猪源葡萄球菌的分离鉴定及耐药性分析
2024-05-09李燕玲陈渊泉谢明杰周伦江陈秋勇连春红王隆柏
李燕玲,陈渊泉,谢明杰,周伦江,陈秋勇,连春红,李 健,王隆柏*
(1.福建农林大学 福建省兽医中药与动物保健重点实验室,福建福州 350002;2.福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心,福建福州 350013;3.仙游县畜牧兽医局,福建莆田 351299)
葡萄球菌(Staphylococcus)为革兰氏阳性菌,无荚膜和芽孢,其对环境有较强的抵抗力,致病性高,尤其当动物机体的免疫力减弱或皮肤受损时,病原可乘虚而入,产生肠毒素、皮肤坏死毒素、凝固酶等多种毒力因子造成动物感染[1-2]。猪葡萄球菌病是由于猪感染金黄色葡萄球菌或葡萄球菌而引发的细菌性疾病[3],感染前者会导致猪乳腺炎、乳房脓疱病和坏死性葡萄球菌皮炎[4-5];感染后者的临床症状通常以皮肤疾病为主,育成猪或哺乳母猪感染后病症较轻[6-7]。仔猪常发生葡萄球菌感染,以出生5~10 d的仔猪最为常见[8],临床症状为渗出性皮炎[9],故又称仔猪油皮病[10-11];其他阶段的猪也会感染该病。该病发生无明显季节性,呈散发性,传染源是带菌猪,通过接触传播,当厩舍内细菌达到一定浓度时还可通过空气传播[12-13]。葡萄球菌病在猪场已经成为一种常发疾病,病死率较高,若仔猪感染未死,除了出现皮肤症状外,还会影响其生长发育[14]。
在我国饲料端禁抗的背景下,2022年10月,福建某规模化猪场出现了以高温、颤抖不止和皮肤结痂致脱落、出血为主要症状的发病猪。后经实验室细菌分离,结果分离到1株细菌,通过对该分离菌的生物学特性、致病性以及其耐药性进行一系列研究,最后鉴定分离菌为致病性葡萄球菌,试验结果可为该病的防控提供理论参考和技术支撑。
1 材料与方法
1.1 材料
1.1.1 病料 肝脏、脾脏、淋巴结等组织病料采自福建某规模猪场的发病猪只,病料经猪瘟病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪圆环病毒等病原检测为阴性。
1.1.2 试验用动物 健康的25日龄仔猪,购自福建福州某规模猪场。
1.1.3 主要试剂 革兰氏染液、血琼脂平板、乳糖、甘露醇、硝酸盐肉汤等微量生化发酵管,青岛高科技工业园海博生物技术有限公司产品;细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司产品;青霉素、头孢曲松、四环素等30种药敏片,常德比克曼科技有限公司产品;车前草、五味子、艾草等24种中药,广东合百草制药有限公司产品;单宁酸和五信子多酚2种中草药提取物,西安小草植物科技有限责任公司产品;百毒杀,上海派斯德生化有限公司产品;84消毒液,新洁尔灭,甲酚皂,山东利尔康医疗科技股份有限公司产品;月苄三甲氯铵,复合酚,成都民生消毒剂有限责任公司产品;戊二醛癸甲溴铵,洛阳享尔生物科技有限公司产品;聚维酮碘,上海全宇生物科技(驻马店)动物药业有限公司产品。
1.1.4 主要仪器 超净工作台(DL-CJ-ZNDI),北京东联哈尔仪器制造有限公司产品;全温培养摇床(QYC-200),上海新苗医疗器械制造有限公司产品;培养箱(9080),上海精宏实验设备有限公司产品;梯度PCR仪(TaKaRa TP600国产),北京宝日医生物技术有限公司产品。
1.2 方法
1.2.1 病原菌的分离纯化 将病料用一次性接种环划线接种于血琼脂平板上,置37℃培养箱内培养24~48 h,挑取单个完整的菌落进行纯化培养后,革兰氏染色镜检。
1.2.2 生化试验 将纯化好的菌落分别按照说明书的方法和步骤接种于乳糖、甘露醇、硝酸盐肉汤等17种微量生化发酵管中,置37℃培养18~48 h后观察结果。
1.2.3 PCR鉴定 按照文献[15]进行。细菌基因组DNA提取按照试剂盒操作说明进行,根据猪葡萄球菌16SrRNA基因序列设计引物,扩增片段长度995 bp,PCR扩增产物送至铂尚生物技术(上海)有限公司测序。反应体系(25 μL):Master Mix 2X 12.5 μL,H2O 7.5 μL,上、下游引物各1 μL,模板3 μL。PCR反应程序:94℃ 5 min;94℃ 40 s,54℃ 40 s,72℃ 40 s,35个循环;72℃延伸10 min。测序结果进行Blast比对,用MegAlign、MEGA软件进行同源性分析。
1.2.4 药敏试验 对分离到的细菌进行药物敏感性试验。药物敏感性判定标准为:抑菌圈直径≥15 mm为+++,表明细菌对该药物高度敏感;10 mm≤抑菌圈直径<15 mm为++,表明细菌对该药物中度敏感;0 mm<抑菌圈直径<10 mm为+,表明细菌对该药物低度敏感;抑菌圈直径=0 mm为-,表明细菌对该药物不敏感或耐药。
1.2.4.1 西药药敏试验 将纯化菌落均匀涂布于血琼脂平板表面,选取青霉素、庆大霉素、四环素等30种西药药敏片贴到已涂布好细菌的平板表面,一个平板贴6种药敏片,于37℃培养18 h后,观察测量抑菌圈的大小。
1.2.4.2 中药药敏试验 中药药敏片的制备:26种中草药各取50 g加蒸馏水250~500 mL室温浸泡1 h后煎沸,沸后文火煎煮至50 mL左右后倒出,再加250~500 mL蒸馏水熬煮至大约50 mL后倒出,合并两次所得滤液再次熬煮浓缩至50 mL后,装入已煮沸消毒过的瓶中,于4℃冰箱中保存备用[16-17]。将空白药敏纸片分别浸泡于药液中,保证每片药敏片均浸泡于药液中,期间不时翻动药敏片,浸泡约2 h后,置烘箱烘干,期间反复翻转药敏片,烘好后装入已消毒的瓶中,于4℃冰箱中保存备用[18]。
将纯化好的菌落均匀涂布于血琼脂平板表面,选取车前草、五味子和单宁酸等26种中药药敏片贴到已经涂布好细菌的平板表面,一个平板贴6种药敏片,于37℃培养18 h后,观察测量抑菌圈的大小。
1.2.5 消毒剂消杀试验
1.2.5.1 菌液的制备 挑取纯化好后的单菌落于TSB溶液中,在220 r/min、37℃恒温振荡培养16~24 h即制得菌悬液,再用麦氏比浊管计算出菌液浓度,最后调整其浓度为108CFU/mL。
1.2.5.2 消毒剂消杀试验 百毒杀按照1∶500、1∶1 000、1∶2 000、1∶5 000、1∶10 000稀释;84消毒液按照1∶200、1∶300、1∶400、1∶500、1∶1 000稀释;月苄三甲氯铵按1∶20、1∶30、1∶100、1∶150、1∶300稀释;复合酚按1∶30、1∶60、1∶90、1∶300、1∶600稀释;戊二醛癸甲溴铵按1∶500、1∶1 000、1∶1 500、1∶2 000、1∶3 000、1∶4 000稀释;聚维酮碘按1∶10、1∶20、1∶100、1∶200、1∶1 000稀释。以上6种消毒液稀释后与菌液以9∶1混匀作用20 min;新洁尔灭按照1∶10、1∶15、1∶30、1∶50稀释后与菌液以9∶1混匀作用2~3 min;甲酚皂按照1∶2、1∶3、1∶5、1∶10、1∶20,1∶30稀释后与菌液以9∶1混匀作用30 min。作用结束后用划线法接种在平板上,于37℃培养18 h后,观察菌落生长情况。
1.2.6 耐药基因检测 参照文献[19]合成引物(cfr、tetM、floR、mcr-1、blaNDM-1、optrA)见表1,细菌基因组DNA提取步骤及扩增程序同1.2.3。扩增产物使用1.5%的琼脂糖凝胶电泳进行检测。

表1 葡萄球菌耐药基因引物序列
1.2.7 动物攻毒试验 将10头25日龄的仔猪按照每组5头随机分成2组,分别为试验组和对照组,试验组以菌液浓度2×107CFU/mL进行颈部肌肉注射1 mL,对照组注射同等剂量的生理盐水,观察攻毒后96h内仔猪的临床症状并记录仔猪体温、精神状态和采食情况等。
2 结果
2.1 病原菌的分离纯化结果
从病料分离到1株细菌(图1A),分离纯化后在血琼脂培养基上培养得到单个呈圆形、中等大小、直径为0.8~1.0 μm的菌落,不透明,呈乳白色到金黄色之间。经革兰氏染色后呈蓝紫色,显微镜下观察为葡萄串样排列的球形菌体(图1B)。

A.血琼脂培养基菌落形态;B.革兰氏染色镜检结果(10×100)
2.2 生化试验结果
经17项生化试验发现该分离菌可分解麦芽糖、果糖、葡萄糖、蔗糖,不能分解乳糖和甘露醇,硝酸盐肉汤、明胶、淀粉水解、MR、尿素酶、过氧化氢酶反应为阳性,硫化氢、蛋白胨、西蒙氏枸橼酸盐、VP、氧化酶试纸反应为阴性。结果与葡萄球菌的生化特征一致。部分结果见图2。

A.尿素酶阳性;B.葡萄糖阳性;C.西蒙氏枸橼酸盐阴性;D.乳糖发酵阴性
2.3 PCR鉴定结果
分离菌PCR扩增结果如图3所示,获得大约970 bp大小的目的条带。用MegAlign软件进行同源性分析结果如图4所示,该分离株与8株葡萄球菌属同源性在98.9%~99.3%之间,由MEGA软件构建的系统进化树如图5,表明该分离株与葡萄球菌在同一大分支上,与MW341442最为相似。综上可进一步说明该分离菌株为葡萄球菌。

1.被检样本;2、3.阳性对照;4.阴性对照;M.DNA标准DL 2 000
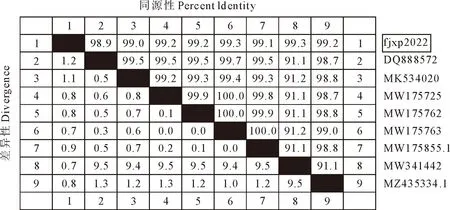
图4 分离菌同源性分析结果
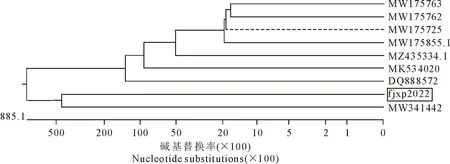
图5 分离菌株系统进化树的构建
2.4 药敏试验
2.4.1 西药药敏试验结果 由表2可见,该葡萄球菌对苯唑西林、6种头孢类药物、米诺环素、诺氟沙星、环丙沙星、氯霉素、左氧氟沙星、亚胺培南和强力霉素等14种药物高度敏感,对阿米卡星、庆大霉素、四环素、万古霉素和氟苯尼考等5种药物中度敏感,但对其他11种药物表现出一定的耐药性。

表2 药敏试验结果
2.4.2 中药药敏试验结果 该菌对单宁酸高度敏感,对五味子、五信子多酚中度敏感,对叶下珠、厚朴、虎杖低度敏感,对半边莲、铁苋菜、三叶草、鱼腥草、使君子、桔梗、辛夷、穿心莲、姜黄、枳壳、蒲公英、车前草、艾叶、重楼、泽泻、黄精、铁苋菜粉、博落回散、抗毒先锋(VA、VE、Vk3、VB6、VB12、生物活性物)等20种中药不敏感。
2.5 消毒剂消杀试验结果
84消毒液对该菌的消杀效果差,在1∶200~1∶1 000稀释浓度内均无消杀效果;甲酚皂在1∶2和1∶3稀释浓度对该菌有消杀效果,1∶5~1∶30稀释浓度对该菌无消杀效果;聚维酮碘在1∶10和1∶20稀释浓度对该菌有消杀效果,1∶100~1∶1 000稀释浓度对该菌无消杀效果;百毒杀在1∶10 000稀释浓度对该菌无消杀效果,在1∶500~1∶5 000稀释浓度对该菌均有消杀效果;戊二醛癸甲溴铵在1∶500~1∶2 000稀释浓度对该菌有良好消杀效果,在1∶3 000和1∶4 000稀释浓度对该菌无消杀效果;新洁尔灭在1∶10~1∶50稀释、月苄三甲氯铵在1∶20~1∶300稀释、复合酚在1∶30~1∶600稀释浓度对该菌都有消杀效果。
2.6 耐药基因检测结果
耐药基因检测结果为阴性,说明分离菌株不携带cfr、tetM、floR、mcr-1、blaNDM-1和optrA耐药基因。
2.7 动物攻毒试验结果
2.7.1 临床症状 攻毒后24 h,葡萄球菌攻毒组全部仔猪体温升高,均在40.5℃左右,出现精神萎靡、食欲减退,个别呕吐,1头死亡;攻毒后72 h,葡萄球菌攻毒组有2头仔猪出现全身结痂、渗出性皮炎、体温升高的现象;攻毒后96 h,葡萄球菌攻毒组仔猪体温回归正常,但都出现有皮肤结痂现象。对照组仔猪的精神状态及采食情况都正常,也未出现结痂现象。试验表明分离葡萄球菌对仔猪具有致病性。
2.7.2 病理切片结果 由结果可得,发病仔猪的脾脏可见白髓、红髓和小梁结构,其中红髓区域可见轻度至中度淤血,间质见中量急性炎症细胞(图6B),对照组正常(图6A);发病仔猪的肺脏包括各级支气管、肺泡等结构,肺泡上皮轻度增生,肺泡间隔增宽,肺泡腔内见红细胞渗出及少量粉染的渗出物(图6D),对照组正常(图6C)。

A.脾脏对照组;B.脾脏攻毒组;C.肺脏对照组;D.肺脏攻毒组
3 讨论
2021年7月1日开始,我国在养殖饲料端全面禁止添加抗生素,给畜禽养殖防控细菌病的发生增加了难度。本研究从疑似发生仔猪渗出性皮炎的仔猪中分离到1株细菌,通过对分离菌株进行的细菌形态结构、菌落特征、革兰氏染色镜检、生化试验、PCR鉴定、动物攻毒试验临床特征等试验结果,分离的细菌为葡萄球菌,且能导致仔猪发病死亡,对仔猪具有高致病性。通过中、西药两类药敏试验显示,该菌对30种临床常用抗生素中的头孢类、诺氟沙星、亚胺培南、氯霉素等14种药物高度敏感,对四环素、万古霉素、阿米卡星等5种药物呈现中度敏感,对其他11种药物表现为一定的耐药性,不存在cfr、tetM、floR、mcr-1、blaNDM-1、optrA等6种耐药基因。根据26种中药药敏试验结果显示,该菌对单宁酸高度敏感,对五味子、五信子多酚中度敏感,对叶下珠、厚朴、虎杖低度敏感,对其余20种中药不敏感。本试验发病猪场采用研究药敏结果进行紧急防控,7 d后疫情得到很好的控制,获得良好的防治效果。鉴此,对于如何有效防治该病的发生,笔者认为,一是在猪群疫病防控的管理过程中,要坚持“以预防为主,治疗为辅”的原则,对发病猪群要做到早发现、早诊断、快治疗;二是加强猪群的饲养管理措施,包括对猪舍温度、湿度和通风的管理,以提高猪群的免疫功能;三是要强化生物安全防控措,做好“人、车、猪、物、料”的消毒管控工作,切断病原传播途径,降低养殖业的经济损失。本研究结果可为今后生猪养殖场在临床上防治猪葡萄球菌病提供理论依据和技术支撑。
