陕西部分地区长角血蜱的鉴定及其基因多态性
2024-05-09陆振华李瑞山孙世伟邵中军
张 琳,贺 真,陆振华,韩 婧,2,周 琦,2,李瑞山,3,孙世伟,4,邵中军*
(1.空军军医大学军事预防医学系流行病学教研室 特殊作业环境危害评估与防治教育部重点实验室,陕西西安 710032;2.陕西中医药大学,陕西西安 712046;3.甘肃中医药大学,甘肃兰州 730101;4.包头医学院,内蒙古包头 014040)
蜱(tick)作为仅次于蚊的媒介生物,分布广泛,全世界报道超过800种蜱类[1],在中国已发现有硬蜱科和软蜱科两大类,包含9属129种[2],约占全球蜱类总数的16%。蜱类分布主要呈点状和带状分布,其中东北三省共有2科7属21种[3],青海省蜱类共有27种[4],贵州省现有2科5属12种[5]。蜱种的传统形态学分类主要依据生殖孔的位置,假头基、足基节等形态学特征进行鉴别,虽然有图谱可以借鉴,但是容易出现错误,鉴别难度大[6]。随着分子生物学技术的发展,将传统分类和分子鉴定有机结合,使分类鉴定更加客观、准确,广泛用于蜱种的系统发育学研究[7]。核糖体在生物的生命活动中起着重要作用,蜱虫的核糖体DNA(ribosomal DNA,rDNA)是由小亚基5.8S和18S,大亚基28S,以及非核糖体编码区内转录间隔区ITS(分为ITS1和ITS2)和基因间隔区IGS组成的基因簇[8]。由于核糖体18S和ITS序列在同种蜱的不同地域株间差异小[9],所以被用于蜱种鉴定[10-11]。28S序列在其他物种中也作为研究系统进化的特征序列,如舌形虫[12],螨虫[13]。尽管GenBank数据库中所报道的核糖体基因序列很多,但是对于陕西省长角血蜱(Haemaphysalislongicornis)核糖体的报道很少。本研究对陕西省渭南市和商洛市长角血蜱核糖体DNA进行扩增和比较,对5.8S、18S、28S、ITS1、ITS2序列构建系统发育树,研究基因多态性,从而对研究蜱虫的种群遗传结构以及鉴定和分化提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样本 2022年7月于陕西省渭南市和商洛市,采集寄生在绵羊体表的硬蜱。选取渭南市蜱虫8只,商洛市蜱虫8只,编号01~16。
1.1.2 主要试剂 RLT裂解液(1048449),德国凯杰QIAGEN公司产品;核酸提取试剂盒(T324),西安天隆科技有限公司产品;引物合成和PCR产物测序,奥科鼎盛生物(北京奥科)公司产品;PremixTaq(R004A),日本TaKaRa BIO公司产品;DNA标准DL 2000(3427A),日本TaKaRa BIO公司产品。
1.1.3 主要仪器 体式显微镜(RH-2000),日本浩视(HIROX)公司产品;研磨仪(Tissuelyser-32L),上海净信有限公司产品;全自动核酸提取试剂仪(GeneRotex 96),西安天隆科技有限公司产品;普通PCR仪(Gentier 48S),西安天隆科技有限公司产品;核酸电泳仪(164-5050),美国伯乐Bio-Rad Laboratories公司产品;全自动凝胶成像仪(Gel Doc XR+),美国伯乐Bio-Rad公司产品;常温离心机(Pico17),美国赛默飞世尔科技公司产品;干式恒温器(K30),杭州奥盛仪器有限公司产品。
1.2 方法
1.2.1 蜱种形态学鉴定 将蜱虫在75%乙醇中洗涤后,在体视显微镜下观察,参考《常见医学蜱螨图谱》根据其形态特征进行初步鉴定。
1.2.2 DNA提取 将鉴定后的蜱虫装入1.5 mL的离心管,加入RLT裂解液、小钢珠,在65 Hz、500 s条件下进行研磨。研磨后在56 ℃的干式恒温器里进行加热10 min。在12 000 r/min、1 min条件的常温离心机中进行离心。完成后使用核酸提取试剂盒,按照操作在全自动核酸提取试剂仪中进行核酸提取。
1.2.3 PCR扩增及测序 参考美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)上的蜱虫核糖体基因组,在软件MEGA 11上针对具体序列设计引物,并在Oligo 7软件上进行引物评价。对28S序列进行分段引物设计,分为28S1,28S2,28S3共3对引物。具体的引物序列如表1所示。样本的PCR体系(共50 μL)含有:25 μL的2×PremixTaq,上游引物1 μL,下游引物1 μL,蒸馏水18 μL,5 μL的模板DNA。18S、ITS1、ITS2、28S1、28S2、28S3序列PCR条件设置如下:94 ℃预变性4 min;94 ℃变性40 s,60 ℃退火1 min,72 ℃延伸2 min,35个循环;72℃延伸7 min。5.8S序列PCR条件设置如下:94 ℃预变性4 min;94 ℃变性40 s,50 ℃退火1 min,72 ℃延伸2 min,35个循环;72 ℃延伸7 min。PCR扩增的产物用0.8%琼脂糖凝胶,在220 V、400 mA、30 min的条件下进行电泳,检测扩增效率。合格的PCR产物被送往奥科鼎盛生物公司进行双向一代测序。

表1 长角血蜱PCR扩增中所使用的引物序列
1.2.4 序列比对和基因多态性分析 获得的DNA序列在MEGA 11软件中进行编辑,28S rDNA序列使用DNA Star软件中SeqMan模块进行组装。在GenBank数据库中分别下载不同种属蜱的核糖体序列,使用Clustal W算法对齐所有序列,并删除未对齐的侧翼序列,采用邻接法(Neighbor-Joining,NJ法)进行系统进化树的构建,采用Bootstrap方法,对每棵树进行1 000次的重复测试,在节点处显示百分比。基因多态性用DNA Star软件中MegAlign模块进行分析。
2 结果
2.1 形态特征
肉眼观察,两地共16只蜱均为雌性。体式显微镜镜下可见雌蜱假头宽短,无眼,假头基呈矩形,须肢第2节外缘明显超出假头基腹面宽短,孔区呈卵圆形,盾板呈亚圆形,无花斑,边缘弧形或微波状,气门板呈圆形,背突短钝,有后肛沟和缘垛。经形态学初步鉴定为长角血蜱。
2.2 长角血蜱各片段电泳结果
本研究共获得15条18S序列,7条ITS1序列,16条5.8S,13条ITS2序列,13条28S序列。长角血蜱18S长度在1 730 bp左右,ITS1长度约1 370 bp,ITS2片段长度在1 620 bp左右,28S-1、28S-2片段长度在1 200 bp左右,28S-3片段长度在1 500 bp左右,5.8S片段长度约175 bp(图1)。
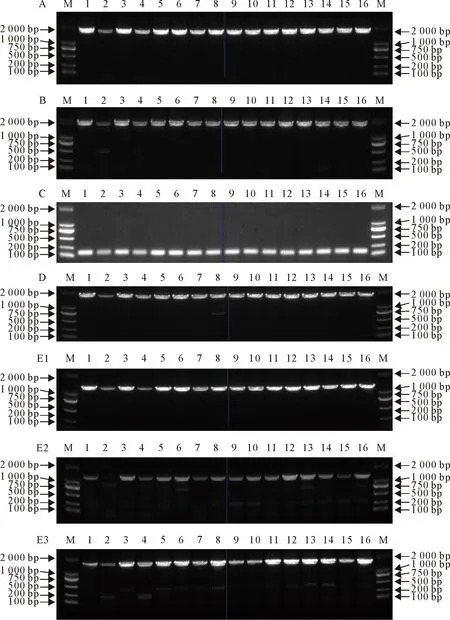
M.DNA标准DL 2000;A.18S片段检测电泳图;B.ITS1片段检测电泳图;C.5.8S片段检测电泳图;D.ITS2片段检测电泳图;E.28S片段检测电泳图,其中E1代表28S-1片段,E2代表28S-2片段,E3代表28S-3片段。
2.3 长角血蜱各序列系统发育分析
18S序列进化树显示,本研究的长角血蜱所有样本在同一分支,与河北、云南的长角血蜱属于不同分支但同处于一个亚群分支,与尼泊尔血蜱和其余不同属的蜱种不在同一分支(如图2)。18S序列不仅可区分不同种属的蜱虫,且不同地域的长角血蜱属于不同分支。本研究的7条ITS1序列与中国6地的长角血蜱ITS1序列同处于一个进化分支,但与罗马尼亚长角血蜱同属于一个根节点,和其他属的蜱属于不同分支(图3)。ITS1序列不能区分中国不同地域的长角血蜱,但与国外长角血蜱属于不同分支,而且可区分不同种属的蜱虫。长角血蜱5.8S序列与各种蜱比较不能形成单独的簇,不能作为区分蜱种的代表序列(图4)。ITS2序列进化树显示,本研究的长角血蜱ITS2序列除04号差异较大外,形成3个亚群分支,02号和10号与中国和日本其他地区的长角血蜱形成同一分支,长角血蜱与其余种属的蜱种区分开来(图5)。ITS2序列不能区分不同地域的长角血蜱,无国内外差异,但可区分不同种属的蜱虫。本研究的13条28S序列同属于一个大的进化分支,与其余种属的蜱虫区分开来(图6)。但由于NCBI上传的长角血蜱28S完整序列较少,无法与其他地域的长角血蜱进行比较,不能判定28S是否能区分地域株。
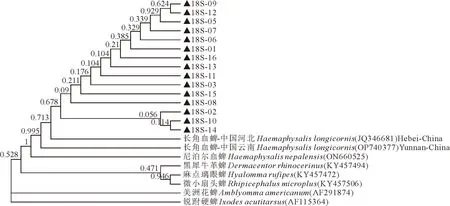
▲.为本研究所获得的序列。▲.The sequence obtained in this study.

▲.为本研究所获得的序列。▲.The sequence obtained in this study.
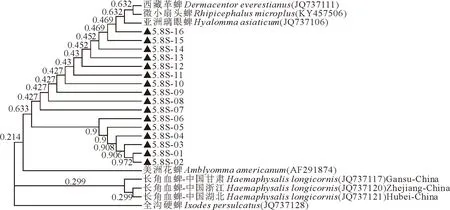
▲.为本研究所获得的序列。▲.The sequence obtained in this study.
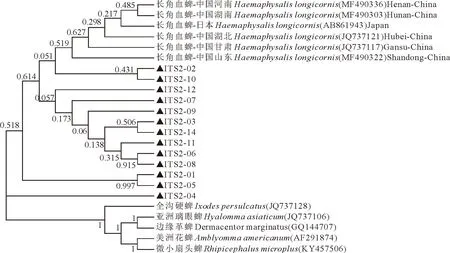
▲.为本研究所获得的序列。▲.The sequence obtained in this study.
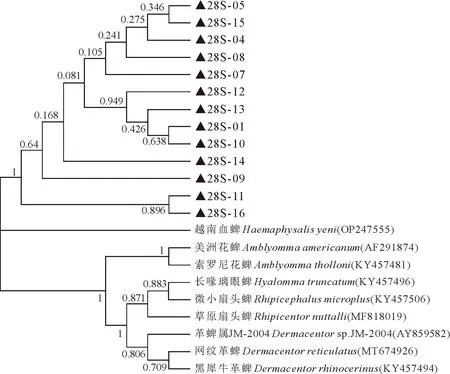
▲.为本研究所获得的序列。▲.The sequence obtained in this study.
2.4 长角血蜱核糖体18S、ITS1、ITS2 rDNA基因多态性分析
应用MegAlign软件对长角血蜱核糖体18S、ITS1、ITS2片段进行多态性分析,如图7所示。18S序列共有10处碱基位点插入,1处G→T突变(图7-A)。ITS1序列共有1处碱基位点插入,2处A→G突变,1处G→A突变,1处C→G突变,1处T→C突变(图7-B)。ITS2序列共有9处碱基位点插入,3处T→C突变,4处G→A突变,3处T→G突变,10处G→C突变,2处C→T突变,4处A→C突变,1处A→T突变,2处C→G突变,1处A→G突变(图7-C)。
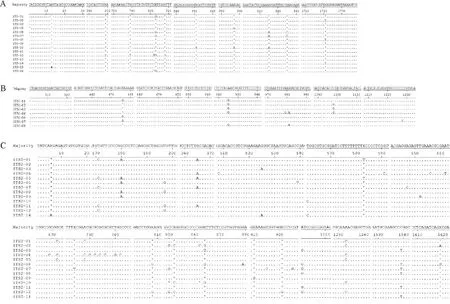
Majority.全部序列中相同位点重复次数最多的序列,图中省略位点相同的基因比对区域;A.18S基因多态性;B.ITS1基因多态性;C.ITS2基因多态性。
3 讨论
陕西省报道的蜱虫有5类属10多种[14],其中长角血蜱为优势种[15]。长角血蜱传播多种病原体,危害很大[16]。本研究对陕西省渭南市和商洛市长角血蜱共16个样本的核糖体DNA进行检测,获得15条18S序列,7条ITS1序列,16条5.8S,13条ITS2序列和13条28S序列。刁沛文等[8]报道,蜱虫的18S、ITS1、5.8S、ITS2、28S片段长度通常为1 784~1 815 bp,407~2 005 bp,152 bp,955~1 707 bp,3 418~4 005 bp[8]。本文中5.8S序列较报道的长,为175 bp,其余序列符合报道长度。研究报道5.8S在个体和物种之间几乎没有差异,18S序列通常作为区分物种的代表性序列[17-18],ITS序列被报道用于鉴定微小扇头蜱[19]。研究结果显示,5.8S序列不能在各个蜱种中进行区分,其余序列均能区分不同种属的蜱虫,ITS2序列无地域差异,ITS1和18S序列可区分国内外地域株,而且18S序列可区分国内不同地域株。18S序列可作为鉴定长角血蜱的遗传标记。通过MegAlign软件对长角血蜱进行基因多态性分析,除18S序列的03、09、11、13号样本不存在基因多态性外,其余18S序列的11个样本以及ITS1和ITS2序列的所有样本均存在多态性。基因多态性与地域环境有关[20]。18S较ITS序列多态性位点少,说明不同序列多态性的区别与序列的保守性有关,18S序列的稳定性也反映了其作为鉴定长角血蜱的优势,进一步证实18S序列可作为鉴定长角血蜱的遗传标记。总之,本研究成功扩增得到陕西省长角血蜱核糖体基因簇单元18S、ITS1、5.8S、ITS2和28S序列全长,并对基因多态性分析,结果表明18S序列区分不同地域株能力最强,可作为蜱虫分类研究和分子鉴定的有效工具。
