H1-SIV、H3-SIV、NA-PRRSV 和EU-PRRSV 多重PCR 检测方法的建立及应用
2024-05-09余良政任同伟郭嘉宁郭金凡黄崇强欧阳康黄伟坚韦祖樟
徐 毅,余良政,林 霜,任同伟,王 豪,曾 昊,郭嘉宁,郭金凡,黄崇强,欧阳康,黄伟坚,韦祖樟,陈 樱
(广西大学动物传染病与分子免疫学实验室 广西大学动物科学技术学院,南宁 530004)
规模化养殖模式下,猪群间导致多种呼吸道疾病的病毒传播能力显著增强,混合感染的现象频频发生,猪流感病毒(Swine influenza virus, SIV)和猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)混合感染的现象在全国范围内都非常普遍,对多地区猪群的调查显示SIV和PRRSV之间以及不同亚型SIV和不同基因型PRRSV之间的混合感染情况日渐严峻。
PRRSV可引起猪繁殖和呼吸功能障碍的猪繁殖与呼吸综合征,临床症状多为母猪怀孕后期发生流产,产死胎和木乃伊胎,幼龄仔猪多因呼吸系统疾病而大量死亡[1]。我国于1996年首次分离到PRRSV美洲型的经典株,2006年分离到PRRSV美洲型高致病性变异毒株,2011年分离并鉴定出致病性的PRRSV欧洲型毒株。在中国PPRSV流行毒株主要以美洲型的经典株和高致病性变异株为主[2],但是近些年,有报道证实我国部分省份的欧洲型PRRSV阳性检出率开始呈现上升态势[3]。猪只感染了PRRSV后免疫力下降,导致SIV的感染风险大大增加。猪流感(swine influenza, SI)是一种急性、热性、高度接触性的呼吸道传染病,通常在猪场内呈现地方性的流行或者大规模的暴发,临床症状以咳嗽、呼吸困难、蜷缩为主要特征。目前世界范围内流行的SIV主要为H1N1、H1N2和H3N2三种亚型。不同年龄、性别和品种的猪均能够感染SIV,猪群感染率高达100%,由其引起的死亡率却非常低[4],但是由于与PRRSV等其他病原共感染,导致患病猪的严重程度增加,死亡率也会随之增高。值得关注的是,作为不同宿主来源毒株间发生基因重组的“混合容器”,猪呼吸道上皮同时存在人流感病毒结合型(唾 液酸α-2,6-半乳糖苷,SAα-2,6-Gal)和禽流感病毒结合型(唾液酸α-2,3-半乳糖苷,SAα-2,3-Gal)两类唾液酸受体,能够重配出具有感染人风险的新型流感病毒,对人类健康构成了重大的威胁。
两种病毒均能引起猪的呼吸道症状,感染初期难以鉴别诊断[5]。多重PCR方法(multiplex PCR,M-PCR)是基于普通PCR方法开发出来的一种更加高效的病原鉴定方法,多重PCR方法只需一次PCR反应,便可以同时鉴别出多种病原体[6]。与电镜观察、病毒分离、免疫组织化学、ELISA血清学检测、荧光抗体技术等常用的诊断手段相比,多重PCR检测方法降低了操作难度,减少了操作时间、劳动力和成本,提高了检测效率[7]。因此,H1-SIV、H3-SIV和欧洲型、美洲型PRRSV四重PCR检测方法的建立将有助于科研工作者高效地开展分子流行病学调查工作,及时了解猪群中病毒流行趋势,避免漏检、误诊并针对病毒亚型及时采取应对措施,防止混合感染进化出具有高致病力甚至感染人的新型SIV毒株及新的PRRSV变异株,进一步为猪群疫病净化及免疫保护甚至是公共卫生安全保障提供可靠的策略。
1 材料与方法
1.1 样品与质粒 重组质粒标准品pMD18T-CZ7HA(H1亚型)、pMD18T-JG13HA(H3亚型)、pMD18T-GX1396MN(NA型)、pMD18T-SHEMN(EU型)均由本实验室构建保存;非洲猪瘟病毒(African swine fever virus, ASFV)、猪伪狂犬病病毒(Porcine pseudorabies virus, PRV)、猪圆环病毒(Porcine circovirus, PCV)、猪轮状病毒(Porcine Rotavirus, PRoV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)、猪星状病毒(Porcine Astrovirus, PAstV)阳性病料均由本实验室收集保存。H1-SIV、H3-SIV、NA-PRRSV、EU-PRRSV细胞培养物由本实验室保存。CSFV活疫苗(细胞源)购自乾元浩生物股份有限公司。
1.2 主要试剂与仪器 DNA聚合酶(DreamTaqHot Start Green PCR Master Mix)购自美国Thermo Scientific公司;反转录酶(Reverse Transcriptase M-MLV)、脱氧核糖核苷三磷酸(dNTP Mixture)购自日本TaKaRa公司;RNA酶抑制剂(RNase Inhibitor)、3×32孔PCR热循环仪(ProFlexTM)购自美国Applied Biosystems公司;病毒核酸提取试剂盒(AxyPrep Body Fluid Viral DNA/RNA Miniprep Kit)购自美国Corning公司;DNA凝胶电泳常规琼脂糖(Regular Agarose)购自西班牙Biowest公司。
1.3 引物设计与合成 根据GenBank公布的病毒全基因组序列,通过大量模板序列的对比,针对H1-SIV、H3-SIV的HA基因和NA-PRRSV、EU-PRRSV的N、M基因的保守区域,应用Primer Premier 5.0分别设计了四对特异性扩增引物(见表1)。引物送至北京擎科生物科技有限公司合成。

表1 多重PCR 引物序列Table 1 Sequences of primer for multiplex PCR

表2 应用多重PCR 方法对临床病料的检测Table 2 Results of clinical samples detected by multiple PCR
1.4 病毒核酸的提取及反转录
1.4.1 RNA或DNA的提取 病毒细胞培养物或者阳性临床样品于-80℃反复冻融3次后进行病毒核酸的提取。利用病毒核酸提取试剂盒AxyPrep Body Fluid Viral DNA/RNA Miniprep Kit提取ASFV、PRV和PCV的DNA以及提取H1-SIV、H3-SIV、NA-PRRSV、EU-PRRSV、PRoV、PEDV、PAstV的RNA。
1.4.2 反转录合成cDNA RNA病毒在核酸提取之后,仍需进一步反转录以获得cDNA样本。于200 μL无菌EP管中依次加入总RNA模板8 µL,5×Reverse Transcriptase M-MLV Buffer 2.5 µL,dNTP Mixture(2.5 mmol/L)1 µL,反转录引物0.5 µL,Reverse Transcriptase M-MLV 0.25 µL,RNase Inhibitor 0.25 µL,总体积为12.5 µL,反应条件为42℃反应1 h,待反应结束后,将所得的cDNA置于-80℃保存备用。
1.5 多重PCR反应条件的优化 以实验室前期构建的4种重组质粒作为标准品模板,用设计的4对特异性引物在同一反应体系中进行PCR扩增,建立总体积为25 µL的多重PCR反应体系。此外,仍需对多重PCR的退火温度(分别为47.5℃、49.5℃、51.5℃、53.5℃、55.5℃、57.5℃),上、下游引物的浓度(终浓度分别为0.125、0.25、0.375、0.50、0.625、0.75 pmol/µL),循环数(分别为25、30、32、34、36、38、40、45个循环)等反应条件进行优化。
1.6 多重PCR的特异性、敏感性、重复性试验 首先,以重组质粒标准品pMD18T-CZ7HA、pMD18TJG13HA、pMD18T-GX1396MN、pMD18T-SHEMN和PRoV、PEDV、PAstV、CSFV的cDNA以及ASFV、PRV、PCV的DNA作为模板,灭菌ddH2O作为阴性对照,对所建立的多重PCR进行特异性试验。其次,将上述4种重组质粒标准品等比例混合后,10倍比稀释成浓度为9.86×109~9.86×100copies/μL,对所建立的多重PCR进行敏感性试验。最后,随机选择同一浓度的4种重组质粒标准品等比例混合成9.86×107copies/μL,对所建立的多重PCR进行重复性试验。所有反应结束之后,均吸取10 µL PCR终产物,点样于1.5%的琼脂凝胶电泳板孔中,140 V电压,电泳约20 min,于凝胶成像仪紫外成像后分析判定。
1.7 多重PCR方法的临床应用 2020—2021年在广西各地出现明显呼吸道症状的猪群中,采集病死猪的肺脏组织共计155份,应用所建立的多重PCR方法检测H1-SIV、H3-SIV、NA-PRRSV、EU-PRRSV。
2 结果
2.1 多重PCR退火温度的优化 建立25 µL多重PCR反应体系:DreamTaqHot Start Green PCR Master Mix 12.5 µL,4对特异性引物(25 pmol/μL)均为0.5 µL,4种重组质粒标准品等比例混合物2.5 μL,灭菌ddH2O 6 µL。扩增反应程序为:95℃预变性5 min;95℃变性30 s,退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。其中,退火温度分别设置为47.5℃、49.5℃、51.5℃、53.5℃、55.5℃和57.5℃。结果显示在退火温度为53.5℃时4条特异性条带扩增效果均较好,所以最终选取53.5℃作为最适退火温度(图1)。

图1 多重PCR 退火温度的优化Fig.1 Optimization for annealing temperatures of the multiplex PCR
2.2 引物浓度的优化 在25 µL多重PCR反应体系中,固定退火温度为53.5℃,将4对特异性上、下游引物终浓度以0.125、0.25、0.375、0.50、0.625和0.75 pmol/μL为6组不同的引物浓度,进行排列组合,其他条件固定不变,进行多重PCR以选出最佳引物浓度。经过优化,H1-SIV、H3-SIV、NA-PRRSV引物对的最佳终浓度为0.375 pmol/μL,EU-PRRSV引物对的最佳终浓度为0.50 pmol/μL(图2)。
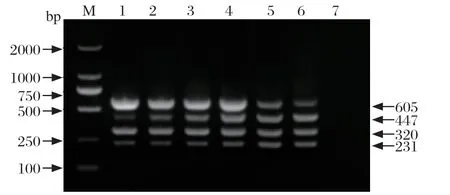
图2 多重PCR 引物浓度的优化Fig.2 Optimization for primer concentrations of the multiplex RT-PCR
2.3 循环数的优化 建立25 μL多重PCR反应体系,固定最佳退火温度和最佳引物浓度,保持其他条件不变,将循环数分别设置为25、30、32、34、36、38、40和45个循环,进行多重PCR。结果表明,当循环数为30~40时,扩增条带均能够保证清晰明亮,最后选择30作为最适循环数(图3)。
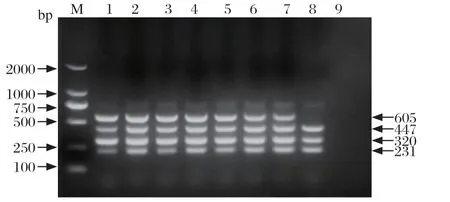
图3 多重PCR 循环数的优化Fig. 3 Optimization for cycles of the multiplex RT-PCR
2.4 多重PCR反应条件的确定 通过摸索并优化反应条件,最终确定25 µL多重PCR反应体系:DreamTaqHot Start Green PCR Master Mix 12.5 µL,H1-SIV、H3-SIV和NA-PRRSV上、下游引物(25 pmol/μL)各0.375 µL,EU-PRRSV上、下游引物(25 pmol/μL)0.5 µL,模板2.5 µL,灭菌ddH2O 6.75 µL。PCR扩增程序:95℃预变性5 min;95℃变性30 s,53.5℃退火30 s,72℃延伸1 min,30个循环;72℃再延伸10 min。
2.5 多重PCR特异性试验 分别以H1-SIV、H3-SIV、NA-PRRSV、EU-PRRSV、PRoV、PEDV、PAstV、CSFV的cDNA以及ASFV、PRV、PCV的DNA作为模板,灭菌ddH2O作为阴性对照,进行多重PCR反应。结果显示,只有H1-SIV、H3-SIV、NA-PRRSV和EU-PRRSV扩增出与相应目的片段大小符合的条带,而PRoV、PEDV、PAstV、CSFV、ASFV、PRV、PCV均未出现扩增条带,表明本试验构建的多重PCR检测方法无交叉反应,具有良好的特异性(图4)。
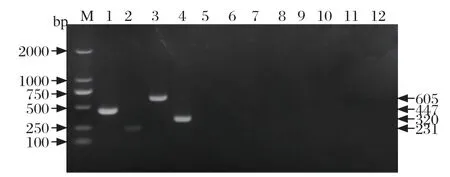
图4 多重PCR 特异性试验Fig.4 Specif icity test of the multiplex PCR
2.6 多重PCR敏感性试验 本研究分别将pMD18TCZ7HA、pMD18T-JG13HA、pMD18T-GX1396MN和pMD18T-SHEMN重组质粒等比例混合后,10倍系列稀释,使得4种重组质粒的终浓度均为9.86×109~9.86×100copies/μL,进行多重PCR。结果表明pMD18T-CZ7HA、pMD18T-JG13HA、pMD18T-GX1396MN和pMD18T-SHEMN的检出下限均为9.86×100copies/μL(图5)。
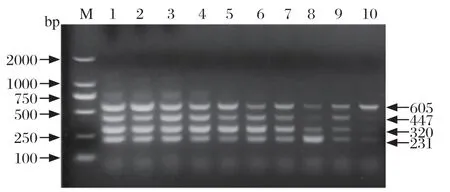
图5 多重PCR 敏感性试验Fig.5 Sensitivity test of the multiplex PCR
2.7 多重PCR重复性试验 选择4种重组质粒混合物或者病毒细胞培养物作为模板,终浓度均为9.86×107copies/μL,其他条件固定不变,进行多重PCR。结果表明,无论模板是质粒还是cDNA,均能够使用本试验构建的多重PCR方法扩增出均匀一致的目的条带,具有良好的重复性(图6)。
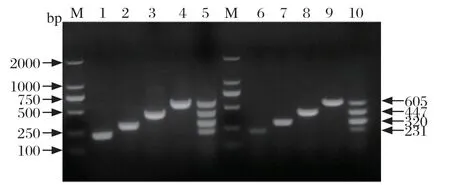
图6 多重PCR 重复性试验Fig.6 Repeatability test of the multiplex PCR
2.8 应用多重PCR对临床样品检测 应用所建立的多重PCR方法,对2020—2021年从广西不同地区采集的1 5 5 份病死猪肺脏组织样品进行检测。结果显示,SIV、PRRSV阳性分别为34份(21.94%)、27份(17.42%);H1-SIV、H3-SIV、NA-PRRSV、EU-PRRSV阳性分别为24份(15.48%)、20份(12.90%)、27份(17.42%)、0份,其中H1-SIV单一阳性13份(8.39%),H3-SIV单一阳性11份(7.11%),NA-PRRSV单一阳性26份(16.77%),H1-SIV和H3-SIV混合阳性9份(5.81%),H1-SIV和NA-PRRSV混合阳性1份(0.65%)。进一步使用单重RT-PCR检测方法对这些临床样品进行检测,所得到的结果和本试验建立的多重PCR方法的检测结果完全一致,符合率为100%。
3 讨论
SIV和PRRSV同为“猪呼吸道疾病综合征(Porcine respiratory disease complex, PRDC)”的原发性致病原之一[8],可引发猪群免疫抑制性疾病,进而导致其他疫病并发或继发感染,加剧患畜病情。近年来,PRRSV和SIV、PRV、PCV、CSFV、PCMV、Mhp等病原体混合感染现象屡见不鲜,其中PRRSV和SIV的共感染趋势日渐严峻。覃绍敏等[9]对广西SIV的混合感染情况调查发现单纯的SIV感染率不高,占26.7%,而SIV感染猪只混合感染其他病原现象非常严重,占73.7%,出现二重、三重甚至四重感染的现象,二重感染中SIV和PRRSV混合感染占6.67%。李吉达等[10]对广西、上海、河南、江苏、浙江、湖南、山东、河北、江西、福建收集的临床样品检测发现PRRSV阳性样品存在混合感染情况,与SIV、PRV、CSFV、PCV、PCMV的混合感染中双重感染率最高(62.5%),PRRSV和SIV的混合感染占53.1%,并存在三重、四重、五重、六重感染,而单纯的PRRSV感染仅占2.27%。骆永泉[11]对广西贺州PRRSV进行监测时发现变异株占多数,且混合感染现象非常严重,存在PRRSV和SIV二重感染,PRRSV和PCV2二重感染,PRRSV、SIV和PCV2三重感染现象,混合模式主要为二重感染,其中变异株占总的PRRSV阳性的66.7%,PRRSV和SIV混合感染占32.07%。不仅SIV和PRRSV混合感染现象普遍,也存在SIV不同亚型和PRRSV不同基因型之间的混合感染。李冰等[2]对183份样品检测发现存在美洲型经典株2份,美洲型变异株31份,欧洲型毒株3份,美洲型变异株和欧洲型毒株混合感染1份。付新亮等[12]对广西、广东两省猪群采集的3265份临床样品进行抗体检测,发现了不同亚型SIV之间有较为严重的混合感染现象,其中EA H1N1和pdm09、EA H1N1和H3N2 SIV之间混合感染率较高,分别占11.3%(369份)、10.01%(327份),此外还有三种亚型之间的混合感染,占4.65%(152份)。近十多年来,全国范围内单一病毒感染现象逐渐被多重病毒混合感染替代,这提示我们使用单一PCR检测方法可能存在漏检,不能正确反应病毒流行事实,多重感染已经是猪场的常见发病模式,严重制约了生猪养殖产业的健康发展。
当前,已有一些学者建立了不同类型的多重PCR鉴别检测方法。韦冠东等[13]建立了检测SIV、PRRSV、ASFV的三重PCR方法。王洪光等[14]建立了SIV和PRRSV的双重检测方法。杨焕良等[15]建立了检测H1N1、H1N2、H3N2型SIV的多重PCR方法。李冰等[2]设计了两对特异性引物,用来扩增美洲型经典型毒株、变异型毒株以及欧洲型经典毒株。史喜菊等[16]最新建立的SIV、NA-PRRSV和EU-PRRSV的多重荧光RT-PCR方法,未能鉴别SIV的毒株类型。由于不同基因型PRRSV和不同亚型SIV之间的混合感染越来越普遍,特别是人因流感结合型受体也能感染SIV,为了满足猪场疫病防控及临床诊断,维护公共卫生安全的迫切需要,本试验建立了同时针对H1和H3亚型SIV以及欧洲型和美洲型PRRSV鉴别的多重PCR方法,以筛查猪场中的SIV和PRRSV及混合感染情况,为早期诊断和鉴别提供有力工具。
应用建立的多重PCR方法对广西155份临床样品检测,证实了存在二重混合感染(H1-SIV+H3-SIV)、(H1-SIV+NA-PRRSV),分别占5.81%、0.65%。检测结果表明,H1-SIV和H3-SIV仍然广泛存在于广西地区,这与我们近些年的SIV分子流行病学调查数据相一致,且两种亚型SIV在猪只体内混合感染。不同亚型病毒在感染猪体内易基因重配,可能导致重组进化出具有大规模爆发的潜力的强致病力新型毒株,感染人的风险随之增加。单一NAPRRSV感染的检出率为16.77%,检出率最高,NAPRRSV在猪群中的潜在威胁相对较高,且已与SIV的共感染,由于突变和重组是PRRSV进化的重要策略[17],这可能导致产生新的PRRSV变异株。未检到EU-PRRSV,在一定程度上说明目前广西地区广泛流行的PRRSV是美洲型,与当前全国范围内的流行趋势相一致。以上结果表明,当前广西的混合感染严重程度较低,应密切监测病毒流行现状和趋势。在生产中,应结合猪场实际情况,针对不同病毒亚型,主要免疫H1-SIV疫苗、H3-SIV疫苗和NAPRRSV疫苗,重点监测EU-PRRSV,防止这些病毒流动传播至广西并大规模流行。病毒流动频率和范围增加使得混合类型多样化,临床区分困难,传统或落后的诊断方法易造成误诊、滥用抗生素等药物的现象,掩盖并拖延病情使得大规模疫病暴发的风险大大增加,使用建立的多重PCR方法对临床分型极为便利,一次操作就能检测出不同亚型病毒,无论在病毒混合模式的分子流行病学调查还是临床诊断都有着巨大的优势。
本研究针对H1-SIV、H3-SIV、NA-PRRSV和EU-PRRSV基因序列,分别设计特异性引物,经过对引物浓度、退火温度、扩增循环数等反应条件的优化,成功建立了特异性强、敏感度高、重复性好的多重PCR检测方法,拓宽了临床检测范围,可一次性快速鉴别检测出H1-SIV、H3-SIV、NAPRRSV、EU-PRRSV的感染,大大节约了时间,降低了试剂耗材成本,提高了检测效率,可应用于上述4种病毒的鉴别诊断及流行病学调查。
