羊泰勒虫与嗜吞噬细胞无浆体双重PCR 检测方法的建立
2024-05-09宁宇春王圆赫郭祥杰朱宏阳田万年
宁宇春,王圆赫,郭祥杰,朱宏阳,田万年
(1.吉林农业科技学院动物科技学院,吉林 132101;2.图们市凉水镇畜牧兽医站,图们 133100)
羊泰勒虫病(ovine and caprine theileriosis)是一种经蜱传播的寄生于羊红细胞内血液原虫病[1]。本病对羔羊和外地引进羊危害较严重,病羊多表现为高热、贫血、黄疸和血红蛋白尿,严重时可引起死亡,从而限制了地方性养羊的发展,给我国养羊业造成较大危害[2-3]。嗜吞噬细胞无浆体(A.phagocytophilum, AP)于1932年在苏格兰地区首次发现,引起羊不明发热,是一类经蜱传播的寄生于红细胞内细菌性病原[5]。嗜吞噬细胞无浆体是一种人畜共患传染病,属于自然疫源性疾病,可引起宿主动物贫血,血小板减少,消瘦等临床症状[6-7]。嗜吞噬细胞无浆体可诱导机体发生炎症和免疫反应,同时能够介导免疫活性细胞及炎性因子对宿主细胞的攻击,最终导致机体出现免疫抑制。
以上两种病原都由硬蜱传播,主要发生于媒介硬蜱活动期间,易发生混合感染,且其临床症状表现相似。因此,血液涂片检测易出现漏诊或误诊的弊端,采用PCR检测具有更高的特异性和敏感性,从而使病原体的诊断更加可靠。目前尚未见羊泰勒虫和嗜吞噬细胞无浆体的双重PCR检测方法,本研究旨在通过建立更加快速、特异的双重PCR检测方法,为羊泰勒虫和嗜吞噬细胞无浆体的快速诊断和流行病学调查提供了适用先进技术。
1 材料与方法
1.1 病料来源 血液样本于2020年5月,采自吉林省图们市散养的绵羊60份,无菌采取抗凝血,同时制作血液涂片供镜检,-20℃保存备用。弓形虫、牛瑟氏泰勒虫、无浆体和附红细胞体标准基因组DNA由延边大学农学院薛书江博士惠赠。
1.2 主要试剂 DNA回收试剂盒、血液DNA试剂盒、DL2000 DNA marker均购自天根生化科技(北京)有限公司,TaqPreMix购自华美生物工程有限公司。
1.3 引物设计 根据NCBI已经收录羊泰勒虫MPSP基因(G Q 2 8 1 0 4 4)和 无浆体1 6 S r R N A 基因(JN558815),设计了两对引物。P1上游引物:5'-CACGCTATGTTGTCCAAGAG-3',下游引物:5'-TGTGACACTCAATGCGCCTA-3'。扩增片段大小为875 bp,P2上游引物5'-TCGTGTCGTGAGATGT TGGTT-3',下游引物:5'-TGGCTGCTTCCTT TCGGTTAG-3',片段大小394 bp,以上引物由吉林省库美生物科技有限公司合成。
1.4 双重PCR方法扩增 提取过程依据试剂盒操作手册进行,获取的DNA低温保存。以提取的羊基因组DNA为模板,PCR体系(25 µL)为:ddH2O 9 µL,TaqPreMix 12.5 µL,羊基因组DNA 2.5 µL,MPSP和16S rRNA上、下游引物各0.5µL。反应程序:95℃预变性3 min;94℃变性45 s,54℃退火45 s,72℃延伸30 s,共33个循环;72℃再延伸7 min。阳性PCR产物经回收纯化后送吉林省库美生物科技有限公司测序。
1.5 退火温度的筛选 在54℃~60℃范围内进行双重PCR扩增,筛选出双重PCR最佳的退火温度。
1.6 特异性试验 用优化的双重PCR分别以羊泰勒虫、嗜吞噬细胞无浆体、附红细胞体、弓形虫和瑟氏泰勒虫基因组DNA为模板进行扩增,分析该方法的特异性。
1.7 敏感性试验 用紫外分光光度计测定已提取的羊基因组DNA的D260值,计算DNA含量,进行10倍稀释后,分别进行PCR扩增。
1.8 临床样本的检测 对临床中60份绵羊抗凝血进行双重PCR检测和血涂片镜检,比较两种方法的阳性检出率和阳性符合率。
2 结果
2.1 血涂片镜检 羊血涂片经吉姆萨染色后,经显微镜镜检发现红细胞内呈圆形、杆状和梨籽形虫体,初步诊断红细胞内含有羊泰勒虫和嗜吞噬细胞无浆体(图1)。

图1 血液涂片吉姆萨染色镜检结果(1000×)Fig.1 Microscopic examination of Giemsa stained blood smears (1000×)
2.2 双重PCR方法扩增 用羊泰勒虫和嗜吞噬细胞无浆体引物分别对羊泰勒虫和嗜吞噬细胞无浆体的DNA和混合感染DNA进行PCR扩增,电泳结果显示分别出现875 bp和394 bp特异性条带,与预期结果一致(图2)。

图2 羊泰勒虫和嗜吞噬细胞无浆体PCR 扩增结果Fig.2 PCR amplication result of ovine and caprine theileriosis and AP
2.3 双重PCR退火温度的筛选 通过对不同退火温度的筛选,结果显示在56℃时,羊泰勒虫PCR扩增产物和嗜吞噬细胞无浆体PCR扩增产物目的条带均较亮(图3),56℃为最佳退火温度。
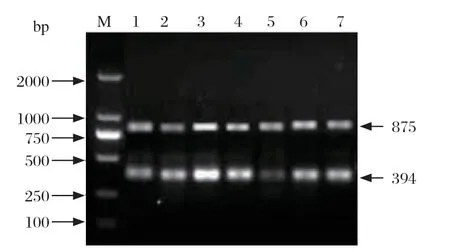
图3 PCR 退火温度的筛选试验Fig.3 Screening test for annealing temperature
2.4 双重PCR特异性试验 将以羊泰勒虫和嗜吞噬细胞无浆体混合感染及单一感染的DNA、附红细胞体、无浆体、弓形虫和瑟氏泰勒虫DNA为模板进行扩增。电泳结果显示,羊泰勒虫和无浆体混合感染和单一感染均可扩增出预期条带,而作为对照样本均无扩增条带出现(图4)。
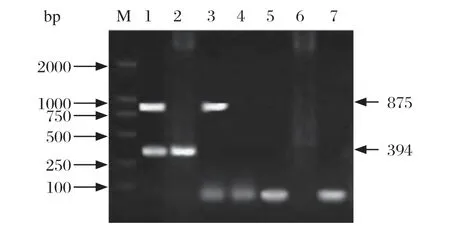
图4 特异性扩增试验Fig.4 The result of specif ic test
2.5 双重PCR敏感性试验 将混合感染羊泰勒虫和嗜吞噬细胞无浆体的抗凝血提取DNA,分光光度法测定DNA浓度,依次做10倍梯度稀释,分别进行双重PCR扩增,反应结果进行琼脂糖凝胶电泳检测(图5)。检测羊泰勒虫DNA最低含量为16 fg/µL,嗜吞噬细胞无浆体的DNA最低含量为1 fg/µL。

图5 敏感性试验Fig.5 The result of sensitivity experiment
2.6 临床样本检测 双重PCR对60份羊血液样本检测显示(表1),嗜吞噬细胞无浆体阳性率为13.33%(8/60),羊泰勒虫阳性率46.67%,混合感染率为10%。血涂片镜检显示,嗜吞噬细胞无浆体阳性率为6.67%,羊泰勒虫阳性率15%,混合感染为5%,双重PCR与血涂片镜检阳性符合率为100%。
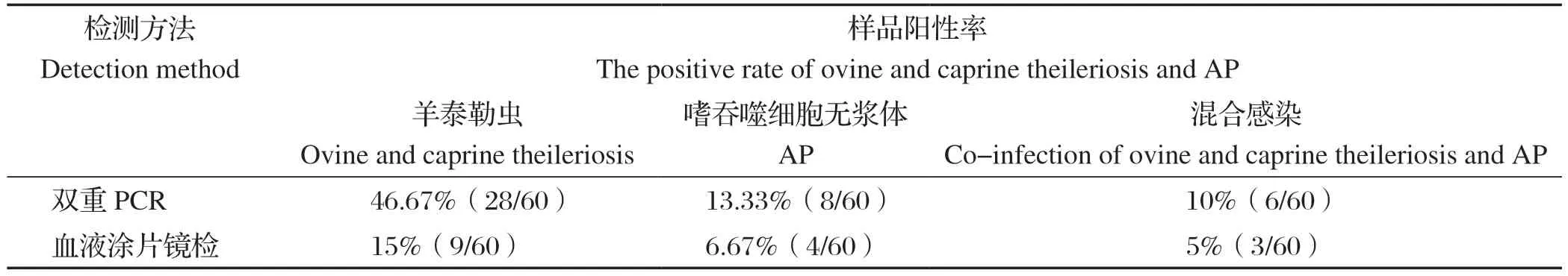
表1 临床样品的检测结果Table 1 Results of PCR assay for clinical samples
3 讨论
目前,对羊泰勒虫和嗜吞噬细胞无浆体的病原检测方法主要有血涂片方法和PCR方法[8-12]。血液涂片检测很难与其他血液病原体区分诊断,且在感染早期,血液中的无浆体数量较少,不易通过血液涂片检测到。血清学检测对抗原和抗体要求较高,还需要筛选多种条件才能建立。分子生物学检测中,荧光定量PCR虽然敏感性、特异性及准确性较高,可以进行定量分析,但存在试剂及实验仪器昂贵的弊端,普通PCR方法因具有操作简单、敏感性高、特异性强的优点被广泛应用于流行病学分析。目前,对某种病原的检测多采用单PCR方法,但一般只能检测一种病原,临床中当多种病原发生混合感染时,应用普通PCR需要多次扩增筛选,费时费力,使检测成本显著增加。本试验所建立的双重PCR表明,该方法不但节约试剂、反应时间,而且还具有高效、经济的特点,更适合在基层兽医部门应用。
羊泰勒虫主要表面蛋白(major piroplasm surface proteins, MPSP)是泰勒虫感染阶段分泌的一种蛋白,是泰勒虫特有的蛋白,具有较好的保守性[13]。嗜吞噬细胞无浆体选取了保守基因16S rRNA基因,这2种基因自身无特异性结合。试验结果表明,无论是普通PCR还是双重PCR扩增除目的条带外均无非特异性扩增出现,不出现交叉反应。李宏旺等[14]对吉林省珲春牛嗜吞噬细胞无形体调查显示,牛东方牛嗜吞噬细胞无形体阳性率为12.5%。应用本试验建立的双重PCR方法对吉林省图们市临床60份绵羊血样本检测,结果显示,羊嗜吞噬细胞无浆体阳性率为13.33%。进一步证明嗜吞噬细胞无浆体在吉林省延边地区流行,丰富了嗜吞噬细胞无浆体流行病学资料。综上,本研究建立了一种可同时检测羊泰勒虫和嗜吞噬细胞无浆体的双重PCR方法,特异性、重复性好,操作简便,可用于两种病原体感染的快速鉴别诊断和分子流行病学调查。
