脂多糖刺激人乳腺上皮细胞SYK及炎症因子的表达变化
2024-05-09刘赛赛卢兴浩陈云帆张小楠赵士弟陈传好
张 铭,仝 洁,刘赛赛,卢兴浩,丁 倩,陈云帆,张小楠,赵士弟,杨 帆,陈传好
(蚌埠医科大学 1.人体解剖学教研室,2.心脑血管疾病基础与临床重点实验室,安徽 蚌埠 233030)
哺乳期乳腺炎是最常见的乳腺组织感染性疾病,好发于产后1个月内,又称产褥性乳腺炎。2021年WHO统计显示,产后8周内乳腺炎的发病率为3%~33%[1]。乳腺炎可导致哺乳期妇女早期断奶,影响母乳儿童短期营养和长期健康[2]。临床上诱发乳腺炎的常见细菌为大肠杆菌,细菌可通过受损乳头进入繁殖而导致急性的乳腺炎发生,脂多糖(LPS)是产生炎症反应的主要成分[3-4]。脾酪氨酸激酶(spleen tyrosine kinase,SYK)在适应性免疫、天然免疫及非免疫性生物学功能中均具有重要作用,它是Toll-样受体信号通路中的重要调控因子之一,参与调节免疫细胞因子白细胞介素(IL)-10和Ⅰ型干扰素分泌[5]。本课题组前期研究利用全基因组关联分析标记SYK为牛乳腺炎重要候选基因[6-7]。但该基因在人乳腺炎症发生发展中的作用尚未见报道。本研究通过qRT-PCR、siRNA等技术,检测LPS诱导MCF-10A细胞炎症反应后SYK及相关炎症因子基因水平表达变化,探讨SYK在LPS诱导的乳腺细胞炎症中的作用。
1 材料与方法
1.1 材料与试剂
1.1.1 实验细胞 人正常乳腺上皮细胞(MCF-10A)购于武汉普诺赛生命科技有限公司,经STR鉴定正确。
1.1.2 主要试剂 LPS来源为Ecoli 055:B5,购自美国Sigma公司;SYK(ab40781)购自英国Abcam公司;SYK(D-3)、TLR2(TL2.1)、TLR4(25)购自美国SANTA公司;IL-1(D3U3E)、NLRP3(D4D8T)购自美国CST公司;无水乙醇、二甲苯购自武汉赛维尔生物科技有限公司;4%多聚甲醛购自上海碧云天生物技术有限公司;胎牛血清、DMEM/F12培养基购自美国Gibco公司;CCK-8试剂盒购自安徽佰欧晶医学科技有限公司;TRIzol、氯仿、FastKing RT Kit反转录试剂盒、SuperReal PreMix Plus试剂盒购自北京天根生化科技有限公司。
1.1.3 主要仪器 超净工作台(苏州智净净化设备有限公司);低温高速离心机(德国Eppendorf公司);Milii-Q纯水机(美国Millipore公司);超微量微孔板分光光度计、梯度PCR仪购自美国Thermo Fisher公司;罗氏实时荧光定量PCR仪(瑞士Roche公司);蔡司荧光倒置显微镜(德国ZEISS公司)。
1.2 方法
1.2.1 细胞培养 使用含5%马血清、20 ng/mL EGF、0.5 μg/mL Hydrocortisone、10 μg/mL Insulin、1% NEAA和1% P/S的DMEM/F12培养基,于5% CO2、37 ℃条件下培养48 h,观察细胞贴壁,更换新培养基。0.25%胰蛋白酶镜下观察消化,细胞传代均匀铺板,镜下观察细胞生长状况,取1~4代指数期增长的正常细胞进行后续实验。
1.2.2 LPS诱导细胞炎症损伤模型 将MCF-10A细胞按5×104个/孔接种至6孔培养板中,细胞密度70%~80%时,利用LPS诱导乳腺上皮细胞炎症,用于总RNA提取。
1.2.3 CCK-8法检测LPS处理后细胞增殖变化 按每孔1×104~3×104密度将MCF-10A细胞接种在96孔培养板中,每孔加完全培养基补足至200 μL,12 h后观察细胞贴壁,细胞密度达到60%进行siRNA实验,转染完成后分别加入含LPS 25、50、100、200 μg/mL的基础培养基,并分别设空白孔(对照组,不加细胞及培养基)、对照孔(siRNA组,无LPS刺激,其余操作同待测孔),每组设置3个重复,每个待测孔加10 μL CCK-8试剂,分别培养1、2、3、4、5 h后,检测450 nm处吸光度用以测定细胞增殖活性。
1.2.4 MCF-10A细胞RNA提取及实时定量PCR扩增 用TRIzol法提取细胞总RNA,紫外分光光度计测定RNA浓度和纯度,按照FastKing RT Kit反转录试剂盒要求操作合成cDNA,以cDNA为模板,按照SuperReal PreMix Plus试剂盒要求操作加样,试验所用引物均由安徽华晓基因科技有限公司合成,引物序列信息见表1。选择GAPDH作为内参基因,用相对定量(ΔΔCT)法计算目的基因相对表达量。
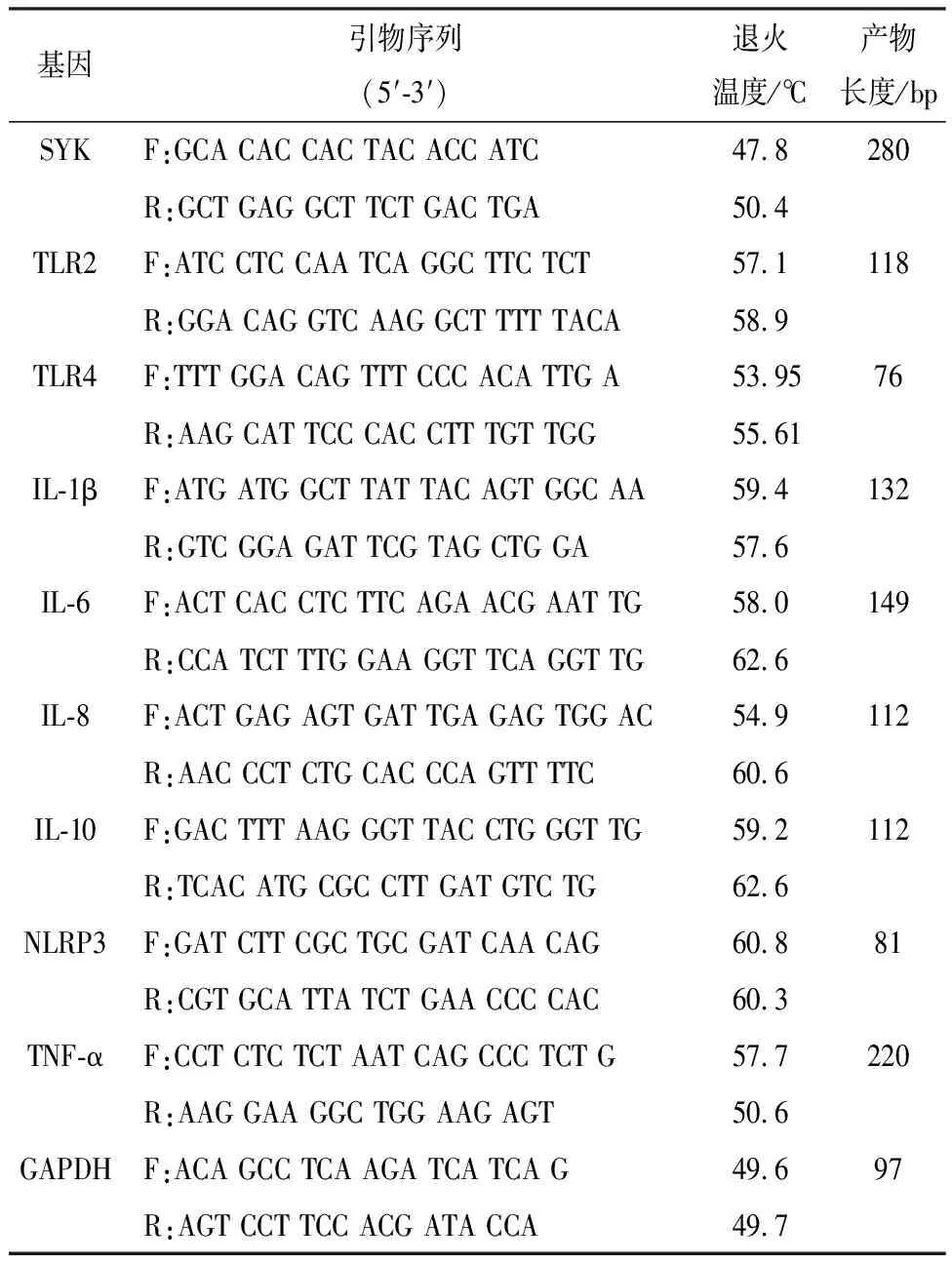
表1 实时荧光定量PCR引物序列
1.2.5 免疫荧光染色 取对数生长期的MCF-10A细胞,按1×105个/孔接种于12孔板中,常规培养24 h后设置实验分组,实验前1 h加入25 μg/mL LPS,12孔板中摇匀。1 h后吸去培养基,PBS中漂洗5 min,4%多聚甲醛固定,PBS中漂洗5 min,加入0.3% Triton X-100封闭。加入SYK、TLR2、TLR4、IL-1β、NLPR3一抗(1∶200),4 ℃孵育过夜。加入荧光二抗兔cy3(1∶150)、荧光二抗鼠Alexa Fluor 488(1∶150),37 ℃孵育2 h后,DAPI复染,PBS中漂洗5 min,晾干后滴加抗荧光猝灭封片剂封片。
1.2.6 转染SYK siRNA 取对数生长期MCF-10A细胞,转染前1 d按4×105个/孔接种6孔培养板中,隔天更换新鲜培养基2 mL。以6孔板一个孔为例,在洁净离心管中加入4 μg质粒DNA到250 μL DMEM溶液,3种质粒DNA(hSYK-299、hSYK-1058、hSYK-2079)分别吹打混匀;另一个洁净离心管加入6 μL LipoFiter3.0,再加入250 μL DMEM混匀后静置5 min;将DNA溶液分别与LipoFiter3.0混合,室温孵育20 min后加入6孔板,其余孔操作同上。
1.3 统计学方法
采用方差分析和q检验。
2 结果
2.1 LPS抑制MCF-10A细胞增殖
通过CCK-8实验观察LPS对MCF-10A细胞增殖抑制作用,结果显示,25 μg/mL LPS诱导1 h后细胞活力正常,与对照组差异无统计学意义(P>0.05),诱导2~5 h后细胞活力均受到抑制(P<0.05);50、100、200 μg/mL LPS刺激1 h开始,细胞活力均较对照组降低(P<0.05)。此外,检测构建的SYK siRNA对MCF-10A细胞活性影响,结果显示,siRNA处理1 h内细胞活力与对照组差异无统计学意义(P>0.05),排除后续siRNA实验转染试剂本身对于实验的干扰(见表2)。
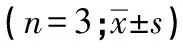
表2 LPS对MCF-10A细胞活力的影响
2.2 LPS刺激增加MCF-10A细胞SYK mRNA表达通过RT-qPCR检测各组MCF-10A细胞中SYK mRNA表达,结果显示,不同浓度梯度(6.25、12.5、25、50、100 μg/mL)LPS中,25 μg/mL LPS刺激下SYK mRNA表达量达到峰值(P<0.05)(见表3);随后检测25 μg/mL LPS不同刺激时间(0.25、0.5、1、2 h)下SYK mRNA表达量,结果显示,刺激时间1 h时SYK mRNA表达到达峰值(P<0.05)(见表4)。
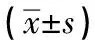
表3 不同LPS刺激浓度的SYK mRNA表达比较
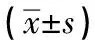
表4 不同LPS刺激时间的SYK mRNA表达比较
根据LPS在MCF-10A细胞内刺激结果,构建3组SYK siRNA序列(hSYK-299、hSYK-1058、hSYK-2079),转染结果显示,与对照组相比,3组siRNA序列组SYK mRNA表达均出现降低(P<0.05),siRNA转染成功;siRNA空载组(NC组)与对照组SYK mRNA表达差异无统计学意义(P>0.05),转染试剂对MCF-10A细胞SYK mRNA表达无明显影响,在后续实验中作为siRNA对照组设置;hSYK-299组SYK mRNA表达均低于hSYK-1058组和hSYK-2079组(P<0.05),选择hSYK-299作为后续实验的敲低组(见表5)。
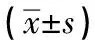
表5 siRNA转染后SYK mRNA表达比较
检测NC、NC+LPS、siRNA(hSYK-299)、siRNA+LPS(hSYK-299+LPS)各组SYKmRNA表达变化,结果显示,敲低SYK基因后,siRNA+LPS组SYK mRNA较NC+LPS组呈现低表达状态(P<0.05)(见表6)。
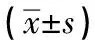
表6 LPS刺激转染后细胞SYK mRNA表达比较
2.3 LPS通过TLR4促进乳腺上皮细胞炎症
通过RT-qPCR检测各组TLR4、TLR2 mRNA表达,结果显示,LPS刺激后,NC+LPS组TLR4 mRNA表达较NC组升高(P<0.05),2组TLR2 mRNA表达水平差异无统计学意义(P>0.05);siRNA敲低SYK后,siRNA+LPS组TLR4 mRNA表达低于NC+LPS组(P<0.05),2组TLR2 mRNA表达差异无统计学意义(P>0.05)(见表7)。
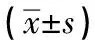
表7 各细胞中TLR2、TLR4 mRNA表达比较
2.4 抑制SYK减轻LPS诱导MCF-10A细胞中细胞因子基因表达
RT-qPCR检测结果显示,25 μg/mL LPS刺激1 h后,NC+LPS组IL-1β、IL-6、IL-8、NLRP3、TNF-α mRNA表达均较NC组升高(P<0.05),2组IL-10 mRNA表达差异无统计学意义(P>0.05);siRNA敲低SYK后,siRNA+LPS组IL-1β、IL-6、NLRP3、TNF-α mRNA表达均较NC+LPS组降低(P<0.05)(见表8)。
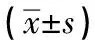
表8 LPS对MCF-10A细胞中各细胞因子mRNA表达水平影响
2.5 抑制SYK减弱LPS诱导MCF-10A细胞中IL-1β和NLRP3荧光表达
免疫荧光观察LPS刺激后细胞因子表达情况,结果显示,25 μg/mL LPS刺激后,NC+LPS组SYK在MCF-10A细胞质内表达较NC组增加,而siRNA+LPS组较NC+LPS组SYK荧光表达降低(见图1)。
NC+LPS组TLR4、IL-1β、NLRP3和SYK荧光表达均较NC组增多(P<0.05),TLR2荧光强度则无明显变化(P>0.05);转染SYK后,siRNA+LPS组IL-1β和NLRP3、SYK荧光表达均较NC+LPS组降低(P<0.05),2组TLR4表达差异无统计学意义(P>0.05)(见表9)。
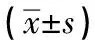
表9 LPS诱导MCF-10A细胞中TLR2、TLR4、IL-1β、NLRP3荧光强度

3 讨论
哺乳期急性乳腺炎主要由细菌感染引起,作为一个复杂的病理过程,致病菌感染后嗜中性粒细胞和淋巴细胞侵入导致促炎因子大量释放,病情的持续发展与早期母乳停养具有高度相关性。母乳喂养可以增加婴儿机体抵抗力,促进肠道正常菌群的生长,因此,不管从家庭还是社会层面,在乳腺炎初期进行干预和治疗有重要意义[2]。然而目前临床治疗仍以抗生素治疗为主,不仅会导致耐药菌株增加,更会对母婴造成潜在危害[8]。SYK作为免疫受体的关键介质,在炎性细胞中表达,通过抑制细胞增殖和分化以及影响细胞因子分泌发挥作用[9]。SYK在LPS刺激后表达上调,已在多种组织中得到验证,如慢性肾小球肾炎中LPS通过SYK/Ras/c-Fos通路引起大鼠系膜细胞炎症和增殖[10];LPS通过RhoA/ROCK-ezrin/Syk-MyD88/IRAK1轴诱导肺泡上皮细胞炎症和促炎细胞因子产生[11]。本研究结果验证,乳腺上皮细胞中SYK在LPS刺激后表达上调,参与促炎细胞因子产生,抑制SYK表达则可降低促炎细胞因子产生,推测SYK与LPS乳腺上皮细胞炎症发展密切相关。
TLR信号是重要的炎性通路之一,其下游炎症信号的级联反应往往加速疾病进展。已有研究表明,创伤失血性休克大鼠肾组织炎性损伤中,上调miR-146a表达可以抑制TLR4/NF-κB信号通路并抑制炎症因子表达[12];肠黏膜屏障损伤中,抑制TLR4-p38MAPK/JNK信号通路可以降低促炎因子的表达,并使抗炎因子的表达增加,缓解肠道炎症损伤[13];TLR4信号传导激活增加下游SYK磷酸化表达,在促炎反应中发挥重要作用[14]。本研究结果亦提示,LPS通过TLR4传导通路激活促进下游信号传导,参与LPS乳腺上皮细胞炎症的发生发展。
乳腺炎炎症反应过程中,炎症因子的释放是判断炎性反应严重程度的重要指标。已有研究[15]表明,乳腺受到LPS刺激12 h,在乳腺组织和血液中诱发严重炎症反应,炎症因子水平显著增高。本研究中,LPS诱导后乳腺上皮细胞中IL-1β、IL-6、IL-8、NLRP3和TNF-α mRNA表达均增高,siRNA干扰SYK后IL-1β、IL-6、NLRP3、TNF-α mRNA水平表达均降低,提示SYK参与乳腺上皮细胞发育及乳腺炎免疫调控,为后续开发以SYK为靶点的新型乳腺炎靶向药物提供新参考。
IL-1β是乳腺炎炎症反应的重要指标。研究[16]显示,乳腺炎期间IL-18和IL-1β释放,激活caspase1引起牛乳腺上皮细胞焦亡。另外,IL-1β作为一种关键的炎性细胞因子,可以降低乳腺上皮紧密链接,从而加剧乳腺炎进展[17]。本研究发现,抑制SYK可以减少LPS诱导的乳腺上皮细胞中IL-1β表达,对于减轻乳腺上皮细胞炎症反应具有重要的意义。而乳腺炎期间激活的NLRP3可以诱导炎症因子活化和释放,研究[18]发现,抑制NLRP3和NF-κB可以减少mMECs中IL-1β和IL-18蛋白表达,减轻炎症反应。NLRP3炎性体的激活及IL-1β释放在热应激导致的牛乳腺炎中具有重要作用,通过抑制NLRP3激活可以降低牛乳腺炎中炎症反应和凋亡,缓解乳腺炎症[19]。本研究中,抑制SYK可减少NLRP3表达,抑制NLPR3激活,对于减少其他促炎因子的活化和释放及减轻乳腺上皮细胞炎症具有重要意义。
综上,SYK在LPS诱导的乳腺上皮细胞炎症反应中表达上调,促进炎症因子分泌,抑制SYK可以降低乳腺上皮细胞中炎症因子的表达,缓解乳腺上皮细胞炎症。TLR4在LPS乳腺炎症中发挥重要调控作用,然而靶向TLR受体介导的炎症通路可能干扰自身免疫从而产生其他不利影响,因此在Toll样受体下游阻断炎症信号的传导具有重要抑炎价值。SYK作为TLR4受体的下游通路基因,作为阻断信号转导的作用靶点,对LPS乳腺炎可发挥保护作用,为缓解乳腺上皮细胞炎症、降低抗生素使用提供研究思路。
