干性心包穿刺术中损伤冠状动脉致心脏压塞1例
2024-05-09左嵩龙德勇薄小雯甄雷蒋晨曦桑才华董建增马长生
左嵩 龙德勇 薄小雯 甄雷 蒋晨曦 桑才华 董建增 马长生
1 临床资料
患者 男,60岁。主因“反复心悸3年,加重1年”2020年11月19日入首都医科大学附属北京安贞医院。患者2017年情绪激动后突发心悸,不伴黑矇、晕厥等症状,外院行心电图提示室性心动过速(室速),行电复律治疗转复为窦性节律(图1A)。此后患者反复心悸发作,且症状逐渐加重,于2020年11月20日于我院行室速射频消融术。既往无特殊病史,无家族史。术前根据体表心电图考虑室速为左心室来源,心外膜起源可能性大。术中血压118/78 mmHg(1 mmHg=0.133 kPa),心电监护提示窦性心律。经RVA电极反复刺激,未诱发心动过速。应用Pentaray导管(强生,美国)对左心室心内膜行基质标测,可见心内膜电压完好,未见明显低电压区及延迟电位。遂经剑突下行干性心包穿刺术,成功置入长导丝并观察20 min,期间患者血压稍有降低,约106/68 mmHg,心影搏动尚可,遂送入NaviStar ST蓝把盐水灌注导管(强生,美国)于心外膜继续行基质标测,于左心室侧壁及前侧壁可见大片瘢痕区,并可见延迟及碎裂电位,结合室速形态考虑室速与该部位基质异常相关,遂对局部异常电位行基质改良消融,至所有异常电位消失,消融过程中多次抽取心包腔内液体共80 ml,呈淡红色液体。消融后反复诱发阴性,再次X线透视心影可见心尖搏动,抽净心包内液体后注射利多卡因及地塞米松并留置Arrow管(图1B)。
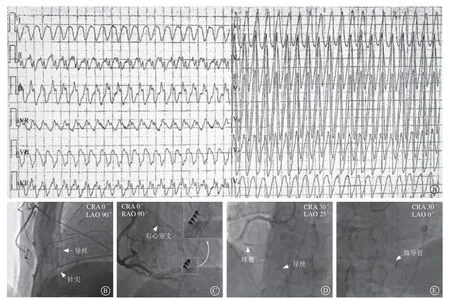
图1 术前资料及术中影像 A.术前室速心电图; B.干性心包穿刺成功后X 线影像;C.冠状动脉造影右冠状动脉提示右心室支远端血液外渗(黑色箭头所示);D.Medtronic Sprinter Legend 1.5 mm×15 mm 球囊至右心室支膨胀封堵管腔影像;E.封堵后应用微导管造影示对比剂外渗消失Figure 1 Preoperative data and infraoperatie images
心电血压监护示窦性心律,血压123/84 mmHg,遂结束手术,并于18∶35安返病房,完善床旁超声心动图提示心包腔内少量液性暗区。19∶55左右,患者诉大汗、气短,血压63/41 mmHg,心音低钝,心率92次/分,考虑心脏压塞可能性大。立即经心包引流管抽暗红色液体约200 ml,并迅速给予升压、扩容治疗,5 min后血压恢复至115/81 mmHg。观察30 min后心包引流管仍可抽出暗红色液体30 ml,考虑存在活动性出血,考虑不除外冠状动脉出血,故心电监护下送往导管室行急诊冠状动脉造影术。冠状动脉造影提示右心室支远端可见对比剂外渗(图1C),左冠状动脉未见明确异常。遂置6 F Medtronic Launcher SAL1.0指引导管至右冠状动脉开口,送SION Blue导丝至右心室支远端,循ASAHI SION Blue导丝送Medtronic Sprinter Legend 1.5 mm×15 mm球囊至右心室支远端6 atm(1 atm=101.325 kPa)膨胀封堵管腔约30 0 s 后,再次造影示对比剂外渗消失;观察30 min后再次造影未见对比剂外渗,结束手术(图1D~E)。患者血压124/83 mmHg,心率77次/分。此后多次复查超声心动图均未见心包积液,血压波动在110~120/70~85 m mHg之间,术后第2天出院,随访至2022年6月30日无室速再发。
2 讨论
干性心包穿刺术常用于室速射频消融治疗,以建立心外膜标测及消融通路。通常当心内膜反复标测并消融无效时,高度提示异位节律可能起源于心肌深处、心外膜脂肪下方或冠状动脉附近等导管不可及的区域,此时可考虑行心外膜标测与消融。本中心采用龙德勇教授改良的干性心包穿刺策略[1],具体过程简要如下。(1)选择心尖和心底部中点位置作为进针点,经左肋膈角部位进针,当穿刺针进入Larrey三角后,推送导丝至头端接触纤维层心包。(2)将导丝收至穿刺针内与针尖推送至纤维心包边缘。(3)进一步推送穿刺针可有突破感或落空感,前送导丝落入心包腔内,穿刺成功后可见导丝沿心影分布;若穿入心室或膈上其他部位,导丝将送出心影,可使用左前斜位加以确认。
近年来心外膜室速消融成功率虽有所提升,但手术相关并发症的发生率仍在4%~10%[2-3],在心外膜室速消融过程中容易损伤冠状动脉引发心包积液进而导致心脏压塞。既往欧洲室性心律失常导管消融专家共识建议对于接受心外膜室速消融的患者,应在消融前通过冠状动脉造影或冠状动脉CT血管造影对心外膜冠状动脉进行成像,以减少动脉损伤的风险[4],同时对于预估有风险的心外膜室速患者,及时匹配超声心动图、输血和现场胸外科手术支持也十分有必要。除此以外,选择合适的穿刺策略也可以有效减少并发症的出现,当前Sosa策略[5]及针中针策略[3](Needle-in-Needle,NIN)已被大多数电生理学者作为心外膜室速消融的首选穿刺方法,两者的安全性未见明显差异[6]。2017年Keramati等[7]提出心外膜前入路行心包穿刺策略,结果显示前路手术的成功率可与NIN策略相当,且优于Sosa策略;同时未出现明显的心包出血、误穿或损伤右心室或急诊心脏手术等安全事件。2020年本中心龙德勇教授提出导丝指导下的改良干性心包穿刺策略[1],其展现出与传统对比剂方案相似的成功率及更好的安全性,并且具有减少并发症的趋势。与此同时,针对改善穿刺安全性的新策略亦在不断探索中。近几年多项研究试图应用二氧化碳将心脏与心包相分离以提高成功率及安全性[8-9],虽然取得了一定成果,但因操作复杂等原因尚未应用于临床之中。
目前,国内进行心外膜射频消融的病例较少,进行干性心包穿刺的经验有限,而在穿刺过程中损伤冠状动脉更为罕见。然而,一旦出现该并发症则危险性极高,及时采取有效地干预策略对于改善预后具有决定性作用。本病例报道冠状动脉损伤位置为右冠状动脉右心室支的远端,考虑到该支细长且末端血流压力较小,首先采用了持续(300 s)低压力(6 atm)球囊扩张封堵策略,结果显示该方案有效达到了止血作用,避免了进一步操作可能造成的冠状动脉及心肌损伤风险。事实上,冠状动脉支架置入术中冠状动脉损伤的处理经验相对丰富,目前认为年龄、性别、冠状动脉病变复杂度可能是冠状动脉穿孔的危险因素[10-11]。然而与支架置入术中多累及冠状动脉主要分支血管不同,心包穿刺常损伤冠状动脉末端。因此及时借鉴冠状动脉支架术中的处理经验,针对不同损伤部位及程度给予最优化处理,减少干预导致的心肌及冠状动脉损伤,将是未来提高干性心包穿刺安全性的重要课题。总之,一旦出现上述情况,可根据损伤位置、出血速度等情况,采取低压力球囊扩张、覆膜支架、冠状动脉内注射凝血酶、局部栓塞甚至心外科手术等方法,及时、有效地干预并发症,改善患者预后,为干性心包穿刺的普及提供安全有效的保障。
利益冲突 所有作者均声明不存在利益冲突
