不同模式低氧训练影响小鼠骨骼肌线粒体自噬与血管生长研究
2024-05-07赵永才高炳宏
赵永才 高炳宏
1 天津体育学院运动健康学院运动生理学与运动医学重点实验室(天津 301617)
2 上海体育大学竞技运动学院(上海 200438)
低氧训练能高效提高人体心肺功能和骨骼肌有氧代谢能力,线粒体是能量合成细胞器,骨骼肌线粒体适应变化是低氧训练高效提升有氧能力的部分机制[1]。运动训练引起骨骼肌线粒体生物合成增强,依赖腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)等激酶调节[2],线粒体生物合成增强的同时,还依赖于线粒体自噬及时清理功能损伤的线粒体,维护骨骼肌线粒体质量。
线粒体自噬是损伤的线粒体被特异性包裹进自噬体并与溶酶体进行融合,最后被降解的过程[3]。经典线粒体自噬通路是帕金蛋白(Parkin)调控的泛素化过程:线粒体损伤后,线粒体定位的PTEN 诱导激酶1(PTEN induced putative kinase 1,Pink1)正常降解过程被抑制,Pink1 在线粒体外膜(OMM)上积累,进一步募集Parkin在OMM上定位并对靶蛋白进行泛素化。选择性自噬接头蛋白P62(Sequestosome 1,P62)含有泛素化结合域,与泛素化蛋白结合并在OMM 上积累,吸引自噬体对线粒体进行识别吞噬[4]。线粒体外膜上的BCL2/腺病毒E1B19kda 相互作用蛋白3(BCL2/adenovirus E1B19Kda protein-interacting protein 3,Bnip3)与Bnip3L(Nix)蛋白可直接结合自噬标记物微管相关蛋白轻链-3(Microtubule-associated protein light chain 3,LC3),直接促进自噬体对线粒体的吞噬[4]。
前期研究发现运动训练可增强胰岛素抵抗小鼠骨骼肌Pink1/Parkin 线粒体自噬信号[5];急性运动激活小鼠骨骼肌线粒体自噬也依赖Parkin 蛋白的调节作用[6]。而低氧环境和缺血缺氧也能增强骨骼肌和脑组织线粒体自噬信号[4,7]。低氧和运动结合而成的低氧训练是否可以更高效地提高骨骼肌线粒体自噬,报道极少。另外,无论常氧运动还是低氧刺激均能增强骨骼肌的血管生成信号[8,9],低氧训练是否更进一步提升骨骼肌血管生长,还不知晓。低氧训练能高效提升有氧代谢能力,分子机制相对缺乏。线粒体质量影响组织细胞能量代谢水平,与血管生成呈正向关联[10],骨骼肌线粒体自噬与血管生长信号的适应可能是低氧训练提升有氧能力的分子机制。因此,本研究考察高住低练(live high-train low,LHTL)和低住高练(live lowtrain high,LLTH)两种低氧训练模式是否能更进一步提升骨骼肌线粒体自噬和血管生成信号。
1 材料与方法
1.1 实验分组及干预
1.1.1 实验对象
6周C57BL/6J雄性小鼠(SPF级),40只,分笼饲养,喂食SPF 级饲料,自由饮食,每日12 h 光照,温度保持在25℃,环境湿度保持在50%~60%。1 周熟悉环境后,随机分5 组:对照组(control group,H 组)、低氧暴露组(hypoxic group,H 组)、运动训练组(exercise training group,E 组)、高住低练组(live high training low group,LHTL 组)和低住高练组(live low training high group,LLTH 组),8只/组。研究经上海体育学院伦理委员会审核(批准号:2017036)。
1.1.2 实验干预
C 组自由饲养,不做干预;H 组白天完成8 小时低氧暴露;E 组于18:00完成一次跑台运动;LHTL 组采取E组和H组的结合模式,即先进行低氧暴露,18:00再进行一次跑台运动;LLTH 组每天18:00于低氧环境下完成一次跑台运动(强度同E组)。持续6周干预,每周5天,使用Everest Summit Ⅱ低氧发生器(Hypoxico Inc公司)设置低氧环境,每次运动负荷和低氧浓度见表1。

表1 运动强度及低氧浓度安排(跑台坡度0°)
最后一次干预24 h 后,动物引颈处死,取腓肠肌于液氮速冻,-80℃保存,用于蛋白表达测定。4%多聚甲醛固定股四头肌,用于组织学处理。取1 mm3腓肠肌,4%戊二醛固定,用于电镜观察。
1.2 Western blot蛋白测定
腓肠肌与适量裂解液混合,冷冻环境研磨,冷冻离心机12000 g离心10 min,蛋白上清液进行浓度测定,100 ℃下煮10 min,完成蛋白变性。每孔蛋白上样,SDS-PAGE 蛋白凝胶电泳,浓缩胶保持70 v 电压,电泳30 min,分离胶保持120 v,电泳30~40 min。将蛋白转至PVDF 膜,进行60~90 min 转膜。膜置于脱脂牛奶封闭2 h,TBST洗膜3×5 min。加一抗并4°C孵育过夜。一抗信息:LC3(MBL,M186-3)、Ulk1(CST,8054T)、p-Ulk1(Ser555)(CST,5869T)、Pink1(Proteintech,23274-1-AP)、Parkin(Proteintech,66674-1-Ig)、Bnip3(博士德, BM5039)、Nix(Proteintech,12986-1-AP)及α-Tubulin(Proteintech,11224-1-AP),一抗均按1∶1000 稀释。孵育完毕后,TBST 洗膜3×5 min,室温孵育二抗(Proteintech,SA00001-2,1∶3000稀释)1 h,洗膜3×5 min。添加ECL发光液显影,Image J 软件分析蛋白印迹的灰度值,α-Tubulin 内参完成校正。
1.3 免疫组织化学方法
本次研究受腓肠肌样本量的限制,取股四头肌进行组织学切片观察,评估血管生成适应。股四头肌进行梯度酒精脱水和透明处理,石蜡包埋及切片。切片经二甲苯和下行梯度酒精复水,切片放于柠檬酸盐修复液,再加热,冷却后PBS洗涤。过氧化氢孵育30 min后PBS 洗涤。BSA 常温下封闭30 min,滴加血管内皮生长因子(vascular endothelial growth factor,VEGF)(碧云天,AF0312)或血小板内皮细胞黏附分子(Platelet- endothelial cell adhesion molecule- 1, CD31)(CST,77699S)一抗稀释液,4°C 孵育6 h。PBS 洗涤后孵育生物素标记二抗,30 min 后PBS 洗涤添加SABC液,室温孵育洗涤后添加DAB显色液,细胞核复染后脱水封片。奥林巴斯BX35 显微镜随机观察样本5 个视野,Image Pro软件计算光密度积分。
1.4 透射电镜观察
腓肠肌约1 mm3体积,用4%戊二醛进行固定,4℃一天,在1%锇酸混合0.1 M 磷酸缓冲液中,室温2 h,PBS 漂洗3×15 min。上行酒精进行脱水。812 包埋剂和丙酮混合液中渗透8 h,使用纯812 包埋剂再渗透8 h。于60℃环境聚合48 h,切片机完成70 nm切片(Leica UC7)。再完成铀铅双染色,常温下干燥。Hitach 7700电镜配合Gatan ccd相机进行分析。
1.5 统计学分析
SPSS 20.0 软件处理数据,数据用平均值±标准差表示,组间差异采用双因素方差分析,整体上具有显著差异后,使用最小显著性差异法(least significant difference,LSD),进一步比较各组之间的差异性。 使用Prism GraphPad 7.0进行绘图,P<0.05表示差异具有统计学意义。
2 结果
2.1 低氧训练过程体重的变化
如图1所示,C组小鼠体重在训练周期稳定增长;H组6 周末体重也显著小于C 组(P<0.05)。E 组小鼠体重增长较慢,干预周期内,E 组小鼠体重显著小于C 组(P<0.01)。干预周期内,LHTL 组与LLTH 组小鼠体重低于C组,到6周干预结束后,LHTL 组与LLTH 组小鼠体重已显著低于C 组(P<0.01)。结果表明单纯低氧暴露、运动训练及低氧训练能降低小鼠体重增长速度。

图1 各类干预过程中各组小鼠体重的变化
2.2 低氧训练后骨骼肌线粒体自噬的变化
2.2.1 骨骼肌自噬信号的变化
与C组相比,各组P62表达无显著性差异(P>0.05,图2A)。对比各组LC3 蛋白(图2B),LHTL 组LC3 Ⅱ/LC3 Ⅰ比值不但显著高于C组(P<0.01,图2B),还显著高于H 组和E 组(P<0.05,图2B),即LHTL 组骨骼肌LC3 Ⅱ转化最明显,自噬信号增强最显著。Unc51 样自噬激活激酶1(Unc51-like autophagy-activating kinase 1,Ulk1)正向调控细胞自噬的进程,相比C组,E组与LHTL 组磷酸化Ulk1(p-Ulk1)水平增加(P<0.05,图2C)。Ulk1 蛋白变化无显著性(P>0.05,图2D)。结果提示运动训练或LHTL显著提高Ulk1磷酸化水平。

图2 各组小鼠骨骼肌自噬相关蛋白的表达
2.2.2 骨骼肌线粒体自噬蛋白表达的变化
与C 组相比,H、LHTL 和LLTH 组Pink1 表达均显著提高(P<0.05,图3A);LHTL 组Pink1 表达也显著高于E 组。LHTL 和LLTH 组Parkin 表达显著高于C 组和H 组(P<0.05,P<0.01,图3B)。各组Bnip3 表达无显著性差异(P>0.05,图3C)。E、LHTL 及LLTH 组Nix 水平显著高于C 组(P<0.05,图3D),LHTL 与LLTH 组Nix 也明显高于H 组(P<0.01,图3D)。总体提示两种低氧训练模式提升Pink1、Parkin 和Nix 蛋白含量较显著,更有利于肌细胞线粒体自噬发生。
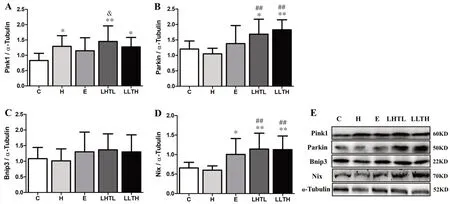
图3 各组小鼠骨骼肌线粒体自噬蛋白的表达
2.3 低氧训练后骨骼肌血管生成信号变化
CD31是血管内皮的标志,可呈现线状(血管纵切)或不规则圆形(血管横切)。如图4,LHTL 与LLTH 组CD31表达高于C组(P<0.05,P<0.01),LHTL组CD31含量也显著高于H 组(P<0.01)。VEGF 是促进血管生长的关键因子,如图5,各干预组VEGF表达显著高于C组(P<0.05,P<0.01)。低氧暴露、运动训练和低氧训练能不同程度提高CD31与VEGF表达,LHTL与LLTH均促进CD31与VEGF表达,血管生长明显。

图4 各组小鼠骨骼肌CD31的表达(×400倍)
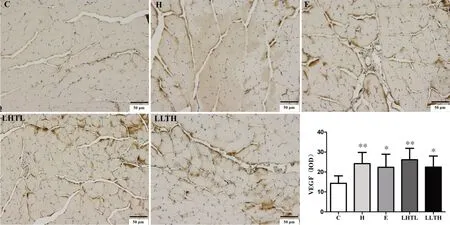
图5 各组小鼠骨骼肌VEGF的表达(×200倍)
2.4 低氧训练后骨骼肌透射电镜观察
腓肠肌切片放大2000倍(图6)。各组代表性切片Z 线保持完整,未见断裂损伤,明带和暗带交替呈现较为规律。各组内质网和Z线交界处的线粒体形态存在差异,相比C组,E组和LHTL 组线粒体体积更大,且线粒体网状结构更明显。各组线粒体形态完整,未见明显水肿及空泡等病变。结果提示本次干预未产生肌原纤维及线粒体结构病变,运动训练后线粒体数量增大且内质网正常,线粒体呈现较好的生理性适应。

图6 各组小鼠骨骼肌线粒体形态特征(×2000倍)
3 讨论
3.1 低氧训练对骨骼肌线粒体自噬的影响
低氧训练使机体承受低氧和运动缺氧双重负荷,高效提高血红蛋白含量,增强心肺功能及肌肉力量[11,12]。前期综述也发现,相比常氧训练,低氧训练对骨骼肌的刺激更为强烈,并有效提高人体骨骼肌有氧代谢能力[13]。近期研究发现,低氧训练能有效提升骨骼肌线粒体去乙酰化酶Sirt3 蛋白表达,提高线粒体抗氧化功能[1]。提示低氧训练促进线粒体功能适应可能是机体有氧代谢能力提升的机制之一,但低氧训练与骨骼肌线粒体自噬的报道相对较少。
自噬(大自噬)是指细胞成分,如细胞器和蛋白质等损伤成分被自噬体识别包裹,与溶酶体融合并被降解的过程,降解成分可循环利用[14]。随着自噬加强,P62表达降低,LC3Ⅱ表达相对提高。本研究未发现各组P62 有变化,但高住低练组LC3Ⅱ/Ⅰ比值显著性升高,而且其LC3Ⅱ/Ⅰ比值也高于单独低氧暴露或运动训练组,提示高住低练提升骨骼肌自噬信号要强于单独运动训练或低氧暴露。自噬的启动程序依赖Ulk1,Ulk1(Ser555)被AMPK磷酸化激活,启动细胞自噬级联信号反应[15]。Ulk1也参与运动激活肌肉线粒体自噬的信号,Ulk1(Ser555)磷酸化是运动激活肌肉线粒体自噬的关键信号[16]。本研究发现骨骼肌Ulk1整体蛋白对各类干预不敏感,但运动训练与高住低练提升了Ulk1(Ser555)磷酸化水平。整体而言,高住低练模式提升骨骼肌自噬信号更明显,有利于充分利用氨基酸、糖、脂等营养素,维持能量合成效率,应对低氧训练下的代谢需要。
骨骼肌代谢旺盛,拥有丰富的线粒体,其数量和质量对于维持肌肉生理功能至关重要[17]。运动引发部分线粒体损伤,受损线粒体易释放ROS,加剧损伤,同时肌细胞ATP减少激活了AMPK,AMPK通过不同途径启动线粒体自噬,清理受损线粒体,维持线粒体质量[18]。Pink1/Parkin 泛素化途径和Bnip3/Nix 受体途径参与自噬体对线粒体的降解[19]。本研究发现两种低氧训练模式均增强Pink1、Parkin 和Nix 蛋白表达,运动训练或低氧暴露对线粒体自噬信号的影响相对较小,且高住低练组Pink1 表达显著高于运动训练组。即两种低氧训练模式,尤其高住低练比低氧暴露或运动训练增强骨骼肌线粒体自噬信号更明显。前期薄海等[20]研究发现4 周低氧训练或11.3%低氧暴露均可提高大鼠骨骼肌Bnip3、Parkin 及Pink1 蛋白表达,但低氧训练提高Parkin、Bnip3 蛋白表达更明显。本次研究支持其研究结论,发现低氧训练增强骨骼肌线粒体自噬信号的效果要好于单纯低氧暴露。低氧训练诱发的双重负荷对骨骼肌刺激更强烈,缺氧能通过降低ATP 含量等途径激活AMPK,进而激活线粒体自噬,提高机体对缺氧的耐受[21],这可能是低氧训练更高效提高骨骼肌线粒体自噬的机制。电镜观察也发现运动训练和高住低练组线粒体体积明显变大,且线粒体网状结构更明显。说明高住低练能有效提高线粒体容量,这是线粒体生物合成增强的宏观表现,与线粒体自噬信号增强相对应,提示本次高住低练模式高效提升了骨骼肌线粒体的生理适应。
低氧训练组的小鼠体重增长相对较慢,这与其线粒体自噬信号较高相对应。低氧训练干预下,骨骼肌能量代谢更加旺盛,以满足低氧和运动双重刺激的代谢需求,再加上骨骼肌自噬与线粒体自噬信号较高,物质分解代谢较强,延缓了小鼠体重的正常增长。
常氧训练结果方面,本研究与既往相关研究结果存在不一致。前人发现长期游泳提高小鼠骨骼肌各类线粒体自噬蛋白的表达[22]。另有研究发现小鼠长期运动训练后,慢肌LC3Ⅱ与Bnip3蛋白表达提高,P62蛋白减少[23],提示有氧运动训练可增强骨骼肌线粒体自噬。有氧运动训练也能促进小鼠骨骼肌Parkin蛋白在线粒体膜上的定位[24]。经常跑步训练人群骨骼肌Parkin(Ser65)、Pink1(Thr257)磷酸化水平比不训练人群高,提示常氧训练即可提高骨骼肌基础水平线粒体自噬[25]。近期还有研究发现常氧下高强度间歇性训练提高大鼠骨骼肌Bnip3蛋白[26]。但本次研究中,常氧训练(运动训练组)后小鼠骨骼肌线粒体自噬信号整体变化不明显。有研究[27]发现6 周小鼠跑台训练明显提高了骨骼肌线粒体态3 呼吸(氧化磷酸化涉及的ATP 合成能力增强),并提高了Parkin 蛋白表达,其干预中后期跑台速度远大于本研究的跑速。与该研究相比,本次研究中,常氧下运动训练强度可能偏低,不能有效激活骨骼肌线粒体自噬信号。而在结合低氧后,双重生理负荷才激活了骨骼肌线粒体自噬。另外,受试对象及运动模式的差异可能也是研究结果不一致的原因。
3.2 低氧训练对骨骼肌血管生长的影响
骨骼肌对低氧训练的适应也涉及血管组织的变化。毛细血管与肌膜极为接近,肌细胞线粒体消耗氧及营养素,线粒体变化也影响到血管组织的适应。CD31主要表达于血管内皮细胞,是评估毛细血管生长的有效指标[28]。VEGF同样在血管内皮细胞高表达,运动可上调高血压大鼠血管VEGF 表达,有利于降压[29]。本次研究发现高住低练与低住高练均明显提高股四头肌CD31 表达,高住低练组CD31 表达还高于低氧暴露组;另外,运动训练、低氧暴露及两种低氧训练也明显提高了VEGF 的表达。本次研究整体表明,低氧训练提升血管生长信号方面,要比低氧暴露更为明显。前期虽有运动增强肌肉血管生长的报道,但缺乏涉及低氧训练与血管生长关系的研究。Hoppeler 等[30]发现低住高练提升运动员骨骼肌VEGF mRNA,且优于常氧训练。Nagahisa等[31]发现纯种马进行长期低氧训练后,肌肉毛细血管密度及VEGF mRNA 大幅提高,优于常氧训练。本研究通过组织学考察发现低氧训练和运动训练均能提升小鼠骨骼肌VEGF 表达,并未发现低氧训练提高VEGF 表达具有优势,可能与研究对象和评估方法差异有关。另一方面,低氧训练提高骨骼肌CD31表达,而运动训练影响骨骼肌CD31不明显,可能CD31敏感性相对较低,只有低氧训练双重生理负荷才能有效提升其表达。总体认为,低氧训练提高肌肉血管生长效果更好,分子机制还有待研究。
4 结论
6 周高住低练和低住高练提高了小鼠骨骼肌线粒体自噬信号和血管生长信号,其中高住低练模式提升骨骼肌线粒体自噬及血管生成信号最明显。6 周运动训练或低氧暴露也不同程度提高小鼠骨骼肌线粒体自噬和血管生长信号,但高住低练模式在提升骨骼肌线粒体自噬信号方面有更好的表现。
