小剂量阿帕替尼联合XELOX 方案治疗晚期结肠癌的疗效△
2024-05-07孙桢申小燕方晓瑞
孙桢,申小燕,方晓瑞
河南科技大学附属许昌市中心医院肿瘤科,河南 许昌 461000
结肠癌是临床常见的原发于结肠黏膜上皮的恶性肿瘤,其早期症状不明显,疾病进展期可出现便血、腹痛等临床表现[1]。流行病学报道指出,中国结肠癌的发病率近年来呈上升趋势,其中男性发病率略高于女性[2]。手术是结肠癌的主要治疗方法,早期结肠癌患者通过外科手术可达到根治目的,对于中晚期结肠癌患者,临床通常采用以化疗为核心的综合治疗模式以改善患者的生活质量[3]。奥沙利铂+卡培他滨(XELOX)方案是目前临床发展较为成熟的化疗方案,在结肠癌中应用效果良好[4]。阿帕替尼属于小分子血管内皮细胞生长因子受体2 酪氨酸激酶抑制剂,可抑制肿瘤新生血管生成,单药主要用于治疗既往至少接受过2 种系统化疗后进展或复发的晚期胃腺癌或胃-食管结合部腺癌患者[5]。研究证实,阿帕替尼对于晚期结肠癌患者的预后具有一定的改善作用[6]。因此,本研究探讨小剂量阿帕替尼联合XELOX 方案治疗晚期结肠癌的疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料
收集2018 年1 月至2022 年12 月河南科技大学附属许昌市中心医院收治的晚期结肠癌患者的病历资料。纳入标准:①符合晚期结肠癌的诊断标准[7];②生存期>3 个月;③既往未接受过阿帕替尼或XELOX 方案治疗。排除标准:①年龄<18岁;②化疗药物过敏;③合并严重肝肾功能不全或活动性出血;④免疫功能低下无法耐受本研究治疗。根据纳入、排除标准,共纳入108 例晚期结肠癌患者,按治疗方案的不同分为对照组(n=52)与观察组(n=56)。对照组中,男30 例,女22 例;年龄48~65 岁,平均(55.24±3.50)岁;病程1~6 年,平均(3.40±0.72)年;TNM 分期:ⅢB 期21 例,Ⅳ期31例。观察组中,男35 例,女21 例;年龄45~70 岁,平均(54.72±3.45)岁;病程1~5 年,平均(3.51±0.85)年;TNM 分期:ⅢB 期26 例,Ⅳ期30 例。两组患者性别、年龄、病程、TNM 分期比较,差异均无统计学意义(P>0.05),具有可比性。本研究经过河南科技大学附属许昌市中心医院医学伦理委员会审批通过(2022-11-JKA56)。
1.2 治疗方法
对照组采用XELOX方案治疗,第1天,给予奥沙利铂130 mg/m2静脉滴注2 h;第1~14 天,给予卡培他滨片1000 mg/m2口服,每日2次,每次500 mg/m2,治疗14 天后休息7 天,以21 天为一个疗程,连续治疗4 个疗程。观察组在对照组的基础上给予小剂量阿帕替尼治疗,甲磺酸阿帕替尼片250 mg 口服,每日餐后服用1 次,持续用药4 个疗程。
1.3 观察指标与评价标准
①治疗效果:根据相关疗效评价标准[8],目标病灶完全消失,且持续时间>1 个月为完全缓解(CR);病灶长径总和缩小≥30%,且持续时间>1个月为部分缓解(PR);病灶长径总和增加<20%或缩小<30%为稳定(SD);病灶长径总和增加≥20%或有新病灶为进展(PD);客观缓解率=(CR+PR)例数/总例数×100%,疾病控制率=(CR+PR+SD)例数/总例数×100%。②肿瘤标志物与生长因子水平:治疗前后,分别采集两组患者空腹静脉血3 ml,以3500 r/min 离心后取上层血清,检测两组患者血清糖类抗原72-4(carbohydrate antigen 72-4,CA72-4)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)及血管内皮生长因子(vascular endothelial growth factor,VEGF)水平。③肠道菌群:治疗前后,分别采集两组患者新鲜粪便0.5 g,以无菌生理盐水稀释10 倍后分别于选择性培养基上进行接种,采用平板活菌计数法检测两组患者肠道大肠杆菌、双歧杆菌及乳杆菌水平。④不良反应:统计化疗期间两组患者胃肠道反应、血压升高、肝肾功能损伤、贫血等不良反应发生情况。
1.4 统计学方法
采用SPSS 24.0统计软件进行数据分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 治疗效果的比较
观察组患者客观缓解率与疾病控制率分别为57.14%(32/56)、76.79%(43/56),均高于对照组患者的36.54%(19/52)、57.69%(30/52),差异均有统计学意义(χ2=4.593、4.487,P<0.05)。(表1)

表1 两组患者的治疗效果[n(%)]*
2.2 肿瘤标志物与生长因子水平的比较
治疗前,两组患者CA72-4、MMP9 与VEGF 水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者CA72-4、MMP9 与VEGF 水平均较治疗前降低,且观察组患者CA72-4、MMP9 与VEGF 水平均低于对照组,差异均有统计学意义(P<0.05)。(表2)

表2 治疗前后两组患者CA72-4、MMP9 与VEGF 水平的比较
2.3 肠道菌群水平的比较
治疗前,两组患者各肠道菌群水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者双歧杆菌、乳杆菌水平均较治疗前升高,大肠杆菌水平均较治疗前降低,且观察组患者双歧杆菌、乳杆菌水平均高于对照组,大肠杆菌水平低于对照组,差异均有统计学意义(P<0.05)。(表3)
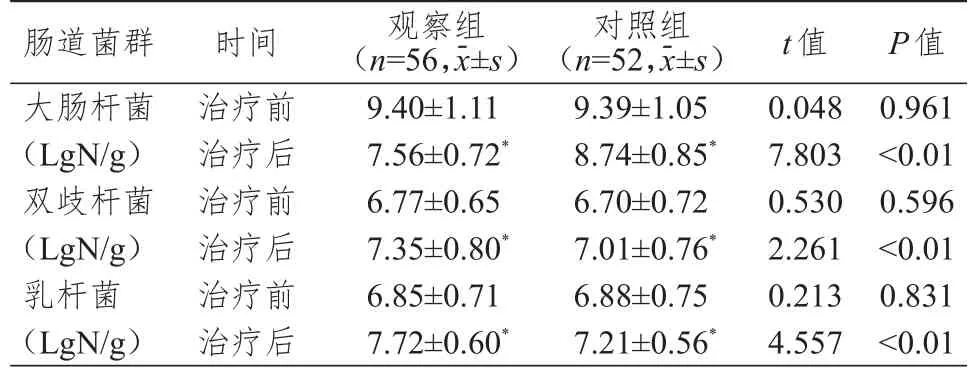
表3 治疗前后两组患者肠道菌群水平的比较
2.4 不良反应发生情况的比较
观察组患者不良反应总发生率为14.29%(8/56),与对照组患者的9.62%(5/52)比较,差异无统计学意义(χ2=0.555,P>0.05)。(表4)

表4 两组患者不良反应发生情况[n(%)]
3 讨论
晚期结肠癌的治疗以化疗为主,但单一化疗方案疗效有限,且不良反应明显,因此通常采用联合化疗方案进行治疗。目前临床针对结肠癌应用较多的治疗方案为XELOX 方案,其优势在于用药方便,方案中卡培他滨为口服药物,患者可在家自行服药,能够缩短住院时间,减轻患者经济负担。但其末梢神经毒性明显,在合并糖尿病等基础疾病以及进食困难的患者中适用性不高[9-10]。阿帕替尼是近年临床讨论较多的新型抗血管生成药物,通过抑制VEGF表达来抑制肿瘤细胞增殖和转移[11]。顾珈裔等[12]研究提出,阿帕替尼属于临床高效抗肿瘤药物,能够有效抑制肿瘤细胞的扩散,控制肿瘤进展。因此,分析阿帕替尼在晚期结肠癌中的应用效果对其临床治疗具有较高的参考价值。
阿帕替尼已被证实在胃癌、乳腺癌等多种疾病治疗中具有较高的安全性和应用价值[13-14]。张博等[15]研究提出,阿帕替尼具有抑制结肠癌肿瘤细胞增殖、侵袭与转移的作用,通过抑制肿瘤细胞信号通路表达,诱导细胞发生凋亡。本研究在常规XELOX方案的基础上给予小剂量阿帕替尼联合治疗,结果显示,观察组患者客观缓解率与疾病控制率均高于对照组,与王珊珊等[16]报道结果一致,表明小剂量阿帕替尼联合XELOX方案治疗晚期结肠癌的短期疗效明显。CA72-4 是消化道肿瘤中常见的高分子量黏蛋白类抗原之一,在结肠癌中表达水平较高,可为结肠癌的临床治疗提供依据[17]。MMP9主要通过降解肿瘤细胞基底膜与细胞外基质中胶原蛋白Ⅳ来参与肿瘤细胞的侵袭与转移等过程[18-19]。既往研究证实,VEGF 表达水平与阿帕替尼的疗效具有一定相关性[20]。本研究结果显示,治疗后两组患者血清CA72-4、MMP9 与VEGF 水平均较治疗前降低,且观察组患者CA72-4、MMP9 与VEGF 水平均低于对照组,提示在XELOX 方案治疗的基础上给予小剂量阿帕替尼在改善患者血清肿瘤标志物与VEGF水平方面疗效更佳。田成和袁岸龙[21]报道,肠道微生物稳态失衡可导致机体炎症水平与致癌代谢产物水平升高,致使肿瘤发生风险增加,通过观察肠道菌群水平可一定程度上反映化疗药物疗效。陈海彬等[22]报道也证实,结肠癌患者中存在明显的肠道菌群水平失衡特征。本研究对两组患者化疗前后肠道大肠杆菌、双歧杆菌与乳杆菌水平进行检测与对比发现,治疗后,两组患者双歧杆菌、乳杆菌水平均较治疗前升高,大肠杆菌水平均较治疗前降低,且观察组患者双歧杆菌、乳杆菌水平均高于对照组,大肠杆菌水平低于对照组,表明应用小剂量阿帕替尼联合XELOX方案治疗晚期结肠癌患者对肠道菌群水平的影响较小,疗效更佳。本研究结果显示,治疗后,两组患者不良反应总发生率比较无明显差异,表明在XELOX方案的基础上加用小剂量阿帕替尼未增加化疗不良反应发生风险。
综上所述,小剂量阿帕替尼联合XELOX 方案治疗晚期结肠癌的临床疗效优于单独应用XELOX 方案,可有效降低患者血清CA72-4、MMP9 与VEGF 水平,提高临床疗效,可为晚期结肠癌的临床治疗提供参考。
