模拟炎症微环境下紫草素对人牙周膜干细胞增殖和成骨分化的影响
2024-05-07陈意磊张文杰
陈意磊, 于 倩,2, 张文杰, 赵 今,2
(1新疆医科大学第一附属医院(附属口腔医院)牙体牙髓病科; 2新疆维吾尔自治区口腔医学研究所, 乌鲁木齐 830054)
慢性牙周炎是发生于牙周支持组织不可逆转的慢性炎症性疾病,可导致牙槽骨吸收、牙齿脱落等不良症状[1]。目前临床上常用的治疗方法是机械清除牙结石,局部使用抗菌药物辅助治疗[2]。对于已丧失牙周组织的患者,使用传统的治疗方法并不能实现稳定的牙周组织再生[3]。人牙周膜干细胞(Human periodontal ligament stem cells, hPDLSCs)具有高可塑性和多潜能性等特点成为牙周炎患者牙周组织和骨再生的理想候选细胞,对牙周治疗具有重要意义[4-6]。有研究表明炎症环境可抑制hPDLSCs的增殖和成骨分化[7],牙周组织再生也就受到抑制,因此需要探寻一种有效的策略增强炎症环境下hPDLSCs的成骨分化能力。天然药物辅助治疗牙周炎具有一定的优势[8],例如巴戟天多糖能在炎症环境下使牙周膜细胞乙酰化酶1表达降低,核苷酸结合寡聚化结构域(Nucleotide Binding Oligomerization Domain, NOD)样受体热蛋白结构域相关蛋白3表达升高,发挥抗炎作用[9]。赵斌等[10]研究发现芦丁在炎症环境下能够促进hPDLSCs成骨分化。紫草素是从紫草中提取的一种萘醌类活性成分,具有抗菌消炎、抗氧化、抗病毒、抗肿瘤等作用[11-14]。本课题组前期研究发现紫草素可通过骨保护素/核因子κB受体活化因子配体信号轴促进小鼠成骨前体细胞细胞增殖和成骨分化,还可通过抑制破骨相关基因的表达,从而抑制破骨细胞生成[15-16]。本研究在脂多糖诱导炎症微环境下探究紫草素对hPDLSCs增殖与成骨分化的影响,现报道如下。
1 材料与方法
1.1 试药紫草素(上海源叶生物科技有限公司,B21682); α-MEM培养基(美国Gibco公司,C12571500BT);磷酸盐缓冲溶液(Phosphate buffer saline, PBS,美国Cytiva公司,02-024-1ACS);青链霉素(美国BI公司,03-031-1B);胰蛋白酶(美国BI公司,03-050-1B);胎牛血清(美国BI公司,04-001-1ACS);二甲基亚砜(Dimethyl sulfoxide, DMSO,(北京索莱宝生物科技有限公司,D8371);牙龈卟啉单胞菌脂多糖(英国InvivoGen公司,LPG-41-01);CD29(美国Biolegend公司,303021);CD105(美国Biolegend公司,323217);CD34(美国Biolegend公司,343515);CD45(美国Biolegend公司,368508);细胞增殖毒性检测试剂盒CCK-8(英国Proteintech公司,PF00004-500T);牙周膜干细胞成骨诱导分化试剂盒、茜素红(美国Cyagen公司,HUXXC-90021); ALP染色试剂盒(碧云天生物技术有限公司,C3206);BCA蛋白定量试剂盒(碧云天生物技术有限公司,P0010-500);ALP活性测试盒(南京建成生物工程研究所,A059-2);Trizol(invitrogen公司,15596-026);cDNA合成试剂盒(英国Thermo Fisher Scientific公司,4368814);RT-PCR试剂盒(Takara公司,RR820A);引物(生工生物工程有限公司,SGYW020)。
1.2 仪器MINI-10K型迷你离心机(杭州佑宁仪器有限公司);VORTEX-6型混匀仪(其林贝尔仪器制造有限公司);XS1003S型电子天平(METTLER TOLEDO);SW-CJ-2F型超净工作台(博迅实业有限公司);CytoFLEX型流式细胞仪(贝克曼库尔特公司);DM IL LED型倒置显微镜(德国徕卡公司);BC-J160型二氧化碳细胞培养箱(博迅医疗生物仪器有限公司);CHT210R型高速冷冻离心机(湖南湘仪实验仪器有限公司);Multiskan型GO全波长酶标仪(赛默飞世尔公司);A51683型实时荧光定量PCR仪(赛默飞世尔公司);Forma 88500型-80℃冰箱(赛默飞世尔公司)。
1.3 方法
1.3.1 hPDLSCs的分离和培养 收集2023年3月-5月就诊于新疆医科大学第一附属医院(附属口腔医院口腔外科门诊)因正畸需拔除的前磨牙或智齿(12~25岁牙周健康者),将离体牙保存到预冷的α-MEM完全培养基(含10%胎牛血清,1%青链霉素,89% α-MEM基础培养基)中,30 min内送至实验室。在超净台内,用α-MEM完全培养基反复冲洗牙根直至无血渍,用12号刀片小心刮取根中1/3牙周膜,剪成1 mm3的组织块,收集于离心管中,1 000 r/min离心3 min,此过程重复3次,将组织块置于培养瓶底部,翻转培养瓶,加入3 mL α-MEM完全培养基,置于37℃、5% CO2环境下干涸2 h,翻转培养瓶孵育。培养基3 d更换1次,待细胞铺满瓶底70%~90%时,用0.25%胰蛋白酶消化,按1∶3传代,标记为第1代细胞(P1)。取P3-P5代用作后续实验。本研究通过新疆医科大学第一附属医院伦理委员会的审批(审批号:K202304-19),所有研究对象均签署知情同意书。
1.3.2 药物配置 将14.42 mg紫草素粉末溶于1 mL DMSO中,混匀后用0.22 nm滤器过滤得到5×104μmol/L的紫草素母液,分装于EP管中,置于液氮罐保存。实验时稀释母液分别至4、2、1、0.5、0.25、0.125、0.062 5 μmol/L。
1.3.3 hPDLSCs鉴定 取状态良好的P3代细胞采用流式细胞检测仪检测细胞的表面标志物,其中阳性标志物CD105、CD29,阴性标志物CD34、CD45。
1.3.4 CCK-8检测 紫草素对不同状态hPDLSCs的增殖影响实验分组:空白组(单纯培养基)、不同浓度紫草素组( 0、0.062 5、0.125、0.25、0.5、1、2、4 μmol/L),每孔加入200 μL。每孔2×103个细胞,每组4个复孔,按照分组连续培养7 d,分别在1、3、5、7 d使用CCK-8试剂盒测量吸光度值。根据测定结果,选用对hPDLSCs有促进增殖作用的紫草素浓度范围,进行分组:空白组(单纯培养基)、LPS组(Porphyromonasgingivalislipopolysaccharide,P.g-LPS ,10 μg/mL)、LPS+不同浓度紫草素组(P.g-LPS+不同浓度紫草素),每孔加入200 μL,每孔2×103个细胞,每组4个复孔。体外模拟炎症微环境选用牙龈卟啉单胞菌脂多糖(P.g-LPS),浓度为10 μg/mL,LPS预先诱导,添加紫草素,连续培养72 h,分别在24、48、72 h时按CCK-8试剂盒说明书操作,用酶标仪测定450 nm处吸光度。
1.3.5 分组 根据“1.3.4”项下实验结果,选取后续实验最佳紫草素浓度进行实验分组:空白组(单纯培养基)、紫草素组(实验药物浓度紫草素)、LPS组(P.g-LPS ,10 μg/mL)、紫草素+LPS组(P.g-LPS+实验药物浓度紫草素,先加入P.g-LPS诱导炎症微环境,后加入实验药物浓度的紫草素)。
1.3.6 划痕实验 按“1.3.5”项下方法分组,将hPDLSCs以5×104个/孔的密度接种于12孔板中,待细胞融合至80%时,用200 μL移液枪枪头在孔板底部划一均匀横线,每组3个复孔,分别在0、24 h在倒置显微镜下测量划痕宽度,用Image J软件计算迁移率,迁移率=(0 h划痕宽度-24 h划痕宽度/0 h划痕宽度)×100%。
1.3.7 细胞上清液中IL-6、IL-18的测定 将hPDLSCs以3×104个/孔的密度接种于24孔板中,待细胞融合至80%时,按“1.3.5”项下分组方法更换培养基进行培养,每组3个复孔,培养72 h后收集于离心管中,4 000 r/min离心20 min,取上清液,-80℃保存。按ELISA试剂盒说明书方法检测上清液中IL-6、IL-18的水平。
1.3.8 碱性磷酸酶染色 将hPDLSCs以2×105个/孔的密度接种于6孔板中,待细胞融合至80%时,按“1.3.5”项下分组方法更换成品成骨诱导培养基进行培养,每组3个复孔。培养7 d后进行碱性磷酸酶(Alkaline phosphatase, ALP)染色,显微镜下观察并拍照记录。
1.3.9 ALP活性检测 将hPDLSCs以3×104个/孔的密度接种于24孔板中,待细胞融合至80%时,按“1.3.5”项下分组方法更换成骨诱导培养基,每组3个复孔,7 d后终止培养,裂解细胞后1 000 r/min离心10 min上清为待测样本。按BCA蛋白试剂盒说明书操作,测定标准曲线以计算各组蛋白浓度。按照ALP活性测试盒说明书操作,在96孔板中进行分组:空白孔、标准孔、测定孔,用酶标仪测定520 nm处各孔吸光度,细胞ALP活力=(测定孔OD值-空白孔OD值)/标准孔OD值-空白孔OD值×标准品浓度(0.02 mg/mL)÷待测样本蛋白浓度。
1.3.10 茜素红染色 将hPDLSCs以5×105个/孔的密度接种于35 mm培养皿中,待细胞融合至80%时,按“1.3.5”项下方法分组更换成骨诱导培养基进行培养,每组3个复孔。培养21 d后终止,进行茜素红染色,显微镜下观察并拍照记录,Image J软件计算结节相对含量,矿化结节相对含量=紫草素组矿化结节数/空白组矿化结节数×100%。
1.3.11 RT-PCR检测基因表达 按“1.3.9”项下方法培养hPDLSCs,每组3个复孔,培养7 d后终止,采用Trizol法提取总RNA,定量后用反转录试剂盒逆转录为cDNA。在实时定量荧光PCR仪上进行扩增,以GAPDH 为内参。RT-PCR 反应条件:(1)预变性95℃,2 min;(2)变性95℃,5 s;(3)退火58℃,30 s,共40个循环;(4)延伸72℃,5 min。用2-△△Ct相对定量法检测检测骨钙素(Osteocalcin, OCN)、RUNT相关转录因子2(Runt-related transcription factor 2, RUNX2)、ALP mRNA的表达,引物序列见表1。
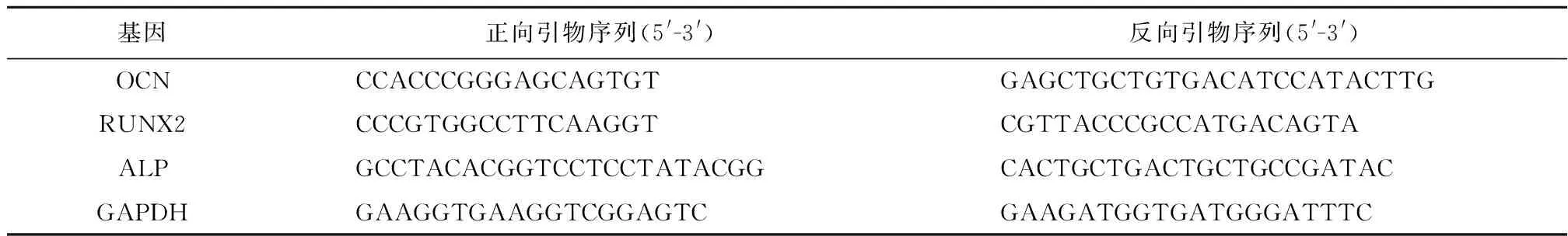
表1 RT-PCR引物
2 结果
2.1 hPDLSCs形态学与鉴定组织块法分离培养原代hPDLSCs,培养120 h后可见组织块周围有长梭形细胞爬出,呈漩涡状生长(图1)。流式细胞仪检测hPDLSCs表面标志物结果显示:CD29(99.91%)、CD105(92.34%)、CD34(0.76%)、CD45(0.32%),证实分离细胞符合干细胞特性,见图2。

注: 图1A为原代hPDLSCs; 图1B为P3代hPDLSCs; 标尺大小: 100 μm。
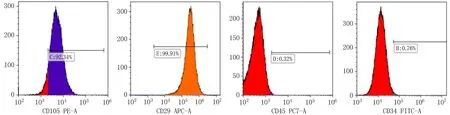
图2 hPDLSCs表面标志物CD105、CD29、CD45、CD34结果图
2.2 紫草素对hPDLSCs增殖的影响CCK-8结果显示:与对照组相比,在1 d时各浓度紫草素组细胞增殖能力差异无统计学意义(P>0.05),见图3A;在3、 5、 7 d时, 当紫草素浓度大于1 μmol/L时,随着紫草素浓度增加,对细胞有抑制作用,当紫草素浓度在0.062 5~0.5 μmol/L范围时对hPDLSCs有促进增殖作用,差异有统计学意义(P<0.05),见图3B-D。模拟炎症微环境下:在24、48、72 h时,与对照组相比,LPS组有抑制细胞增殖的作用;与LPS组相比, 0.062 5~0.5 μmol/L浓度的紫草素+LPS组促进hPDLSCs增殖的作用, 且0.5 μmol/L浓度的紫草素作用最佳,差异有统计学意义(P<0.05),见图4。结合紫草素对hPDLSCs增殖活性的结果,后续实验选择0.5 μmol/L的药物浓度。
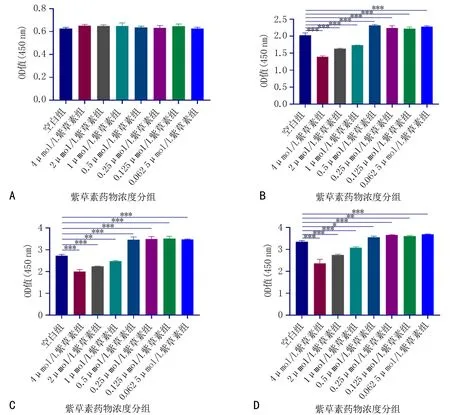
注:图3A为1 d结果,图3B为3 d结果,图3C为5 d结果,图3D为7 d结果。与空白组比较, *P<0.05, **P<0.01, ***P<0.001。
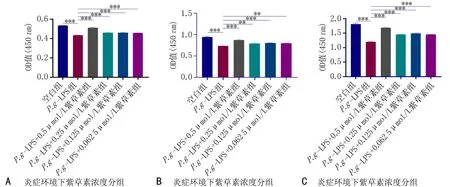
注: 图4A为1 d结果; 图4B为2 d结果; 图4C为3 d结果; 与LPS组比较, **P<0.01, ***P<0.001。
2.3 细胞划痕实验与空白组相比,LPS组细胞迁移率减小,紫草素细胞迁移率增加,差异有统计学意义(P<0.05);与LPS组相比,紫草素+LPS组细胞迁移率增加,差异有统计学意义(P<0.05),见图5、6。

图5 各组不同时间细胞划痕结果显微图(×40)

注:与空白组比较, ***P<0.001; 与LPS组比较, ###P<0.001。
2.4 细胞上清液中IL-6、IL-18的水平的测定与空白组相比,LPS组中IL-6、IL-18水平升高,差异有统计学意义(P<0.05);与LPS组相比,紫草素+LPS组中IL-6、IL-18水平降低,差异有统计学意义(P<0.05),如图7、8。
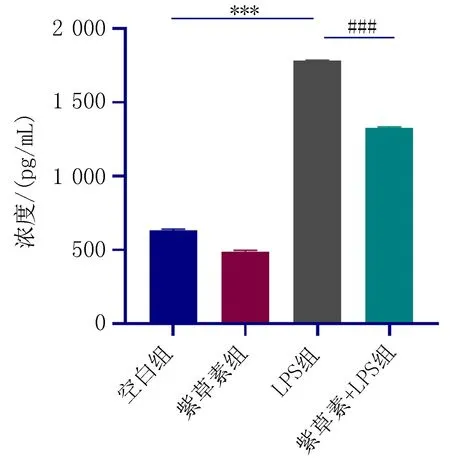
注:与空白组比较,***P<0.001; 与LPS组比较, ###P<0.001。
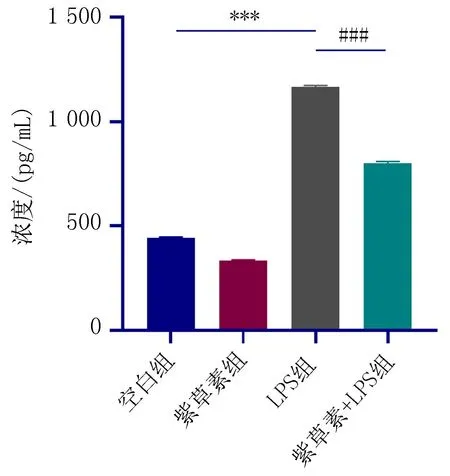
注:与空白组比较,***P<0.001; 与LPS组比较, ###P<0.001。
2.5 紫草素对模拟炎症环境下hPDLSCs的ALP活性的影响成骨诱导21 d后,与空白组相比,LPS组的染色深度明显降低,紫草素组的染色深度增加;与LPS组相比,紫草素+LPS组的染色深度加深。如图9、10。
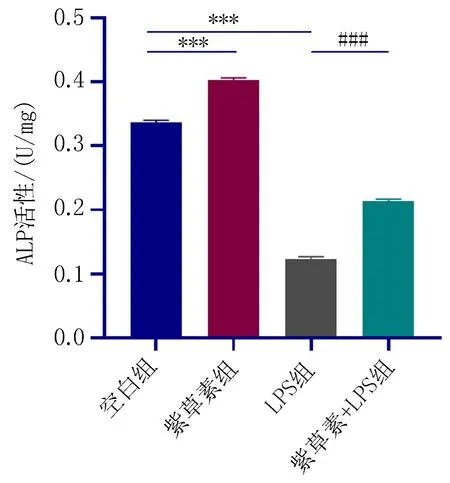
注:与空白组比较,***P<0.001; 与LPS组比较, ###P<0.001。
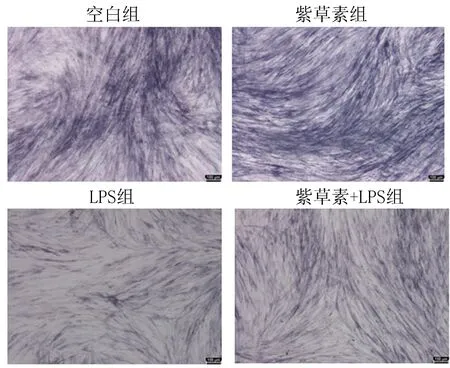
注:碱性磷酸酶染色显微镜下图(×40),标尺大小:100 μm。
2.6 紫草素对模拟炎症环境下hPDLSCs矿化作用的影响成骨诱导504 h后,与空白组相比,LPS组的矿化结节数减少,紫草素组的矿化结节数量增加且染色较深;与LPS组相比,紫草素+LPS组的矿化结节数量明显增加。如图11、12。
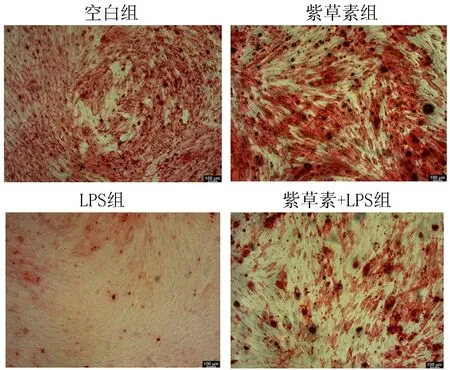
注:茜素红染色镜下图(×40),标尺大小:100 μm。

注:与空白组比较, ***P<0.001; 与LPS组比较, ###P<0.001。
2.7 紫草素对模拟炎症环境下hPDLSCs中OCN、RUNX2、ALP表达的影响RT-PCR结果显示:与空白组相比,LPS组中OCN、RUNX2、ALP表达降低,而紫草素组OCN、RUNX2、ALP表达增加,差异有统计学意义(P<0.05);与LPS组相比,紫草素+LPS组中OCN、RUNX2、ALP表达增加,差异有统计学意义(P<0.05),如图13、14、15。

注:与空白组比较, ***P<0.001; 与LPS组比较, ###P<0.001。
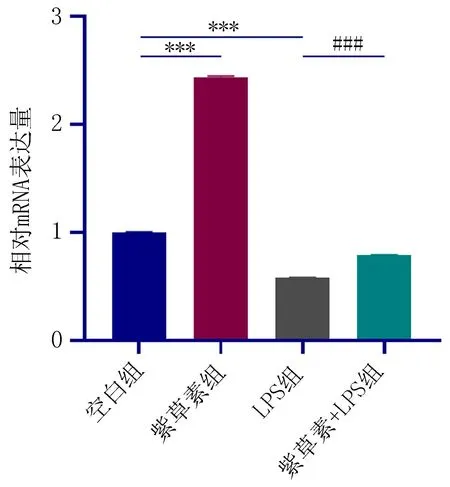
注:与空白组比较, ***P<0.001; 与LPS组比较, ###P<0.001。
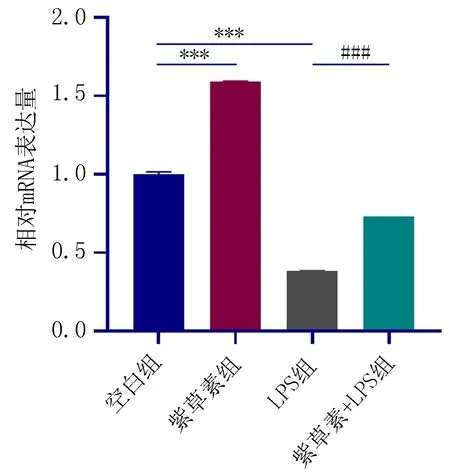
注:与空白组比较, ***P<0.001; 与LPS组比较, ###P<0.001。
3 讨论
牙周病的发生涉及一系列免疫炎症反应,炎症微环境会抑制牙周细胞成骨成血管反应,影响牙周组织的再生[17]。hPDLSCs是一种牙源性间充质干细胞,在牙周组织重建和骨再生中发挥重要作用[18]。研究发现炎症会抑制牙周组织的再生,紫草素具有明显的抗炎活性[19],能下调由脂多糖刺激的Toll样受体4的表达水平,抑制IL-1β、IL-6、TNF-α的分泌,并促进IL-10的分泌[20]。本课题组研究表明,紫草素对牙龈卟啉单胞菌和具核梭杆菌均有抑菌作用,并且可以减轻实验性小鼠牙周炎的炎症反应,抑制牙槽骨的吸收及破骨细胞的生成[21]。
本研究通过P.g-LPS刺激模拟体外炎症微环境[22],与TNF-α诱导结果相同,发现LPS能明显抑制hPDLSCs的增殖,说明LPS能成功模拟炎症微环境。利用CCK-8筛选出对hPDLSCs没有毒性且具有增殖作用的紫草素浓度范围后,在炎症微环境下筛选出增殖作用最佳的紫草素浓度为0.5 μmol/L。划痕实验能模拟细胞的愈合能力[23],本实验结果证明0.5 μmol/L浓度的紫草素能在炎症环境下促进细胞的迁移。牙周炎发生时IL-6可以使中性粒细胞激活,加剧炎症反应,还促使血管内皮生长因子(Vascular endothelial growth factor, VEGF)的生成,进而促进新生血管形成导致炎症反应的加剧[24]。IL-18可以诱导趋化因子、基质金属蛋白酶9(Matrix metalloproteinase-9, MMP-9)的释放[25],导致组织降解,还能促进炎症细胞的吞噬、抗感染,诱导慢性牙周炎症急性期蛋白的合成[26]。ELISA结果显示,对比空白组,LPS组的上清液中IL-6、IL-18水平升高,证明促炎成功。0.5μmol/L浓度的紫草素能够降低IL-6、IL-18水平,说明0.5 μmol/L浓度的紫草素具有明显的抗炎作用,这与前期研究结果一致[27]。
牙周组织再生最重要的是能否成骨,碱性磷酸酶染色和茜素红染色是观察成骨的标志性方法[28-29]。经成骨诱导后,ALP染色及活性测试和茜素红染色结果显示,LPS能够明显抑制hPDLSCs的成骨分化,说明炎症环境能抑制成骨分化。而0.5 μmol/L浓度的紫草素能够明显促进成骨分化,在炎症环境下也能促进成骨分化,这与课题组前期研究结果一致。说明0.5 μmol/L浓度的紫草素在正常环境及炎症环境下,均具有促进hPDLSCs成骨分化的作用。RNUX2作为一种骨形成的关键调节因子,能够调节一系列基因的表达,不仅能促进成骨细胞的增殖分化,还参与骨重塑和骨修复等过程[30]。OCN是一种钙化组织的非胶原基质蛋白,是一种明确的成骨细胞标志物与胶原蛋白和磷灰石结合,在骨吸收和矿化中发挥作用[31]。OCN、ALP是晚期骨形成和成骨细胞分化的成骨标志物[32]。本实验RT-PCR结果表明,0.5 μmol/L浓度的紫草素在正常及炎症微环境中均能不同程度的促进RUNX2、OCN和ALP的基因表达。但紫草素在炎症环境下促进hPDLSCs成骨分化的具体机制还有待进一步研究。
综上所述,适当浓度的紫草素在炎症环境下能够促进hPDLSCs的增殖和成骨分化,可作为慢性牙周炎防治的潜在备选药物。由于口腔是个复杂的环境,本课题组将进一步探究炎症微环境下紫草素对牙周组织再生的影响及机制,以期为牙周病的防治提供实验基础。
