EB病毒相关性噬血细胞综合征的治疗进展
2024-05-06徐晓军
邢 源,陈 艳,徐晓军
(1.遵义医科大学附属医院 小儿内科,贵州 遵义 563003;2.浙江大学附属儿童医院 肿瘤血液内科,浙江 杭州 310003)
噬血细胞性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis ,HLH)即称噬血细胞综合征,是一组患者有发热、全血细胞减少、肝脾肿大和铁蛋白升高等罕见、危及生命的临床综合征。根据疾病发作的病因分为两大类,原发性噬血(primary hemophagocytic lymphohistiocytosis,pHLH)和继发性噬血(secondary hemophagocytic lymphohistiocytosis,sHLH),继发性噬血以EB病毒感染最常见[1-2]。据流行病学调查显示,EB病毒(Epstein-Barr virus,EBV)是一种常见的人类疱疹病毒,在自然界中广泛存在,全世界约95%的人被EBV感染,呈隐性感染,形成EBV潜伏感染的状态[3]。由徐晓军教授牵头发起的儿童HLH全国多中心回顾性调查显示,74.4%的HLH患儿合并EBV的急性感染[4]。另外据日本文献报道,超过50%的HLH患儿和EBV有关,其病死率达41%[5]。噬血细胞综合征的预后很差。1983年,据文献报道长期生存率为4%,随着国际治疗合作的引入,HLH的生存率在很大程度上被提高[6-7]。
1 HLH的一线与挽救治疗
1.1 一线治疗 HLH病死率高,诊断后应立即采用HLH-94/04方案[8]。HLH-94/04方案包括8周的初始治疗,主要药物包括依托泊苷(etoposide,VP-16)和地塞米松(dexamethasone,DXM),HLH-94和HLH-04方案5年生存率分别为54%和61%[6,9]。提示目前以DXM和VP16为基础的HLH治疗方案存在瓶颈,需纳入新的治疗手段方能提高疗效。另有研究报道VP-16可以抗EBV,干扰EBV诱导的T淋巴细胞转化,并抑制EBV核抗原的合成,清除EBV病毒,早期使用VP-16的HLH患者不仅能延缓病情进展且可提高生存率[4]。儿童EBV-HLH的治疗效果显著优于恶性肿瘤相关性HLH(malignancy-associated HLH,M-HLH)、家族性HLH(familial HLH,F-HLH)、X-连锁淋巴组织增生性疾病(x-linked lymphoproliferative disease,XLP)等亚型的HLH,国内外研究分别显示其5年总体生存率可以达到80%左右[10-11]。目前HLH-94/HLH-04方案可以提高患者的生存率,但仍有部分患者治疗反应不佳,即至少接受为期2周HLH-94/04方案治疗后效果不佳的患者是难治性HLH[12]。随着靶向药物被逐渐的认识和应用,靶向药物为HLH治疗提供了更多的选择[13-15]。
1.2 挽救治疗 一线治疗经评估无效时,需尽早进行挽救治疗。Wang等[16]将多柔比星脂质体、依托泊苷和甲泼尼龙组合方案(doxorubicin-Etoposide-meprednisone,DEP)治疗难治性HLH,显示总体缓解率(overall response rate,ORR)76.2%。在此基础上,他们又将培门冬酶加入到DEP方案中,即由脂质体多柔比星、依托泊苷、甲泼尼龙联合PEG-天冬氨酸酶(Peg-aspargase-Doxorubicin VP-16 meprednisone,L-DEP)治疗方案,发现接受L-DEP方案的患者总体缓解率优于接受DEP方案的患者(88.37% vs 65.38%),提示DEP/L-DEP是一种良好的挽救治疗方法[17]。Zhao等[18]应用L-DEP方案治疗儿童难治性HLH,结果显示26例患儿中19.2%(5/26)获得完全缓解(complete response,CR),42.3%(11/26)获得部分缓解(partial response,PR),总体缓解率61.5%。达到缓解的患者中有62.5%患者接受同种异体造血干细胞移植(allogeneic hematopoietic stem-cell transplanttion,allo-HSCT),在最终随访中,70%患者存活。L-DEP方案对于难治性EBV-HLH儿童而言也是一种有效而且相对安全的挽救治疗方法,同时可以作为连接造血干细胞移植的桥梁。
2 HLH的靶向药物治疗
2.1 抑制剂(阻断剂)类药物
2.1.1 芦可替尼(ruxolitinib) 它是一种酪氨酸激酶JAK1/2 抑制剂,可以抑制干扰素-γ(interferon-gamma,IFN-γ)、白细胞介素(interleukin,IL)-2、IL-6、IL-10等多种不同细胞因子的产生[19]。有研究报道,分别被淋巴细胞性脉络膜脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)、CpG DNA感染诱发的原发性HLH和继发性HLH两种小鼠模型,应用芦可替尼后可以限制小鼠模型CD8+T细胞扩增、降低细胞因子并减少组织炎症反应、改善各脏器功能,显著减轻HLH症状的表现[20]。基于芦可替尼能抑制炎症反应,临床上开始应用芦可替尼治疗HLH。2017年,Sin等[21]首次报道芦可替尼治疗1例难治性EBV-HLH患者,血清铁蛋白降低,各脏器功能改善。此后,国内外陆续出现了临床研究报道芦可替尼对复发难治性HLH有一定的疗效,同时对于不适宜化疗的患儿也可作为替代化疗的治疗方案。北京儿童医院开展了应用芦可替尼治疗儿童继发性HLH的Ⅰ期和Ⅱ期两项临床研究(ChiCTR2000029977)和(ChiCTR2000031702)[22-23]。Ⅰ期临床试验包括12例HLH患者,其中8例EBV-HLH患者。患者持续口服芦可替尼28 d,总体缓解率83.3%,其中8例EBV-HLH患者接受芦可替尼治疗后均达到缓解,完全缓解率(CR)是75%,部分缓解率(PR)是25%。Ⅱ期临床研究共纳入52例患儿,包括24例EBV-HLH和10例慢性活动性EBV感染相关HLH(chronic active EBV infection-associated HLH,CAEBV-HLH),11例全身性自身炎症性疾病相关HLH(systemic autoinflammatory disorder-associated HLH,SAIDs-HLH)和7例病因不明的患儿。所有患儿均在3 d内产生反应,整体反应率为69.2%(36/52),尤其EBV-HLH患儿最敏感,总体缓解率87.5%。此外,国外的一项新诊断的成年HLH患者应用芦可替尼的Ⅰ期临床试验(NCT02400463)正在进行中,根据已公布前5例入组患者的当前研究数据,表明早期应用芦可替尼干预继发性HLH是可行性高、耐受性良好及可能使患者受益的治疗方案[24-25]。当前法国针对于芦可替尼作为HLH的一线治疗开展了Ⅱ期临床研究(NCT05762640),预计2026年完成。总体而言,目前国内外已开展的临床研究试验均说明了应用芦可替尼治疗继发性HLH是一种安全且有效、毒性低、比强化化疗耐受性好的一种治疗方案,因此芦可替尼联合其他化疗药物治疗复发难治性HLH的策略也在探索中。Wei等[26]回顾性分析了16例接受RU-DEP+/-L治疗HLH患儿的临床资料。16例患儿(13例EBV-HLH),总体反应率62.5%(10/16),46.7%(7/15)患儿血浆EBV-DNA转阴,中位随访时间35.1个月,56.2%的患儿存活。研究结果提示RU-DEP+/-L是难治性EBV-HLH的一种安全、有效的挽救方案。
2.1.2 阿那白滞素(anakinra) 它是一种重组人IL-1受体阻断剂,被推荐作为继发性HLH(sHLH)的治疗[27]。IL-1主要分布在人体免疫系统中的重要细胞类型上,IL-1与受体结合后,产生大量炎症因子,在系统性幼年特发性关节炎(systemic juvenile idiopathic arthritis,sJIA)和EBV感染相关性HLH的发病中发挥重要作用[28-29]。Eloseily等[30]共纳入44例sHLH/巨噬细胞活化综合征(macrophage activation syndrome,MAS)患儿接受阿那白滞素治疗,治疗15 d内血清铁蛋白显著下降,总体死亡率27%,结果表明阿那白滞素可以有效治疗继发性HLH/MAS患儿、降低死亡率。阿那白滞素也可以应用于继发性HLH的一线治疗[31]。
2.2 单抗类药物
2.2.1 依马利尤单抗(emapalumab) 它是一种可以中和IFN-γ的单克隆抗体,控制炎症,维持细胞免疫稳态,有效控制HLH[32]。2018年11月,依马利尤单抗在美国获得全球首批的细胞因子靶向治疗HLH,用于治疗难治、复发或者对常规化疗不耐受的患者[33]。一项临床试验(NCT01818492)评估依马利尤单抗治疗34例原发性HLH患儿的安全性和有效性[34]。依马利尤单抗的起始剂量每3天1 mg/kg静脉输注,根据临床评估患者病情,调整药物剂量,剂量可增加至3、6 mg/kg及最大剂量10 mg/kg。结果显示炎症因子显著下降,噬血症状改善,随访1年后总生存率71%,复发难治组的总缓解率为63%,治疗后70%的患者可桥接移植,移植后1年的总体生存率为89.5%。提示依马利尤单抗是治疗原发性HLH的一种低毒高效的药物。但约53%的依马利尤单抗接受者发生严重不良反应,包括感染、胃肠道出血和多器官功能障碍,感染最常见(56%)。一项临床试验(NCT03985423)旨在评估依马利尤单抗在成年HLH患者中的有效性[35]。此外,有文献报道该药物可以治疗合并严重感染的难治性EBV-HLH患儿[36]。因此,应用依马利尤单抗治疗继发性HLH的方案也在临床探索中。
2.2.2 细胞程序性死亡受体-1(programmed cell death 1,PD-1)单抗 细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)功能耗竭是继发性HLH发病的重要特征,表现为PD-1明显上调。利用PD-1单克隆抗体阻滞PD-1途径,使CTL恢复其杀伤功能,从而清除炎症因子和减缓继发疾病发展进程[37]。一项临床研究显示,PD-1抑制剂可以恢复抗EBV的活性并根除EBV。这项回顾性分析纳入7例复发、难治性EBV-HLH患儿接受那武利尤单抗单药治疗[38]。诱导治疗期间患者每3至4周经静脉注射100~200 mg,EBV-DNA转阴后,患者继续接受每3个月静脉注射100 mg维持治疗,时间为1年。71.4%患者实现了临床CR,57.1%患者EBV-DNA被完全根除,数据表明,纳武利尤单抗作为单一疗法,为难治易复发EBV-HLH 提供了潜在的治愈方法。另有报道应用PD-1抑制剂治疗16例CAEBV患者,12例患者对PD-1抑制剂有反应,在治疗期间,3例患者EBV-DNA拷贝数逐渐下降,PD-1抑制剂的安全性和耐受性均可以接受,未观察到与药物相关的严重副反应,故PD-1抑制剂治疗CAEBV患者和根除EBV具有显著效果[39]。Song等[40]使用PD-1抑制剂联合来那度胺治疗24例CAEBV患者,每2周的第1天开始给予静脉注射PD-1抑制剂和持续2周患者每天均口服来那度胺5 mg(年龄<18岁)/10 mg(年龄≥18岁),持续2周。总体缓解率为 54.2%,EBV-DNA 拷贝数显著下降,1年总生存率为91.3%。PD-1抑制剂是CAEBV患者的有效治疗方法。与之不同的是,笔者所在课题组报告了1例EBV-HLH患儿,在接受PD-1抑制剂纳武利尤单抗治疗后,IL-10和IFN-γ炎症因子升高,即出现暴发性细胞因子释放综合征(cytokine release syndrome,CRS)[41]。在Liu等[38]的研究中那武利尤单抗治疗HLH的研究结果与笔者所在课题组得出的结论不一致,考虑可能是由于不同EBV-HLH患者的病理生理学存在个体差异,个体差异会导致不同的结果。值得注意的是,PD-1抑制剂治疗过程中出现的潜在风险即伴有并发症CRS,需要进一步探讨如何在确保治疗效果的情况下减少不良反应的发生。
2.2.3 利妥昔单抗(rituximab) 它是抗血细胞簇分化抗原20(cluster of differentiation 20,CD20)的单克隆抗体,通过迅速消耗循环床中的B淋巴细胞并减少B细胞介导的炎症反应[42]。国外一临床研究纳入42例EBV-HLH患者接受含有利妥昔单抗的治疗方案,通过降低病毒载量、减少炎症反应,改善疾病症状,总生存率达61.9%(26/42)[43]。另一临床研究也采用利妥昔单抗联合常规化疗方案治疗15例EBV-HLH患者,10例仅B细胞受EBV感染的患者经1次治疗后EBV DNA转阴,另外5例主要被T淋巴细胞和自然杀伤(natural killer,NK)细胞感染的患者经治疗前后显示EBV-DNA无显著下降趋势,结果表明利妥昔单抗用于治疗主要以B淋巴细胞被感染的EBV-HLH[44]。故利妥昔单抗在临床上用于治疗EBV-HLH 具有良好前景。
2.2.4 阿仑单抗(alemtuzumab) 它主要是一种抗血细胞簇分化抗原52(cluster of differentiation 52,CD52)的单克隆抗体,CD52抗原在淋巴细胞和单核细胞系统均有表达,阿仑单抗可以导致淋巴细胞、NK细胞和单核巨噬细胞快速耗尽并从循环床中消除[45]。Marsh等[46]回顾性分析22例难治性HLH患者接受阿伦单抗联合常规化疗方案治疗,63.6%的患者获得部分缓解,5例患者的HLH症状或实验室指标至少改善25%,后续77%患者存活后接受造血干细胞移植,表明阿伦单抗可能是难治性HLH的一种有效治疗药物,可作为造血干细胞移植治疗HLH的桥梁。目前,阿仑单抗也是HLH造血干细胞移植非清髓预处理方案的核心药物之一[47]。此外,阿仑单抗被作为HLH的一线治疗方案也获得了鼓舞人心的结果[48]。一项Ⅱ期临床试验(NCT02472054)针对于评估阿仑单抗联合糖皮质激素作为原发性HLH的一线治疗方法正在进行中,期待提供进一步的相关信息。目前HLH靶向治疗相关的药物具体见表1。
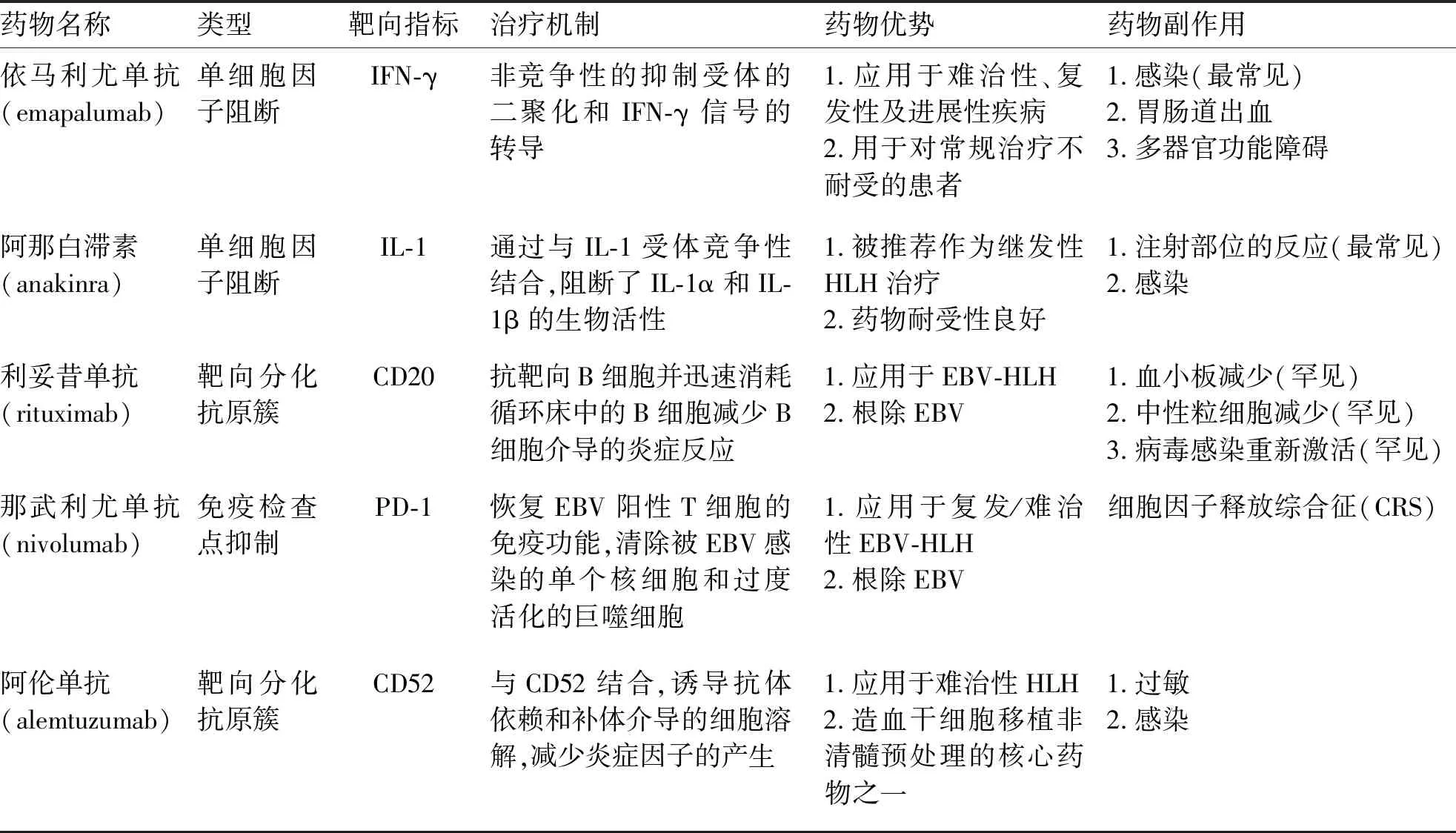
表1 与HLH靶向治疗相关的药物
3 HLH的其他治疗方法
3.1 血液净化 部分HLH患儿采用HLH-94/04等常规化疗方案后疗效不佳,尤其是早期合并多器官功能衰竭的HLH患者[49]。故早期快速改善多器官功能和降低细胞因子是改善HLH患儿预后的关键问题。血浆置换(plasma exchange,PE)和连续性肾脏替代治疗(continuous renal replacement,CRRT)是体外血液净化技术,主要是控制高细胞因子血症,改善HLH患者脏器功能,目前已被广泛应用于过度炎症反应综合征、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)等疾病[50-51]。课题组前期纳入8例重症的EBV-HLH患者,接受PE+CRRT联合常规化疗免疫疗法,白细胞介素2受体(soluble interleukin 2 receptor,SIL-2R)和细胞因子降低,还显著降低了EBV DNA,疗效显著,未出现严重副作用,87.5%(7/8)患儿获得完全缓解[52]。同时,笔者所在的陈艳教授团队陆续应用PE+CRRT联合常规免疫疗法治疗重症HLH患者,结果显示无论是儿童EBV-HLH还是非EBV-HLH均有较好的治疗效果,此外,采用PE+CRRT联合化学免疫疗法较单纯化免疫疗法疗效好,生存率高,同时可以降低血清铁蛋白,多脏器功能被改善,短时间内可以很好的控制体温,使细胞因子降低,是治疗重型HLH的好方法[53-56]。国内一项多中心流行病学研究,共纳入66例HLH患者,结果显示PE组好转率为62.1%,CRRT组好转率55.9%,研究提示PE主要应用肝功能异常HLH患儿,CRRT联合PE应用是以肾功能损伤和血流动力学不稳定的患儿为主[57]。但应注意的是,PE疗法快速置换血浆引起血流动力学不稳定,患者会出现低血压、脑水肿等不良反应,CRRT作用持续且缓慢,可以协助改善循环功能[58]。
3.2 造血干细胞移植 造血干细胞移植是治愈复发难治性HLH的主要手段。在HLH-94和HLH-04的研究中,HLH患者接受HSCT后5年生存率均为66%,一方面提示对于复发难治性EBV-HLH患者尽快进行HSCT能挽救生命;同时也显示HLH的HSCT存在一定的瓶颈,需要优化[6,9]。其中移植预处理和供者选择是最主要的两个方面。关于移植前预处理,国外多采用以CD52单抗为基础的减低剂量的预处理方式,可显著降低移植相关毒性,患儿的长期生存率可达到92%,明显优于清髓性预处理的方案。但移植后混合嵌合状态是该预处理方式的主要问题,可发生于65%的患儿,需要通过撤减免疫抑制剂、供者淋巴细胞输注等方式进行应对[59]。而国内近期的研究提示,清髓性预处理方案对于EBV-HLH也能取得较好的疗效。国内各中心多采用以清髓性预处理(modified myeloablative conditioning,MAC)为基础的造血干细胞移植(MAC-HSCT)治疗EBV-HLH,其3年的总体生存率可达到63.3%~87.7%,结果说明MAC-HSCT是HLH的有效治疗方案[60-61]。各移植中心可根据经验选择清髓或非清髓方案进行造血干细胞移植。关于移植供者,早年日本的研究显示脐带血移植治疗家族性HLH和EBV-HLH的10年生存率分别为(65.0±7.9)%和(85.7±9.4)%[62]。对于家族性HLH,非亲缘供者移植死亡率高于亲缘供者和脐带血;而EBV-HLH以脐血移植为主,由于病例数量不多且生存率高,并未发现差别。随着半相合移植技术的进步,目前国内应用半相合移植治疗EBV-HLH应用较多,疗效也非常不错,移植后总体生存率60%以上[60,63]。
4 总结
目前,HLH进入精准治疗的时代,基因测序技术的进展、细胞因子等检测的临床普及,以及各类小分子药物和靶向药物的上市,为HLH的精准诊治提供了手段。EBV-HLH作为我国儿童最常见的HLH亚型,虽然大部分患者治疗反应良好,但仍有部分病人表现为复发难治,相信随着这些技术和新药的应用,其治疗必能突破HLH-94和HLH-2004的瓶颈,为更多的患儿带来希望。
