原发性肺内髓外浆细胞瘤18F-FDG PET/CT显像1例报告并文献复习
2024-05-06李蕾胡晓燕罗娜娜彭辽河邱大胜
李蕾,胡晓燕,罗娜娜,彭辽河,邱大胜
0 引言
浆细胞肿瘤可分为多发性骨髓瘤(累及骨髓及其他全身)、孤立性骨髓瘤(骨浆细胞瘤)、髓外(软组织)浆细胞瘤和浆母细胞肉瘤[1]。髓外浆细胞瘤(extramedullary plasmacytoma, EMP)是一种罕见的不累及骨髓的软组织浆细胞瘤,约占所有浆细胞肿瘤的3%~5%,以上呼吸道及上消化道多见,约占80%~90%,且多见于鼻腔、鼻窦及口鼻咽部[2]。该病的病因尚不清楚,但病毒发病机制和慢性刺激被认为是主要因素[3]。发生在肺部的EMP极其少见,尤其发生区域淋巴结转移时极易误诊,本文主要分析1例发生在肺门及纵隔的浆细胞瘤的影像学表现及临床特点,并进行相关的文献复习,为肺内EMP的诊疗提供更多的经验。
1 临床资料
患者男,68岁,于2022年2月无明显诱因出现咳嗽、咳痰,无发热及活动后气喘,2022年4月自感症状加重。外院胸部CT提示左肺占位,肿瘤待排,给予抗感染等对症治疗后症状未见明显改善,前往我院进一步就诊,门诊以“左肺占位待查”收入我院胸内科。既往有高血压及头孢过敏史。痰培养及肺癌相关肿瘤标志物阴性。胸部增强CT结果显示:左肺门旁软组织肿块,与纵隔多发肿大淋巴结分界不清,最大层面大小约10.2 cm×11.5 cm,边界不清,增强扫描呈稍不均匀中度强化,肿块内见增粗血管影,病灶包埋气管、左、右主支气管、主动脉弓、降主动脉、肺动脉干、左、右肺动脉及左肺静脉,与食管壁、上腔静脉及心包分界不清,见图1。18F-FDG PET/CT结果显示:左肺门区及前中后纵隔内见多发软组织密度结节及肿块影,密度较均匀,边界不清,PET于相应部位见不均质异常放射性浓聚影,SUVmax范围约4.28~9.38。左侧胸腔内见弧形液体密度影,见图2。在18F-FDG PET/CT引导下对左前上纵隔淋巴结进行穿刺活检,病理示:镜下见弥漫一致分布的异型浆细胞(图3),结合形态及免疫表型考虑浆细胞瘤,建议临床检查本周蛋白、M蛋白等进一步证实。 免疫组织化学结果:CD45/LCA(弱+),PAX5(-),CD20(-),CD3(-),CD5(-),CD79a(+),CD38(+),CD138(+),CD56(散在+),λ(个别+),κ(弱+),MUM1(+),TdT(-),PCK(-),CK7(-),CK19(-),TTF-1(8G7G3/1)(-),Syn(-),CgA(-),INSM1(散在弱+),P63(散在弱+),Ki67(Li: 15%)。骨髓穿刺结果示骨髓象:原幼淋巴细胞占0.5%,浆细胞小于5%。尿本周蛋白、血清蛋白免疫固定结果分析提示微量IgA-KAP型M蛋白血症。综上明确诊断为肺内EMP伴局部淋巴结转移。

图1 患者平扫及增强CT影像学表现Figure 1 Plain and enhanced CT images of the patient
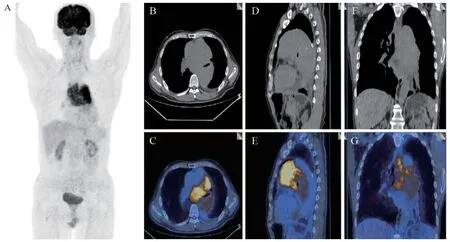
图2 患者18F-FDG PET/CT影像学表现Figure 2 18F-FDG PET/CT imaging of the patient

图3 左上纵隔肿块穿刺活检常规病理结果 (HE ×200)Figure 3 Routine pathological results of the biopsy of the left upper mediastinal massy (HE ×200)
2 讨论
原发性肺内EMP比较罕见,没有特异性临床表现,有慢性咳嗽、发烧、咳痰、胸闷和咯血等症状的报道,压迫或侵犯气管和支气管会引起呼吸困难、咳痰和咯血;如果累及胸膜,患者可能会感到胸痛[1]。患者多为中老年,平均年龄60岁,50岁以下占1/4,男女发病率无明显差异[4-5]。EMP的诊断标准:(1)活检组织标本显示浆细胞组织学特征;(2)病理样本免疫组织化学和(或)血液或尿液免疫电泳显示存在单克隆疾病;(3)骨髓浆细胞浸润不超过所有有核细胞的10%;(4)无溶骨性病变,无贫血、高钙血症或肾功能不全[1]。病检组织学结果提示单克隆浆细胞浸润及免疫组织化学细胞表达CD138和(或)CD38[6]。肺内EMP分期一般采用Wilshaw法:Ⅰ期:肿瘤局限于原发部位;Ⅱ期:局部淋巴结转移;Ⅲ期:有明显的远处广泛转移[7]。本例患者结合影像学检查排除溶骨性病变、骨髓穿刺浆细胞小于10%、实验室检查血清蛋白免疫固定电泳提示IgA-KAP型M蛋白血症、病理学检查发现弥漫一致分布的异型浆细胞及免疫组织化学CD38(+)、CD138(+)可以明确诊断为肺内EMPⅡ期。
原发性肺内EMP CT表现多为孤立性肺结节或团块影,多位于肺门区支气管附近,圆形或类圆形,密度相对均匀[1,8-9],极少出现坏死和钙化[4],少见显示多个阴影团块[5],可发生区域淋巴结浸润及远处转移[8]。CT增强扫描病灶呈中度至明显强化,肿瘤内及周边可见迂曲增粗的血管影[8-9]。本病例CT增强表现为左下肺门软组织密度类圆形肿块,其内见增粗血管影及纵隔多发肿大淋巴结影,与上述文献报道一致。
本例患者18F-FDG PET/CT表现为左肺门及纵隔内多发软组织密度结节及肿块,FDG代谢不均质增高,左肺门肿块FDG摄取值(SUVmax约4.28)明显低于纵隔肿块(SUVmax约9.38),此代谢的差异性可能与肿瘤的异质性有关,具体原因有待进一步研究。有研究[10]显示孤立性浆细胞瘤对FDG摄取阳性的比例高达82%,并与肿瘤大小显著相关:FDG浓聚病灶比FDG阴性病灶更大(41.4 mmvs.23.5 mm)。本例患者在影像表现上应与淋巴瘤、中央型肺癌伴淋巴结转移及结核瘤相鉴别。淋巴瘤是血液系统最常见的恶性肿瘤,临床症状常表现为低热、消瘦、乏力等,其生物学特点决定了其逐级或跳跃式累及不同部位淋巴结,因此常累及纵隔及肺门以外的淋巴结,表现为大小不等、形态及分布不规律,密度较均匀,相互融合成较大肿块可出现缺血坏死[11],可侵犯肝、脾等结外器官,对FDG的摄取程度与淋巴瘤的侵袭性有关。中央型肺癌伴淋巴结转移:中央型肺癌病理类型上以鳞癌多见,肿块较大时常伴坏死,钙化少见,可引起阻塞性肺炎和肺不张,易发生肺门及纵隔淋巴结转移。结核瘤:患者常有咳嗽、咳痰、咯血、午后低热、盗汗等临床表现,病灶常伴坏死、钙化,肺内结核瘤周围常伴卫星灶。因恶性肿瘤细胞及结核的炎性细胞的葡萄糖代谢均会增加,在18F-FDG PET/CT上均表现为FDG高摄取,影像学表现有时候缺乏明确的特异性,因此确诊需要依靠病理学检查。18F-FDG PET/CT作为代谢特性与解剖学的结合,能一次进行全身显像,有研究报道18F-FDG PET/CT对EMP的诊断及评估预后优于MRI,FDG阳性病灶数量大于2进展为多发性骨髓瘤的风险更高[6]。18F-FDG PET/CT 能够引导穿刺活检,排除溶骨性骨病变,判断远处是否有转移,有利于分期。18F-PET/CT能够区分疾病的代谢活性部位和非活性部位,可提供更早的反应评估,并可预测预后,被国际指南推荐使用[12]。
目前尚无针对肺内EMP患者的既定治疗方法。解剖性肺切除术联合或不联合放疗是治疗肺内EMP的有效方法[13]。化疗适用于肺内多发病灶[5]。对于肿瘤大于5 cm的患者部分学者推荐辅助化疗[6]。EMP与其他浆细胞肿瘤相比预后良好,10年生存率约为75%[14]。然而,在EMP治疗后,大约19%的病例发生局部或远处复发,14%转化为多发性骨髓瘤,时间往往发生在首次诊断后的2~3年内[15],因此强烈建议密切追踪。本例患者拒绝本院治疗出院。截止投稿日期前行电话随访,患者自述从本院出院后在当地胸科医院进行局部放射治疗,具体剂量及次数不详,未进行其他辅助治疗,目前疾病控制稳定,未出现明确进展。
利益冲突声明:
所有作者均声明不存在利益冲突。
