奥拉帕利联合贝伐珠单抗方案对卵巢癌患者近期疗效及血清P-selectin、sICAM-1水平的影响
2024-05-06张新高雁荣黄伟娟李秀芳
张新,高雁荣,黄伟娟,李秀芳
(安阳市肿瘤医院 1.妇三科;2.妇二科,河南 安阳 455000)
卵巢癌是妇科临床常见恶性肿瘤,由于该病多发于盆腔深处,早期症状隐匿不易被发现,部分患者确诊时已处于中晚期,失去手术机会。针对此类患者临床常采取常规化疗治疗,但化疗易出现胃肠道不适、恶心呕吐等毒副反应,且长时间使用易产生耐药性[1]。贝伐珠单抗是一种靶向药物,可抑制肿瘤细胞转移、扩散,阻止新生血管生成,但其可能会增加肿瘤患者毒副反应[2]。奥拉帕利为新型靶向药物,可抑制肿瘤细胞增殖[3]。目前,临床对于奥拉帕利与贝伐珠单抗联合治疗卵巢癌的研究较少,基于此,本研究选取87例卵巢癌患者,以探讨两药联合对其疗效、T淋巴细胞、肿瘤标志物及相关血清因子的影响,现报告如下。
1 资料与方法
1.1 一般资料
以2019年1月至2021年5月安阳市肿瘤医院收治的87例卵巢癌患者为研究对象,依据不同治疗方案分为参照组(43例)、研究组(44例)。参照组年龄42~67岁,平均(54.75±5.93)岁;体重指数(BMI)20~26 kg/m2,平 均(23.16±1.15)kg/m2;其中粘液性9例,子宫内膜癌5例,浆液性27例,其他2例;肿瘤分期:Ⅲ期24例,Ⅳ期19例。研究组年龄43~68岁,平均(55.52±5.79)岁;BMI 21~27 kg/m2,平均(23.67±1.32)kg/m2,其中粘液性8例,子宫内膜癌4例,浆液性29例,其他3例;肿瘤分期:Ⅲ期23例,Ⅳ期21例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准,患者或其家属知情本研究且签署同意书。
1.2 纳入与排除标准
纳入标准:预计生存期≥6个月;首次发病;符合卵巢癌相关诊断标准[4];经病理学及影像学检查确诊为卵巢癌,且存在病灶;已进行新辅助化疗+手术治疗,且化疗6~8周期。排除标准:研究前1个月内有手术史;合并重要脏器严重功能障碍;伴有血液、免疫系统疾病;患有其他部位恶性肿瘤;依从性差,无法配合治疗者;存在精神疾病或认知障碍;对本研究药物过敏或不耐受;卵巢癌远处转移。
1.3 方法
1.3.1 参照组 于术后第2周期增加贝伐珠单抗[信达生物制药(苏州)有限公司,国药准字S20200013,规格:4 mL∶100 mg]治疗,取7.5 mg/kg该药与250 mL 0.9%氯化钠溶液混合后静脉滴注,第1次滴注时间<1.5 h,第2次及以后滴注时间>1 h,1次/2周,21 d为1个周期,持续治疗22周期。
1.3.2 研究组 在参照组基础上,于术后化疗8周期后1个月增加奥拉帕利(AbbVie Deutschland GmbH &Co.KG,国药准字H20180049,规格:150 mg)治疗,300 mg/次,2次/d。持续治疗2年。
1.4 观察指标
1.4.1 临床疗效 治疗完成后观察4周,比较两组治疗后疾病控制率(DCR)、总缓解率(ORR)。疾病进展(PD):病灶最大直径之和增加>20%,或出现新病灶;稳定(SD):病灶最大直径之和减小<30%,或病灶最大直径之和增加<20%;部分缓解(PR):病灶最大直径之和减小>30%,持续时间>4周;完全缓解(CR):病灶完全消失,且持续时间>4周[5]。ORR=[1-(SD+PD)]/总例数×100%;DCR=(1-PD)/总例数×100%。
1.4.2 肿瘤标志物及血管内皮生长因子(VEGF)水平 分别于治疗前、治疗4周后采集患者空腹静脉血4 mL,离心处理后(3 000 r/min,半径8 cm,时间10 min)取上清液,保存于-70℃环境中待检,采用电化学发光免疫分析法检测糖类抗原(CA199、CA125)、癌胚抗原(CEA)水平,采用酶联免疫吸附试验(ELISA)检测VEGF水平。
1.4.3 T淋巴细胞 分别于治疗前、治疗4周后采集患者空腹静脉血3 mL,离心处理后(3 000 r/min,半径8 cm,时间10 min)取上清液,保存于-70℃环境中待检,采用艾森生物(杭州)有限公司生产的NovoCyte D2061R型流式细胞仪检测CD4+、CD8+、CD3+水平并计算CD4+/CD8+。
1.4.4 可溶性P-选择素(P-selectin)、可溶性细胞间粘附分子-1(sICAM-1)分别于治疗前、治疗4周后采集患者空腹静脉血2 mL,离心处理后(3 000 r/min,半径8 cm,时间10 min)取上清液,保存于-70℃环境中待检,采用ELISA法测定P-selectin及sICAM-1水平。
1.4.5 毒副反应 观察两组治疗期间出现胃肠道反应、黏膜出血、肝肾损伤、血小板减少等毒副反应发生情况。
1.5 统计学方法
采用SPSS 22.0对数据进行分析,计数资料以百分率(%)表示,比较用χ2检验,计量资料以均数±标准差()表示,比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
治疗后研究组ORR(70.45%)高于参照组(48.84%),差异有统计学意义(χ2=4.226,P=0.001);治疗后两组DCR比较,差异无统计学意义(χ2=0.040,P=0.971)。见表1。
2.2 两组治疗前后肿瘤标志物及VEGF水平比较
治疗后两组CEA、CA199、VEGF及CA125水平均明显下降,其中研究组下降幅度更为显著,差异有统计学意义(P<0.05)。见表2。
表2 两组治疗前后肿瘤标志物及VEGF水平比较 ()

表2 两组治疗前后肿瘤标志物及VEGF水平比较 ()
注:†与治疗前比较,P<0.05。
2.3 两组治疗前后T淋巴细胞比较
与治疗前比较,两组CD8+水平均升高,CD4+、CD3+、CD4+/CD8+水平均降低,差异有统计学意义(P<0.05);两组治疗后CD8+、CD4+、CD3+、CD4+/CD8+比较,差异无统计学意义(P>0.05)。见表3。
表3 两组治疗前后T淋巴细胞比较 ()
注:†与治疗前比较,P<0.05。
2.4 两组治疗前后sICAM-1及P-selectin比较
治疗后研究组sICAM-1、P-selectin水平低于参照组,差异有统计学意义(P<0.05)。见表4。
表4 两组治疗前后sICAM-1及P-selectin比较 (,ng/mL)
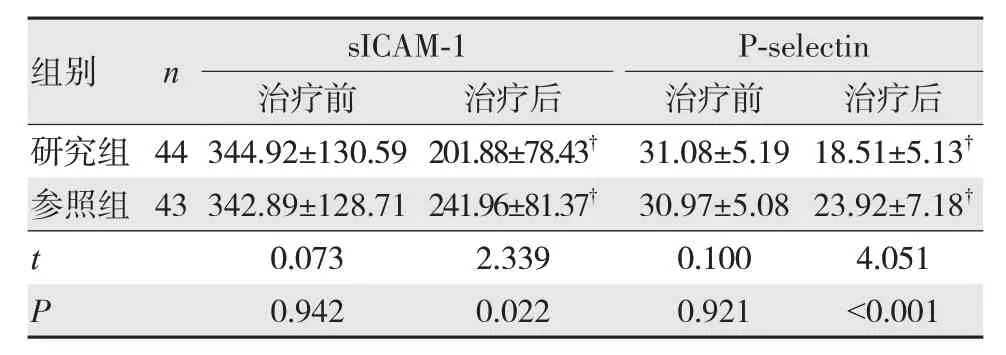
表4 两组治疗前后sICAM-1及P-selectin比较 (,ng/mL)
注:†与治疗前比较,P<0.05。
2.5 两组毒副反应发生情况比较
研究组肝肾损伤、血小板减少、胃肠道反应及黏膜出血等毒副反应情况与参照组比较,差异无统计学意义(P>0.05)。见表5。
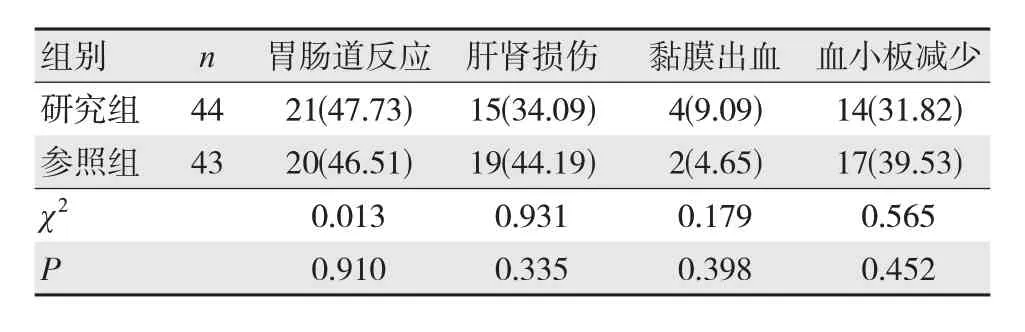
表5 两组毒副反应发生率比较 [n(%)]
3 讨论
目前,卵巢癌的病因尚无法明确,其作为一种异质性较高的恶性肿瘤,具有治疗难度大、预后差及病死率高等特点。有研究表明,其病死率高居妇科肿瘤之首,对患者生命健康产生严重威胁[6]。
临床常使用新辅助化疗、肿瘤细胞减灭术、常规化疗等方式治疗卵巢癌。但对于确诊时已无法手术或化疗效果欠佳患者,有研究尝试使用靶向药物与化疗联合治疗,以提高疗效[7]。贝伐珠单抗是治疗肿瘤的一线药物,可与VEGF结合,阻断VEGF传导信号,延缓血管生长,抑制肿瘤。马文波等[8]研究表明,贝伐珠单抗联合化疗治疗可发挥协同作用,提高疗效。奥拉帕利与贝伐珠单抗同为靶向药物,可抑制肿瘤细胞的生长、转移,从而抑制肿瘤进展[9]。本研究结果显示,治疗后研究组ORR高于参照组,表示联合治疗效果优于单一用药。有研究指出,在肿瘤生长、转移、扩散的过程中,不断有新生血管出现,其可为肿瘤细胞提供所需营养及氧气,因此,抑制新生血管可抑制肿瘤细胞增殖[10]。本研究显示,治疗后研究组肿瘤标志物及VEGF水平均低于参照组,其中VEGF即为促进新生血管生成的重要因子,而CA199、CEA及CA125均由肿瘤细胞增殖过程中产生,可直接反映肿瘤细胞变化[11]。由此可见,联合治疗可降低肿瘤标志物水平,抑制VEGF表达,减少新生血管生成,从而达到抑制肿瘤生长的效果。有研究证实,恶性肿瘤患者机体免疫功能存在明显异常[12]。本研究显示,治疗后两组T淋巴细胞水平无明显差异,表明联合治疗对机体免疫功能影响较小。
在内分泌疾病、免疫性疾病及恶性肿瘤等疾病中,细胞间黏附分子-1水平均可出现高表达状态,其还可存在于血清中,形成sICAM-1,而sICAM-1可阻碍白细胞识别靶细胞,降低机体免疫系统清除肿瘤细胞的能力,促进肿瘤细胞的生长与增殖,其水平在卵巢癌患者体内呈高表达[13]。P-selectin为跨膜糖蛋白,可介导肿瘤细胞与血管黏合,促进肿瘤细胞的转移、侵袭,还可使肿瘤细胞进入血液循环,增加肿瘤细胞扩散风险[14]。本研究首次选取P-selectin与sICAM-1作为观察指标,以探讨贝伐珠单抗联合奥拉帕利对肿瘤细胞的影响,结果显示,治疗后研究组sICAM-1、P-selectin水平下降幅度大于参照组,这表明联合治疗可显著降低sICAM-1、P-selectin水平,分析原因为,奥拉帕利为聚腺苷二磷酸核糖聚合酶抑制剂,可抑制肿瘤细胞活性,阻止其分裂、转移,抑制肿瘤发展[15]。本研究还显示,两组毒副反应发生率比较差异无统计学意义,提示联合治疗不会增加毒副反应。因此,联合治疗可抑制肿瘤细胞生长、分裂、增殖,控制肿瘤发展,且不增加毒副反应风险,有利于病情好转。
综上可知,奥拉帕利联合贝伐利珠单抗治疗卵巢癌患者疗效显著,可降低肿瘤标志物及VEGF水平,抑制肿瘤细胞的生长与转移,促进病情恢复,且对机体免疫功能影响较小。
