黄河口西南侧小岛河河口天然牡蛎礁的牡蛎种群结构
2024-05-06张贝叶王安东
左 涛,张贝叶,王 俊,左 明,王安东
1 中国水产科学研究院黄海水产研究所,青岛 266071 2 青岛市海洋科学与技术试点国家实验室,海洋生态与环境科学功能实验室,青岛 266237 3 上海海洋大学水产与生命学院,上海 201306 4 东营市海洋发展研究院,东营 257091 5 山东黄河三角洲国家级自然保护区管理委员会,东营 257091
牡蛎礁是生态系统服务价值最高、但又是全球退化最严重的海洋生境之一[1—2]。在中国大陆沿岸,牡蛎种类多、资源丰富,天然牡蛎礁曾广泛分布于温带和亚热带海区的潮间带和浅水潮下带[3—4],目前也面临着分布面积大幅缩小、斑块化现象明显及退化严重的局面[5—8]。
牡蛎礁修复是国际海洋生态修复的热点[9—10],也是我国海岸带生物栖息地保护和修复的重要内容之一[11],其旨在重建牡蛎自然种群、恢复和补充牡蛎资源,并获得可自我扩繁(self-sustaining)的野生牡蛎礁。建立可用于评估效果的生态参照基准(Baseline)是实施牡蛎礁修复的首要关键环节[9,12]。而掌握当前和历史的牡蛎种群数量、分布等生态学特征是确定该参照基准的基础[9],也是推进牡蛎礁生境保护、制定修复策略的关键[9—10]。目前,除了江苏海门[13—14]、河北曹妃甸-乐亭[15]、天津大神堂[5,16]、杭州湾北岸大金山岛[17]等少数区域外,我国仍缺乏对沿岸现有天然活牡蛎礁的系统性生态调查,牡蛎自然种群状况及动态变化记录不足,未能掌握天然礁体的详细分布、生存现状[18],这极其不利于牡蛎礁保护及修复工作的深入推进。
黄河口是中国北方最大的河口,其近岸海域曾存在十余处天然牡蛎礁[4],但自20世纪90年代以来河口周边的活体牡蛎礁明显退化或消失,对残存的牡蛎礁开展保护和修复迫在眉睫[8]。近年来,在黄河尾闾摆动区西南侧、小岛河河口的潮间带发现面积约为0.24 km2的活体牡蛎礁[19](当地称“牡蛎山”)。声呐调查显示该礁区边缘有渔网拖痕、受人工开采等被破坏痕迹[19]。另外,经实地调研也确认,当地渔民曾在此海域大量采捕野生牡蛎。以上表明该牡蛎礁已经面临人为破坏的威胁,亟需开展生境监测、保护和修复工作。目前,已有该牡蛎礁生境调查[20]和修复技术[19]等方面的研究报道,但牡蛎种群的相关研究工作有待进一步深入。
为此,本文开展了小岛河河口天然牡蛎礁的牡蛎种群生态调查,基于分子和传统形态分类技术鉴定了牡蛎的物种组成,测定其形态学表观参数,并分析了牡蛎种群年龄结构和生长特征,研究结果可望为评估该天然牡蛎礁的健康状况和生态服务潜力,以及研发相应的修复技术和制定保护策略等提供科学依据。
1 材料与方法
1.1 研究区域和样品采集
本研究的牡蛎礁(37.59 °N,119 °E)位于黄河口西南侧、小岛河河口的潮间带(图1),该区域的水深受不规则半日潮影响,平均潮差1.5—1.7 m,最大潮差3 m;在遇大风、退大潮时牡蛎礁会偶尔出露;沉积物以粉砂和黏土质粉砂为主,为典型的淤泥质潮滩。
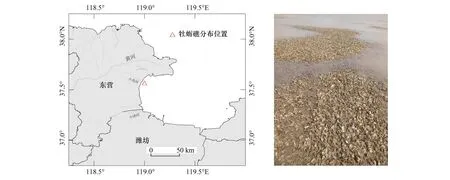
图1 牡蛎礁分布地理位置示意和出露实景Fig.1 Geographic location and exposed view of the oyster reef
2021年初冬(11月19日),赶低潮、牡蛎礁部分出露时进行了样品采集。采样过程参考《海洋调查规范 第6 部分:海洋生物调查》(GB/T 12763.6—2007)有关潮间带生物调查方法[21],沿垂直岸线方向设置了3个断面,每个断面采集了2个长50 cm×宽50 cm×深25 cm的样方位点,相邻样方位点间距约10—20 m,采集的牡蛎和泥样经封存后带回实验室处理、测定和分析。
1.2 样品处理和分析
在实验室分检和分离牡蛎,清洗晾干,计数牡蛎的数量、测定生物量(鲜重,精确至0.1 g);从每个样方采集的样品中随机选取不少于50个牡蛎,记录编号,观察外部形态,拍摄记录是否活体、壳内、外表面和闭壳肌痕颜色、是否有放射肋、鳞片等特征。此季采集的牡蛎均处于空胃和性腺萎缩状态,因而未进一步分析其肥满度和性腺发育期。
测量活体牡蛎的壳宽(SI)(精确至1 mm)和壳质量(去除软体部的壳体鲜重,精确至0.1 g)及左壳的壳高(SH)和壳长(SL)。SI为左右壳闭合时,垂直于两壳铰合面的最大壳体厚度;SH为单壳上从壳顶铰合部末端、经闭壳肌痕到生长边缘的最大长度;SL为单壳剖面上,与SH垂直的最大截面宽度。
牡蛎为连续生长的软体动物,其外壳剖面的生长层年轮可用于判断生长年龄[22—23],即选取无缺损且形状规整的左壳,沿壳最大生长轴(通过壳顶、韧带部、闭壳肌痕)径向截面切割,打磨和抛光处理剖面,切片,在体视显微镜下辨认和计数壳体切片上的灰色半透明生长层,结合壳体韧带槽表面生长层分布,确定牡蛎壳体的生长年龄(图2)。不足1龄的记为0+ a,介于1龄和2龄的记为1+ a,依次类推。

图2 3+龄的近江牡蛎韧带部切片及年生长层的示意图Fig.2 Photograph of a representative resilium radial cross section from a 3+ a Crassostrea ariakensis and the sketch showing the annual growth lines
参考文献[24],根据牡蛎外观特征进行初步分类,然后利用分子生物学方法,以COI为目标基因进行物种鉴定。参考文献[25—26]的方法,利用表1所列特异性引物扩增牡蛎闭壳肌的线粒体COI基因序列。在https://blast.ncbi.nlm.nih.gov/中借助基本局部比对搜索工具BLAST-N(Basic Local Alignment Search Tool)比对扩增的PCR产物序列结果,以进一步确定牡蛎的种类。
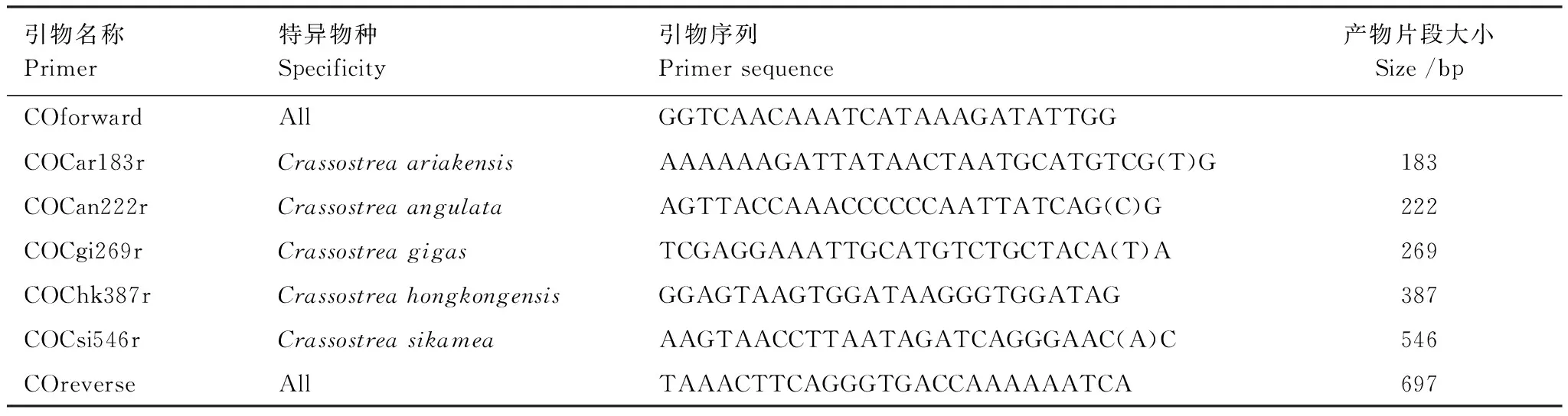
表1 牡蛎不同种特异性PCR引物和预期产物大小Table 1 Species-specific PCR primers and expected product size for oysters
1.3 数据处理
计算活体牡蛎的种群密度(个/m2)和生物量(kg/m2),以及SH/SL和SH/SI。SH、SL和SI是牡蛎壳体形状和生长空间趋向性的指标,其中,SH反映了垂向上的生长和延展,SL和SI反映了水平方向的生长和扩展。SH/SL比值接近1时,壳体呈盘状或圆形,>2则呈狭长形;SH/SI是壳体凹陷或深度的指数,该比值接近1表示壳体的深度或凹陷程度与其高度相同,为杯状或球形,>1则说明牡蛎的高度大于深度[22]。
采用对数回归直线方程分别拟合牡蛎的壳质量(y)与SH、SL和SI等形态参数(x)的关系式。计算公式为:
ln(y)=a+bln(x)
(1)
a为截距,b为斜率。牡蛎壳质量与SH关系式中b的取值范围一般在3—4之间,小于3则属于负异速增长[27]。
根据牡蛎的SH-年龄的分布拟合相应的von Bertalanffy生长方程[28],方程公式为:
SHt=SHmax[1-e-k(t-t0)]
(2)
SHt为t龄牡蛎的壳高,SHmax为渐近壳高,k为生长系数、t0为壳高近似为零时的初始年龄。将SHmax代入上面(1)式,计算得到渐近壳质量(asymptotic shell mass,Wmax)。利用(1)式中b和(2)式中k和t0计算壳质量增加的拐点年龄(ttp)和最大年龄tmax,公式为:
(3)
tmax=3/k
(4)
以上回归和拟合分析采用SPSS R27(IBM Corp.)计算得到。
2 结果
2.1 种类组成
BLAST比对结果显示,采集的牡蛎包括近江牡蛎(Crassostreaariakensis)与长牡蛎(C.gigas)两种,它们分别与包括其他地域的近江牡蛎与长牡蛎样本的相似度大于99.8%。
近江牡蛎壳体厚大,多呈卵圆形,少数呈长条形,壳色偏紫黑色或黄褐色,左壳有较平滑的同心鳞片、放射肋不明显,右壳较扁平、稍小于左壳,闭壳肌痕有白色与紫色(图3),以白色居多(占比95%);长牡蛎个体略小,呈圆形和长条形,壳色黄或金黄色,左右壳均有明显凹凸状,左壳具显著的放射肋,边缘钙质波褶坚硬明显,闭壳肌痕明显,有白色、紫色、黄色与混色(图3),紫色(占比49%)与黄色(占比39%)居多。

图3 黄河口西南侧小岛河河口天然牡蛎礁中的近江牡蛎和长牡蛎 Fig.3 Shell morphology of oysters Crassostrea ariakensis and C.gigas near the mouth of Xiaodaohe River, southwest of the Yellow River Estuary
2.2 密度和生物量
采集的样品中,活体牡蛎为主,死亡的牡蛎壳数仅占总壳体数的6.1%—6.7%。活体牡蛎密度介于1953—3976 个/m2,均值为(2811±778)个/m2;生物量介于2—82 kg/m2,均值为(21.97±1.37)kg/m2。其中,近江牡蛎密度介于847—2367 个/m2,均值为(1566±544)个/m2,占牡蛎总密度的55.7%,生物量介于1—70 kg/m2,均值为(16.78±26.69)kg/m2,占牡蛎总生物量的76.4%;长牡蛎密度介于801—2223 个/m2,均值为(1245±535)个/m2,生物量介于1.5—12 kg/m2,均值为(5.18±3.86)kg/m2。方差分析显示,密度和生物量在采样样方间及两种牡蛎间的差异均不显著(P>0.05)。
2.3 年龄组成
近江牡蛎个体年龄主要介于0+ a—4+ a,平均年龄为(0.25±1.02)a;长牡蛎个体年龄介于0+ a—2+ a,平均年龄为(0.15±0.50)a。另外,对死亡的壳体年龄分析显示,死亡壳体所处的年龄高于活体牡蛎平均年龄,其中死亡的近江牡蛎壳体平均年龄为(1.94±1.54)a、长牡蛎为(1.0±0.75)a。
图4显示,活体近江牡蛎密度随龄级增加而减少,0+ a的密度最高,占比>89%,其他龄级的密度占比<4%;总生物量以3+ a和0+ a占比较高,约为31%,其次为4+ a,占比为25%。与近江牡蛎相似,活体长牡蛎的密度随龄级增加而减少,亦以0+ a的个体最多,占比>84%,但总生物量仍以0+ a的较高,占比达51%。
2.4 形态参数—频数分布
活体近江牡蛎SH均值为(47.8±21.2)mm、SI为(12.5±6.5)mm、SL为(29.6±14.9)mm、壳质量为(10.98±30.43)g;活体长牡蛎SH均值为(37.9±15.4)mm、SI为(11.2±3.8)mm、SL为(18.8±6.0)mm、壳质量为(7.8±15.5)g。图5显示,两种牡蛎的形态参数的频数分布表现为单峰型,且都以SH介于30—40 mm和壳质量<5 g的0+ a个体居多。方差分析显示,除SI外,SH、SL和壳质量均值的种间差异都达显著水平(P<0.05)。
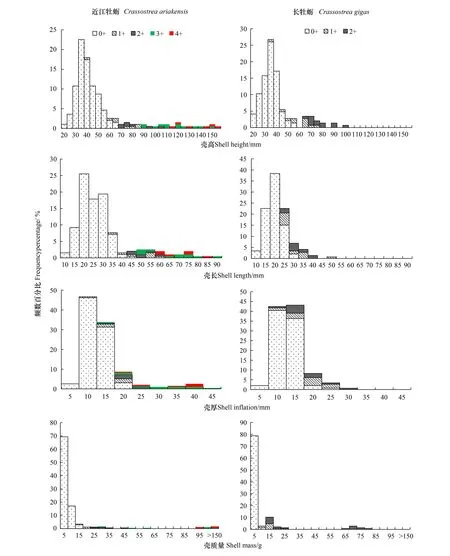
图5 各龄级的近江牡蛎和长牡蛎壳高SH、壳长SL和壳宽SI、壳质量-频数百分比分布Fig.5 Shell height (SH), length (SL) and inflation (SI), mass-frequency percentage distribution along the age for Crassostrea ariakensis and C.gigas
各龄级牡蛎的形态参数均值列于表2。据此可计算出,近江牡蛎的SH年增量均值约为24 mm/a,0+ a至3+ a期间的SH年增量较高(均值为34.0 g/a);壳质量快速增长期为2+ a—4+ a,其中3+ a至4+ a期间壳质量增量最高(>50 g/a)。长牡蛎的壳高年增量较稳定,约为21 mm/a;壳质量在0+ —1+ a低龄期的增量较高。相较而言,近江牡蛎的壳体形态参数均值都高于同龄组的长牡蛎相应值;除壳宽外,各参数在两种牡蛎间的差异达极显著水平(t-test,P<0.01)。
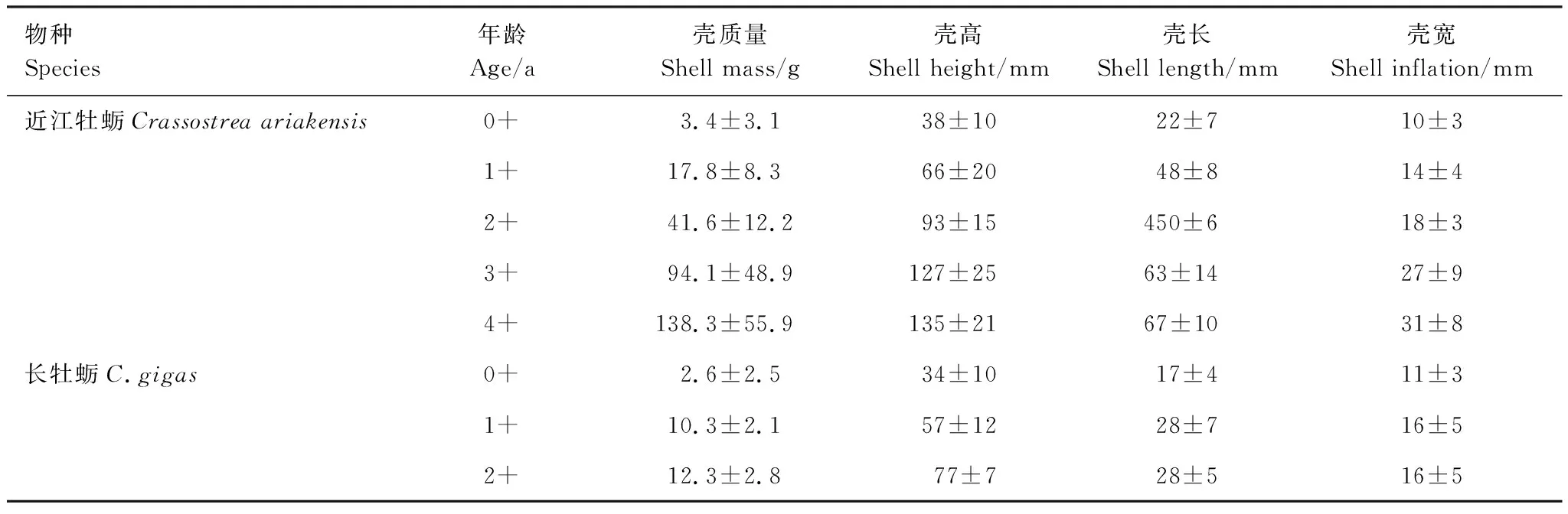
表2 分年龄组实测牡蛎形态参数均值Table 2 Average values of morphological parameters of oyster shells in age classes
近江牡蛎的SH/SL均值为1.78—1.79,小于长牡蛎SH/SL的1.92—2.04,其SH/SI均值较高,为4.01—4.07,而长牡蛎SH/SI均值为3.39—3.74。图6显示,近江牡蛎在低龄期(0+ a —1+ a)的SH/SI比值相对稳定,SH/SL降低,显示此期壳体偏好横向生长、表现更为扁平,1+ a—2+ a时,SH的增幅明显高于SI、SL,显示壳体处于向上延展期,2+ a —4+ a时SH/SI的比值减少、SH/SL的比值增加,显示壳体在垂向和水平向上都处于延展期,壳体偏向狭长厚杯状。与之不同,长牡蛎的SH/SI和SH/SL的比值随龄级增加而增加,表明长牡蛎壳体向上延展优势明显,其在1+ a—2+ a时的SH/SL比值较近江牡蛎高,显示其壳体较近江牡蛎更为扁平狭长。
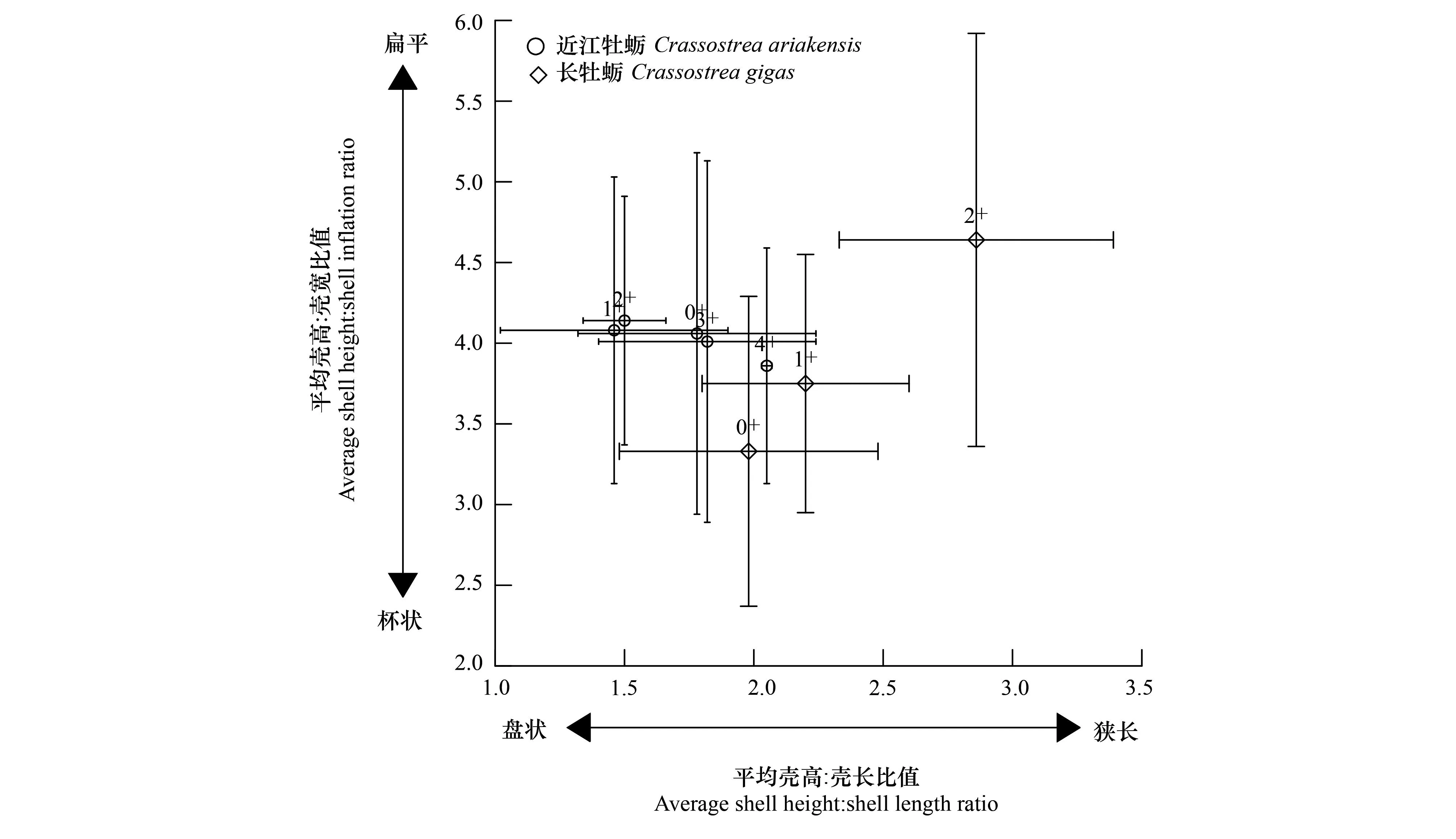
图6 各龄级的近江牡蛎和长牡蛎的壳高/壳宽比均值(和标准差)与壳高/壳长比均值(和标准差)的分布Fig.6 Average shell height:shell inflation ratios (with standard error) in relation to average shell height:shell length ratios (with standard error) along the age for Crassostrea ariakensis and C.gigas
2.5 生长方程
表3所示,两种牡蛎的壳质量与SH、SL及SI的回归关系式的斜率均<3,表明其生长都属于负异速增长。比较而言,近江牡蛎的回归关系式中斜率和截距都高于长牡蛎的相应值。协方差分析显示,两种牡蛎的壳高-壳质量回归关系式的斜率差异达极显著水平(P<0.001),壳长-壳质量和壳宽-壳质量回归关系式的截距差异达极显著水平(P<0.001)。

表3 近江牡蛎和长牡蛎的壳质量与形态参数的关系式Table 3 Results of the linear model fitted between log-transformed shell mass and morphological parameters for Crassostrea ariakensis and C.gigas
基于各龄级的壳高-年龄分布(表2),拟合两种牡蛎的von Bertalanffy生长方程曲线(图7和表4)得到,近江牡蛎渐近壳高为286 mm,最大年龄为20 a;长牡蛎的渐近壳高为173 mm,最大年龄为15.5 a。近江牡蛎的生长系数k值小于长牡蛎的相应值。协方差分析显示,两种牡蛎的生长曲线存在极显著差异(F=13.38,P<0.001)。
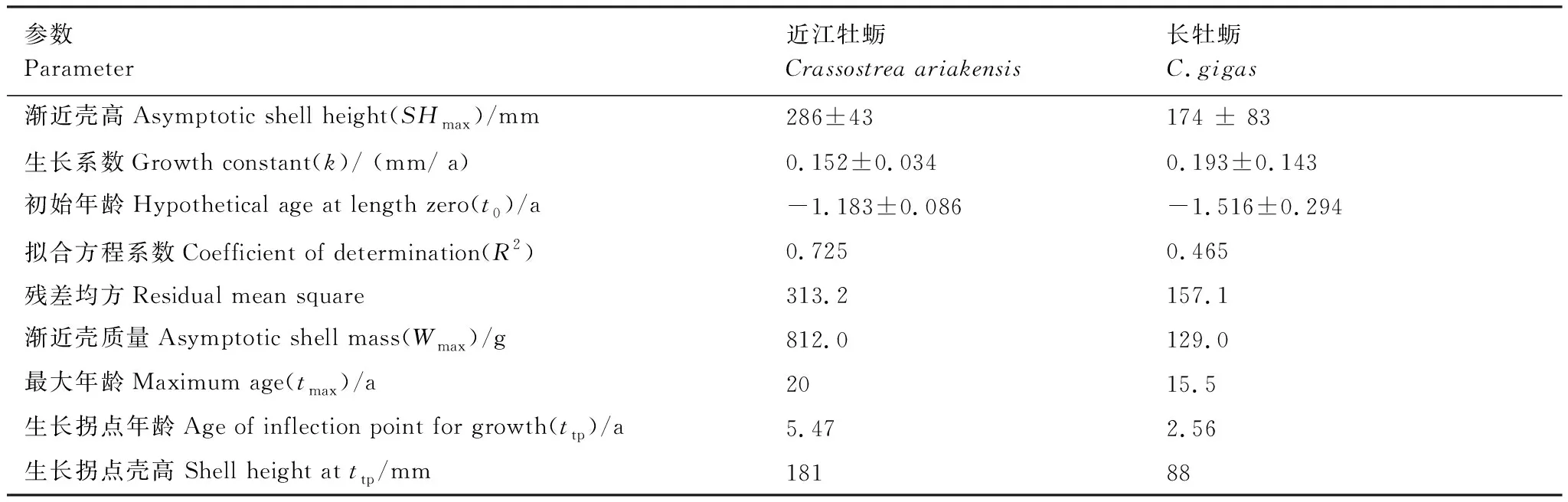
表4 近江牡蛎和长牡蛎生长特征参数Table 4 Growth parameters of oyster Crassostrea ariakensis and C.gigas
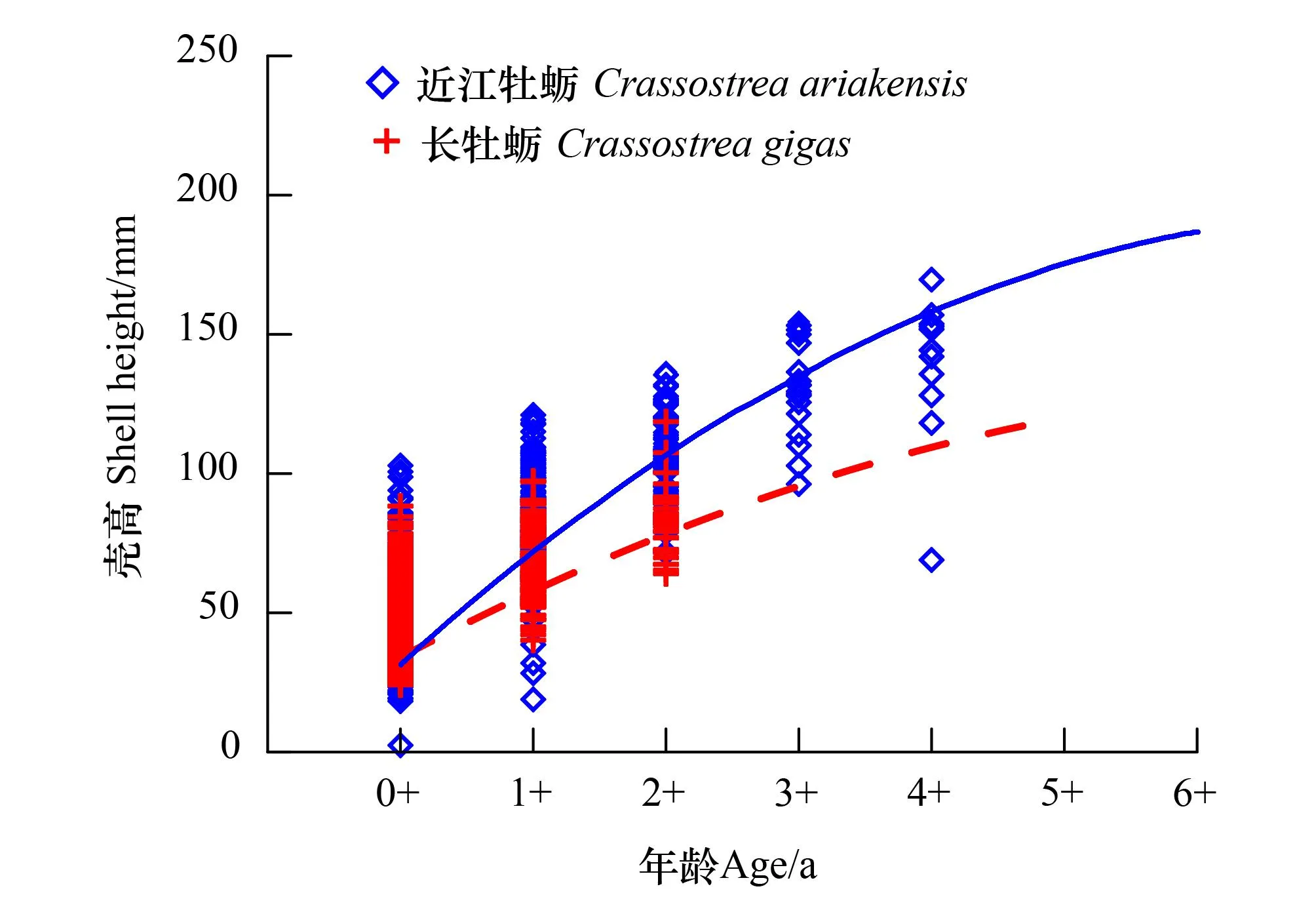
图7 近江牡蛎和长牡蛎的壳高-年龄的Von Bertalanffy生长曲线分布Fig.7 Fitted von Bertalanffy growth curves of shell height-age for Crassostrea ariakensis and C.gigas
3 讨论
3.1 种类组成
此前的调查认为该区域牡蛎礁的牡蛎构成种类只有近江牡蛎[19]。本研究结果显示,该牡蛎礁的牡蛎种类组成中,不仅包括近江牡蛎,还有长牡蛎。这两种牡蛎在黄河口邻近海域分布较广,是较为常见的造礁物种[3—4]。本研究还发现,采集的样品中,低龄期、小个体的近江牡蛎和长牡蛎形态分类特征不明显,可能无法依据波褶的有无、放射肋显著与否[24]来进行区分,而采集样中长牡蛎以低龄期为主,因此这可能是造成之前研究中未能识别出长牡蛎的原因。对低龄期的近江牡蛎和长牡蛎,闭肌痕颜色可能是一个较好的辅助判断依据,如图3所示,近江牡蛎的闭壳肌痕多为白色,而长牡蛎的闭壳肌痕颜色显著且多变,紫色和黄色居多,这两者之间的颜色差异与在渤海辽宁营口观察到的结果[29]相似。
3.2 密度和生物量
活体牡蛎的种群密度是评价礁体生态状况的基础指标[12,30]。本研究的牡蛎礁区域内活体牡蛎密度2811 个/m2和生物量21 kg/m2,远高于国内外大多数天然或人工修复牡蛎礁中的牡蛎平均密度值和生物量[13,17,31—33],与江苏海门蛎岈山[14]、河北唐山曹妃甸-乐亭[15]、长江口[34]、南卡罗来纳洲(South Carolina)沿海[35]等牡蛎礁的牡蛎高密值相当。此外,相较于海门蛎岈山的牡蛎死亡个体的高比值(23%)[13],本研究牡蛎礁上的死亡牡蛎壳体占比值仅约为6%。总体而言,本研究的牡蛎礁区域内牡蛎种群具有高密度、低死亡率的特点,表明该天然礁的牡蛎种群具有较好的活力和扩张潜力,这也为后续礁体的保护和修复提供了有利条件。
3.3 年龄结构和大小分布
近江牡蛎和长牡蛎作为常见的商业养殖和牡蛎礁生态修复的备选物种[10,34],掌握其在天然活牡蛎礁体上的自然种群年龄结构方面的资料有着重要的意义。有人认为,在无疾病、环境适宜、无人类干扰情况下,牡蛎的生长寿命可达10 a以上[36],近江牡蛎生长寿命最大可达20 a[37]。在天津大神堂的古老地层中发现的长重牡蛎(亦即长牡蛎),估测的年龄即高达20 a[38]。与之相近,本研究结果亦显示,小岛河河口天然牡蛎礁上的近江牡蛎和长牡蛎渐近最大年龄分别可达20 a、15.5 a(表4)。但在实际采集到的牡蛎中,占主体的却主要是低龄个体,其中近江牡蛎多小于4+ a,长牡蛎多小于2+ a,不仅远低于它们各自的最大年龄,甚至低于其各自的生长拐点年龄(5.47 a和2.56 a,表4)。与之形成对比的是,2004年在莱州湾小清河口采集的近江牡蛎和长牡蛎,其最大年龄分别可达到5 a和6 a[22]。此外,由图5和表4可知,本研究采集的两种牡蛎壳高和壳质量分布阈值明显低于其相应的渐近壳高值(近江牡蛎为286 mm,长牡蛎为173 mm),而早前在小岛河河口采集到的近江牡蛎的最大壳高可达293.2 mm[19]和325.82 mm[39],在渤海湾埋藏礁体中采集的长牡蛎(对种名尚有争议,有认为近江牡蛎)的壳高平均值为25 cm,研究者还认为在没有人类干扰的自然环境中牡蛎可从容地生长至数十厘米、甚至达50 cm[5]。以上分析都表明,相较其他区域和本区其他时期采集的同种牡蛎而言,本研究采集的牡蛎具有低龄、个体相对较小的特点,推测其原因可能与近年该天然牡蛎礁的生境特征及人为干扰有关,一方面,研究区域受河口陆地径流泥沙掩埋以及潮汐影响较大,较高龄级的牡蛎分布于较深层,容易被底泥掩埋而导致窒息死亡[40],这也可能是结果2.3中死亡壳体所处的年龄均值远高于活体牡蛎的相应值的原因;另一方面,根据实地走访了解到,2017—2018年期间曾有渔民承包礁区,大规模开采牡蛎,这也可能导致较高龄级的牡蛎缺失。
3.4 生长特征
近江牡蛎和长牡蛎在正常生长的过程中,多保持直立原地生长[5]。从表2和图7可以看出,两牡蛎的SH随龄级的增幅大、SH/SL与SH/SI的比值均>1,亦即表明两种牡蛎趋于向上生长的特点,这也与其对河口生境的适应性有关。实地调研发现,礁区受黄河入海泥沙影响严重,生境属于泥质潮间带,底质是以较为松软的粘土和粉砂为主。而泥质沉积物的快速堆积,会迫使牡蛎个体将并不充裕的造壳物质主要用于垂向上的SH生长,以免被泥沙堆积掩埋窒息而死[38,40]。此外,本研究还发现两种牡蛎的形态表观存在差异,这可能与生长过程中壳体参数的相对变化有关。如图6所示,长牡蛎偏好垂向生长因而呈狭长形,近江牡蛎的壳体在低龄级偏好横向生长、在较高龄级则呈多维(垂向和水平向)扩张态势,因而更显厚、圆。而且,两种牡蛎的壳高生长曲线分布(图7)差异显著,近江牡蛎的SHmax和tmax都高于长牡蛎相应值(表4),且同龄级的近江牡蛎的SH和壳质量明显高于长牡蛎(表3)。根据上述结果推测,小岛河河口天然牡蛎礁上近江牡蛎的壳体扩张和生长潜力应优于长牡蛎,这亦是造成该牡蛎礁上两种牡蛎虽然种群密度接近,但近江牡蛎生物量远高于长牡蛎的原因,特别是2+以上的近江牡蛎。现场调查还发现,近江牡蛎埋栖深(12—20 cm),而长牡蛎多分布于表层或附着在近江牡蛎外壳上生长。据上结果认为,在小岛河河口外天然牡蛎礁体形成和发育中,近江牡蛎可能较长牡蛎更为重要。
4 结论与展望
本研究通过种群生态调查发现,黄河口西南侧小岛河河口的天然牡蛎礁上不仅有近江牡蛎,而且还有长牡蛎,礁体上牡蛎资源较为丰富;牡蛎种群具有高密度、低龄和低死亡率等特点;比较而言,2+龄以上的近江牡蛎对礁体形成可能更为重要。综合该牡蛎礁曾被大规模的商业采捕的实地调研结果,推测该天然牡蛎礁可能处于开发后的恢复期。建议进一步开展有效的长期连续监测和更多基础性研究工作,以查明礁体的形成、发育状况以及牡蛎资源补充与生境要素间的关系等问题,更为深入推进该牡蛎礁的保护和修复。根据计算的牡蛎种群生长拐点年龄,建议监测和修复计划周期应至少为3年及以上。
