氨苄西林胶囊质量分析
2024-05-03李一兰王丹付晓丽刘旭春张玲变周晓溪
李一兰?王丹?付晓丽?刘旭春?张玲变?周晓溪

摘要: 目的 評价目前国产氨苄西林胶囊的质量现状及存在问题。方法 按国家药品抽检计划总体要求,采用法定检验方法结合探索性研究对氨苄西林胶囊样品进行检验,通过对杂质谱、溶出度、溶出曲线、原料药对制剂质量的影响和包装材料对制剂质量的影响等项目的考察,分析本品的质量状况。结果 按法定标准检验103批次样品,合格率100%,与2016年氨苄西林胶囊国抽结果比较,产品质量总体持续稳定。探索性研究对各杂质的来源与结构进行了确证;溶出度测定方法采用HPLC法检测结果与标准检验排除胶囊壳干扰后结果无明显差异;不同企业样品的溶出曲线存在较大差异;原料药的质量影响制剂质量;不同包装氨苄西林胶囊在相同的放置条件下杂质变化差异较大。结论 氨苄西林胶囊质量总体较好,现行质量标准需进一步完善,建议修订溶出度测定方法为HPLC法以消除胶囊壳的干扰;建议企业开展仿制药质量和疗效一致性评价,选用质量更好的原料药,选用防潮效果更好的铝塑铝包装,或者在铝塑泡罩外加防潮袋。
关键词:氨苄西林;质量分析;溶出曲线;胶囊
中图分类号:R978.1文献标志码:A
Quality assessment of ampicillin capsules
Abstract Objective This study evaluated the current quality status and existing problems with domestic ampicillin capsules. Methods According to the overall requirements of the national drug sampling plan, the sample of ampicillin capsules was tested using statutory methods combined with exploratory research. The quality status of this product was analyzed by examining impurity profiles, dissolution, dissolution curve, the impact of raw materials on the quality of the products and the impact of packaging materials on the quality of the preparation. Results A total of 103 batches of samples were tested according to the specifications, and all of them complied with regulations. Compared with the results obtained in 2016, the product quality of ampicillin capsules was generally stable. Exploratory research had confirmed the sources and structures of various impurities in the products. There was no significant difference between the results of the HPLC test and those of the standard test after excluding the interference of the capsule shell. The dissolution curves of samples from different manufacturers were significantly different. The quality of the raw materials affected the quality of the products. The impurity changes of ampicillin capsules with different packages varied significantly under the same storage conditions. Conclusion The quality of ampicillin capsules was generally good, and the current specifications needed to be further improved. It was recommended to revise the dissolution determination method to the HPLC method to eliminate the interference from the capsule shell. It was also recommended that enterprises carry out a consistent evaluation of the quality and efficacy of generic drugs, choose better-quality raw materials, choose aluminum foil-plastic-aluminum foil packaging with a better moisture-proof effect, or add a moisture-proof bag to the aluminum-plastic blister.
Key words Ampicillin; Quality evaluation; Dissolution curve; Capsules
氨苄西林,曾用名氨苄青霉素,为广谱半合成青霉素类抗生素[1-2],由英国Beecham研究所于1961年合成。氨苄西林胶囊为口服制剂,活性成分为氨苄西林三水合物,主要用于治疗敏感细菌所致的呼吸道、泌尿道、消化道和耳鼻喉等各种感染性疾病[3-5],不良反应主要为过敏反应。国内1965年由上海医药工业研究院研制成功。
氨苄西林胶囊执行标准为国家食品药品监督管理局国家药品标准WS-10001-(HD-0981)-2002-2012[6],其在英國药典2023年版及美国药典45版中均被收载,但日本药局方第17改正版未收载该制剂。2016年曾对氨苄西林胶囊进行过国家药品抽检,研究表明国产氨苄西林胶囊的总体质量情况良好。本文结合标准检验和探索性研究检验结果,对国内市场上氨苄西林胶囊的关键质量属性进行比较分析,并对2016和2022年的抽检结果进行纵向比较,对产品存在的主要质量问题进行探讨,从而对完善现行质量标准提出合理建议,为进一步提高产品质量提供方向。
1 仪器与试药
1.1 仪器
Ultimate 3000高效液相色谱仪(美国赛默飞公司); AL-240电子天平(瑞士Mettler Toledo公司); CPA225D电子天平(德国Sartorius公司);V30水分滴定仪(瑞士Mettler Toledo公司);SOTAX AT自动溶出仪(瑞士Sotax公司);U3000/QE液质联用仪(美国Thermo Scientific公司)。
1.2 试药
氨苄西林对照品(批号130410-201908,含量:85.6%);头孢拉定对照品(批号130427-201708,含量:头孢拉定88.4%;头孢氨苄0.81%);氨苄西林系统适用性对照品(批号130618-201202)均购自中国食品药品检定研究院。水为超纯水,乙腈为色谱纯,其他试剂均为分析纯。
1.3 样品
氨苄西林胶囊为2022年国家药品抽检样品,共103批,其中抽自生产企业26批,经营单位86批,使用单位1批,涉及国内25家生产企业。
2 试验方法
2.1 法定标准检验
102批次按国家药品标准WS-10001-(HD-0981)-2002-2012检验,1批次按进口药品注册标准JX20140306检验[7]。主要项目包括溶出度、有关物质、含量测定等。
2.2 探索性研究
根据法定检验结果,结合文献报道[8-9]以及品种特点、企业调研等情况,对本品的杂质谱、溶出度、溶出曲线、原料药对制剂质量的影响、不同包装材料对样品质量的影响等项目进行研究。
2.2.1 杂质谱研究
(1)按WS-10001-(HD-0981)-2002-2012标准有关物质方法测定样品。
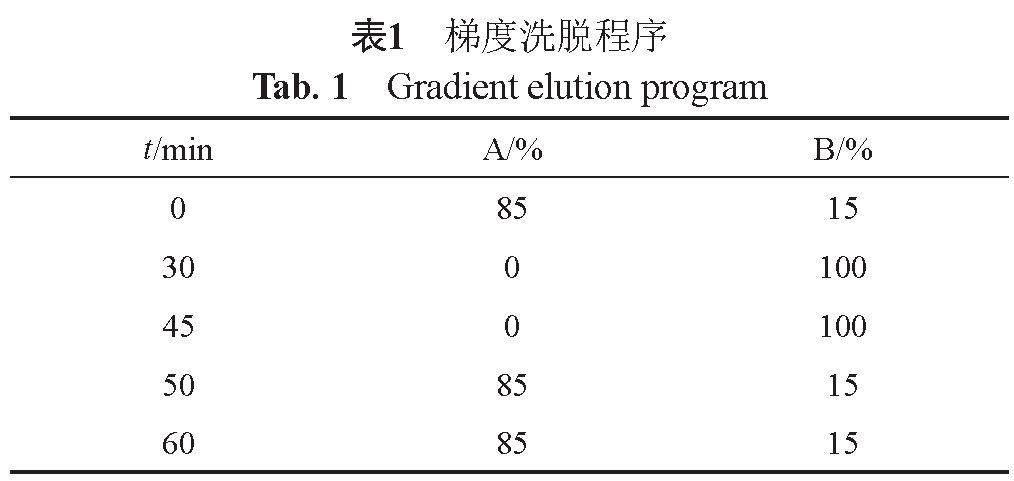
(2)杂质的确证:将单个杂质分离后通过LC-MS测定,色谱条件:色谱柱MGⅡ(5 μm ,3.0 mm ×150 mm);以冰醋酸溶液-乙腈-1 mmol/L乙酸铵溶液(0.3:50:950, V/V/V)为流动相A,冰醋酸溶液-乙腈-1 mmol/L乙酸铵溶液(0.3:400:600, V/V/V)为流动相B;按表1进行梯度洗脱;流速: 0.3 mL/min;柱温: 30 ℃;波长254 nm。利用质谱对杂质峰进行一级和二级扫描分析。
2.2.2 溶出度测定
氨苄西林胶囊溶出度按WS-10001-(HD-0981)-2002-2012标准,溶出方法不变,检测方法改为HPLC法,照含量测定项下方法测定。选取标准检验中存在胶囊壳干扰的12批样品进行测定,与标准检验结果进行比较。
2.2.3 溶出曲线分析
因未能采购到参比制剂(DAVA Pharmaceuticals INC),且国内目前没有通过仿制药一致性评价的氨苄西林胶囊,故选取市场份额较大的Z企业氨苄西林胶囊作为参比制剂。选取大于6批次的6家企业(含Z企业)0.25 g规格的样品,参照日本橙皮书氨苄西林胶囊的溶出曲线测定方法,采用篮法,分别以水、pH3.0柠檬酸-磷酸氢二钠缓冲液、pH4.0柠檬酸-磷酸氢二钠缓冲液和pH6.8磷酸盐缓冲液900 mL为溶出介质,转速为50 r/min,依法操作,分别于5、10、15、30、45、60、90、120和180 min时取样,HPLC法测定,绘制溶出曲线。
2.2.4 原料药对制剂质量的影响
选取同一家制剂企业使用不同原料生产的样品各1批,置于温度40 ℃、相对湿度75%的条件下,分别放置20、40和60 d,与0 d的样品进行比较,分析其杂质的变化情况。
2.2.5 不同包装材料对样品质量的影响
选取企业1和企业2各2批不同包装的氨苄西林胶囊以及其他企业不同包装的样品共9批次,置于温度
40 ℃、相对湿度75%的条件下,分别放置20、40和
60 d,与0 d的样品进行比较,分析其杂质的变化情况。
3 结果与讨论
3.1 法定检验结果
按现行标准检验,103批次样品均符合规定,合格率为100%。溶出度、有关物质,含量测定等主要检查项目与产品质量密切相关,对其结果进行进一步统计分析。
(1)有关物质 103批次样品按法定标准检验,合格率100%。其中单个杂质为0.11%~0.64%,均未超过标准规定的限度1.0%;总杂质为0.56%~2.87%,均未超过标准规定的限度3.0%。
(2)溶出度 103批次样品的溶出度值在72%~109%之间,平均溶出度为96.9%。同一企业样品的溶出度批内(6粒)的RSD值在0.9%~13.2%之间,表明部分样品溶出均一性较差。部分企业批次间差异较大,提示这些企业的生产工艺稳定性和控制水平有待提高。标准检验中还发现部分企业使用的胶囊壳对溶出度测定结果存在干扰,结果偏高。
(3)含量测定 103批次样品的含量在93.0%~102.9%之间,平均含量为97.7%。呈正态分布,对不同企业样品的含量测定结果进行单因素方差分析,组间P<0.05,表明各企业投料差异较大。
(4)质量纵向比较 按法定标准检验,氨苄西林胶囊2016及2022年的合格率均为100%,质量状况良好,比较稳定。其中,2016年样品溶出度多数集中在95%~112%之间,平均溶出度为106%,检验中发现部分厂家使用的胶囊壳对溶出度测定存在一定干扰,导致测定结果偏高[3];2022年检验中仍发现胶囊壳干扰问题,扣除胶囊壳干扰后,样品溶出度在72%~109%之间,平均溶出度为96.9%。2016年样品含量在90.8%~105.7%范围内,平均值为96.5%[3];2022年样品含量在93.0%~102.9%范围内,平均值为97.7%。法定标准检验说明该品种含量控制水平2022年较2016年略有提升,部分企业溶出度的控制水平还有待提高。
3.2 探索性研究结果
3.2.1 杂质谱分析
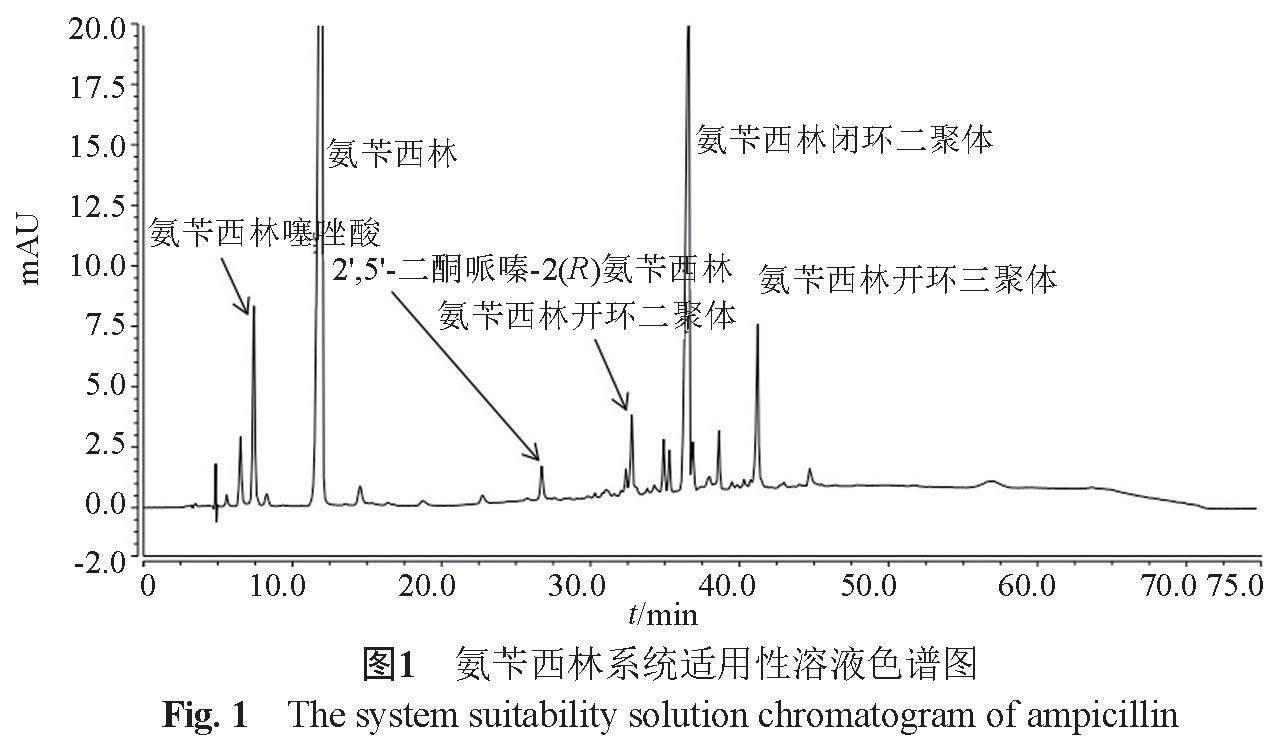
氨苄西林系统适用性溶液图谱见图1。氨苄西林胶囊共检出22个杂质,各杂质峰与主峰分离良好,典型色谱图见图2。利用氨苄西林系统适用性对照品确证了其中的5个杂质;通过LC-MS,结合氨苄西林合成路线、β-内酰胺类质谱裂解规律[10-12],推测了4个杂质结构,杂质名称见表2。103批次样品中除1批样品为氨苄西林轻粉与辅料混合制粒外,其余102批次样品均为氨苄西林重粉与辅料直接混合填充,未经过制粒或干燥等,工艺过程对杂质影响较小。与2016年氨苄西林胶囊国抽有关物质探索研究相比,样品检出的杂质总数相差不大,主要已知杂质基本一致,为氨苄西林噻唑酸,2,5-二酮哌嗪-(2R)氨苄西林、氨苄西林闭环二聚体,大部分企业最大杂质为氨苄西林闭环二聚体。2016年部分样品氨苄西林噻唑酸含量超过0.5%,2022年103批次样品氨苄西林噻唑酸及氨苄西林噻唑酸异构体总量均低于0.4%,表明氨苄西林结晶工艺总体有所提高。
3.2.2 溶出度测定
标准检验采用UV法测定,部分企业胶囊壳干扰测定结果,使结果偏高。HPLC法测定结果和标准检验扣除胶囊壳影响后结果无明显差异(表3)。表明采用HPLC法可以消除胶囊壳的干扰,而且检验更加高效便捷。
3.2.3 溶出曲线研究
口服固体制剂的溶出特征是其重要的质量属性。6家企业样品在水、pH3.0柠檬酸-磷酸氢二钠缓冲液、pH4.0柠檬酸-磷酸氢二钠缓冲液和pH6.8磷酸盐缓冲液4种介质中的溶出曲线见图3。
采用f2因子评价法,比较6家企业的溶出曲线(表4)。5家企业样品溶出曲线与企业6(参比制剂)相比,仅在部分介质中相似,在pH6.8磷酸盐缓冲液中均不相似,说明不同的处方和生产工艺对产品的溶出行为有较大影响,提示不同企业样品存在体内生物不等效的可能性。与2016年氨苄西林胶囊国抽溶出特性研究所得出的 “不同生产厂家的氨苄西林胶囊之间溶出行为有显著差异,说明不同的处方和生产工艺对产品的溶出行为影响较大”结果一致。目前国内尚未有氨苄西林胶囊通过仿制药质量和疗效一致性评价,建议企业参照原研药品积极优化处方工艺,严格工艺控制过程,尽早开展一致性评价工作。
3.2.4 原料药对制剂质量的影响
(1)对比原料药与制剂杂质检测情况发现,原料药中有16个杂质,未检出制剂样品中的4、7、11、14、20和22号杂质,但杂质总体分布情况与制剂相似,原料药质量影响着制剂的质量。该结果与2016年氨苄西林胶囊国抽有关物质探索研究结果一致。
(2)在加速试验中,两种原料来源的样品,氨苄西林闭环二聚体均减小,18号杂质(氨苄西林闭环二聚体异构体)均增大,总杂质均增大,推测是在加速试验过程中氨苄西林闭环二聚体转变成18号杂质;使用原料1的样品,18号杂质和总杂质增幅较使用原料2的样品大(图4)。说明原料药质量影响制剂质量。
3.2.5 不同包装材料对样品质量的影响
在温度40 ℃,相对湿度75%条件下,按有关物质方法测定样品中杂质。企业1铝塑泡罩加防潮袋包装的样品杂质变化幅度比塑料瓶包装的小;企业2铝塑铝包装的样品杂质变化幅度比铝塑泡罩包装的小。比较不同企业的样品,铝塑铝包装的样品杂质变化幅度比铝塑泡罩小(图5~6)。因此,建议企业选用防潮效果更好的铝塑铝包装,或者在铝塑泡罩外再加防潮袋以阻隔环境中水分对样品的影响。
4 小结
本次抽检结果显示,氨苄西林胶囊总体质量较好,产品合格率100%。与2016年氨苄西林胶囊国抽结果比较,其各项指标变化不大,提示产品质量总体持续稳定。
实验中发现,氨苄西林胶囊标准WS-10001-(HD-0981)-2002-2012溶出度测定采用UV法,存在胶囊壳干扰的情况,建议修订为HPLC法测定;不同企业样品的溶出曲线存在较大差异,建议企业参照原研药物优化处方工艺,尽早开展仿制药质量和疗效一致性评价工作;原料药的质量影响制剂质量,建议企业选用高质量的原料药;不同包装材料氨苄西林胶囊在相同的放置条件下杂质变化差异较大,说明包装材料的优劣对本品质量存在一定的影响,建议企业选用防潮效果更好的铝塑铝包装,或者在铝塑泡罩外再加防潮袋以阻隔环境中水分对样品的影响。
参 考 文 献
薛咏兰, 滕鈺, 黄婕, 等. 水分对氨苄西林胶囊稳定性的影响[J]. 中国抗生素杂志, 2018, 43(3): 303-306.
李香荷, 王强, 张轶华, 等. 国产氨苄西林丙磺舒胶囊的质量评价[J]. 中国抗生素杂志, 2021, 46(1): 53-61.
黄婕, 滕钰, 徐洪, 等. 国产氨苄西林胶囊质量评价[J]. 中国抗生素杂志, 2018, 43(3): 296-301.
国家药典委员会. 中华人民共和国药典临床用药须知: 化学药和生物制品卷[S]. (2010年版). 北京: 中国医药科技出版社, 2011: 632-633.
岑海燕, 吴建国, 陈燕, 等. 老年性尿路感染的流行病学及诊治现状[J]. 国外医药(抗生素分册), 2023, 44(6): 379-382.
国家食品药品监督管理局. 国家食品药品监督管理局国家标准[S]. 2012: WS-10001-(HD-0981)-2002-2012.
国家食品药品监督管理总局. 国家食品药品监督管理总局进口药品注册标准[S]. 2014: JX20140306.
胡昌勤. 对抗生素药品评价性抽验基本思路与方法的思考[J]. 中国抗生素杂志, 2013, 38(1): 1-11.
胡昌勤. 国内抗生素药品的质量现状[J]. 中国抗生素杂志, 2018, 43(3): 255-261.
李桃. 液质联用技术在药物降解产物及杂质分析中的应用[D]. 石家庄: 河北医科大学, 2014.
宁志强, 李猛, 张宏森, 等. 氨苄西林质谱解析及离子化方式研究[J]. 化学与粘合, 2013, 35(5): 34-35.
李玮, 张伟清, 李翔, 等. 阿莫西林、氨苄西林混合降解杂质对照品的研究与应用[J]. 药学学报, 2014, 49(9): 1310-1314.
