基于SSR标记的黄骅古贝壳堤濒危酸枣独特性分析
2024-04-30尚国丽刘颖刘孟军王玖瑞
尚国丽 刘颖 刘孟军 王玖瑞

摘 要:【目的】黃骅古贝壳堤自然保护区酸枣种质可作为筛选枣抗盐碱砧木的重要资源,但已处于濒危状态。对这些酸枣种质的挖掘研究,可为其合理利用、保护提供参考依据。【方法】本研究以黄骅古贝壳堤36个酸枣类型和来自8个省份的枣属57个种质为试材,采用SSR分子标记,通过遗传多样性和亲缘关系分析,揭示贝壳堤酸枣的特殊性。【结果】20对SSR引物从93份材料共获得138个等位基因,平均每个位点6.9个等位基因。聚类分析将93份材料可分为9类,I类包含了黄骅古贝壳堤酸枣全部36个基因型,多样性值分别为Na=5.40, Ne=3.18, I=1.30。通过群体结构分析得到的9个亚种群与聚类结果相对应。在Q≥0.6、Q≥0.8和Q≥0.9时,黄骅古贝壳堤酸枣种群的基因型数分别占97.4%、92.1%和86.8%。黄骅古贝壳堤酸枣虽然表现出遗传多样性, 但它与其他居群遗传成分交流较少。【结论】黄骅古贝壳堤的野生濒危酸枣种质资源独特,应加强保护和评价利用。
关键词:黄骅古贝壳堤;酸枣;遗传多样性;群体结构
文章编号:2096-8108(2024)01-0042-08 中图分类号:S665.1中图分类号 文献标识码:A文献标志码
SSR Markers Reveal the Specialty of Endangered Sour Jujube at Huanghua Ancient Chenier
SHANG Guoli1,LIU Ying1,LIU Mengjun2,WANG Jiurui1*
(1.College of Forestry, Hebei Agricultural University, Baoding Hebei 071001, China;
2.Research Center of Chinese Jujube, Hebei Agricultural University, Baoding Hebei 071001, China)
Abstract:【Objective】Sour jujube germplasms at Huanghua ancient Chenier, a provincial nature reserve, are potential resources for Chinese jujube rootstock with resistance to saline-alkali, yet the germplasms are endangered. The research on these germplasms can provide references for its rational utilization and protection.【Methods】Thirty-six sour jujubes collected from Huanghua ancient chenier and 57 jujube accessions from 8 provinces were used as materials to analyze the genetic diversity and relationship by SSR molecular marker technique, in order to reveal the specialty of sour jujube germplasm resources at Huanghua ancient chenier. 【Results】The results showed that a total of 138 alleles with an average of 6.9 alleles per locus were obtained by 20 SSR primer pairs. The accessions were divided into nine main groups and cluster I contained all 36 sour jujube genotypes from Huanghua ancient chenier with diversity values (Na=5.40, Ne=3.18, I=1.30). Nine subpopulations obtained by analysis of population structure corresponded to the cluster results. The number of genotypes accounted for 97.4%, 92.1% and 86.8% of Huanghua ancient chenier population at Q ≥ 0.6, Q ≥ 0.8 and Q ≥ 0.9, respectively. The sour jujube population of Huanghua ancient chenier showed genetic diversity, yet the exchange of genetic components between Huanghua ancient chenier population and other populations was relatively low. 【Conclusion】The wild and endangered sour jujube germplasms at Huanghua ancient chenier are distinctive resources and should be further conserved, evaluated and utilized.
Keywords:Huanghua ancient chenier; sour jujube; genetic diversity; population structure
酸枣(Ziziphus acidojujuba C. Y. Cheng et M. J. Liu)属鼠李科枣属植物,原产于中国,是中国栽培枣(Ziziphus jujuba Mill.)的祖先[1-2]。酸枣通常是灌木,稀为小乔木,广泛分布于中国北方,是最受欢迎的野生水果和重要药用植物之一[3-4]。其果实具有独特的酸味,维生素C含量极高,具有重要的药用和营养价值[5-6]。酸枣具有抗寒、抗旱、耐涝、耐盐碱化、耐瘠薄等特点,常被用作山地造林的先锋植物和栽培枣树的优良砧木[7-8]。近年来,由于保护意识的缺乏和对酸枣种子的过度采收,造成了酸枣种质资源的部分流失。黄骅古贝壳堤是1998年经中国河北省人民政府批准设立的省级自然保护区,位于渤海湾西岸,其开发规模、时间跨度和地质信息在世界上都是罕见的[9-11]。酸枣是黄骅古贝壳堤中最具优势的乔木植物,有着不可替代的防风固沙作用。黄骅古贝壳堤沿线的野生酸枣资源具有一定的抗盐碱、抗寒、抗旱能力,然而它们的应用、开发和保护还不够。黄骅古贝壳堤的酸枣作为野生资源,很少受到人们的重视,由于部分酸枣种植区已转为耕地,原有的种质资源规模已遭受大量破坏。
不同类型的分子标记可用于品种鉴定、多样性分析和系统发生研究等,如RAPD[12-13]、AFLP[14]、SRAP[15]和简单重复序列(SSR或微卫星)[7,16-17]。其中SSR分子标记具有多态性高、可重复性好、孟德尔遗传和共显性等优点,通常在亲缘种之间具有良好的保守性[18-19]。此外,它的PCR反应程序相对简单,可应用低质量的DNA[20]。因此,SSR分子标记是研究酸枣资源的有效工具[21-22]。本研究利用SSR分子标记对收集到的黄骅古贝壳堤酸枣及其他种质资源进行遗传多样性和亲缘关系分析,探讨黄骅古贝壳堤濒危酸枣种质资源的独特性。
1 材料与方法
1.1 材料
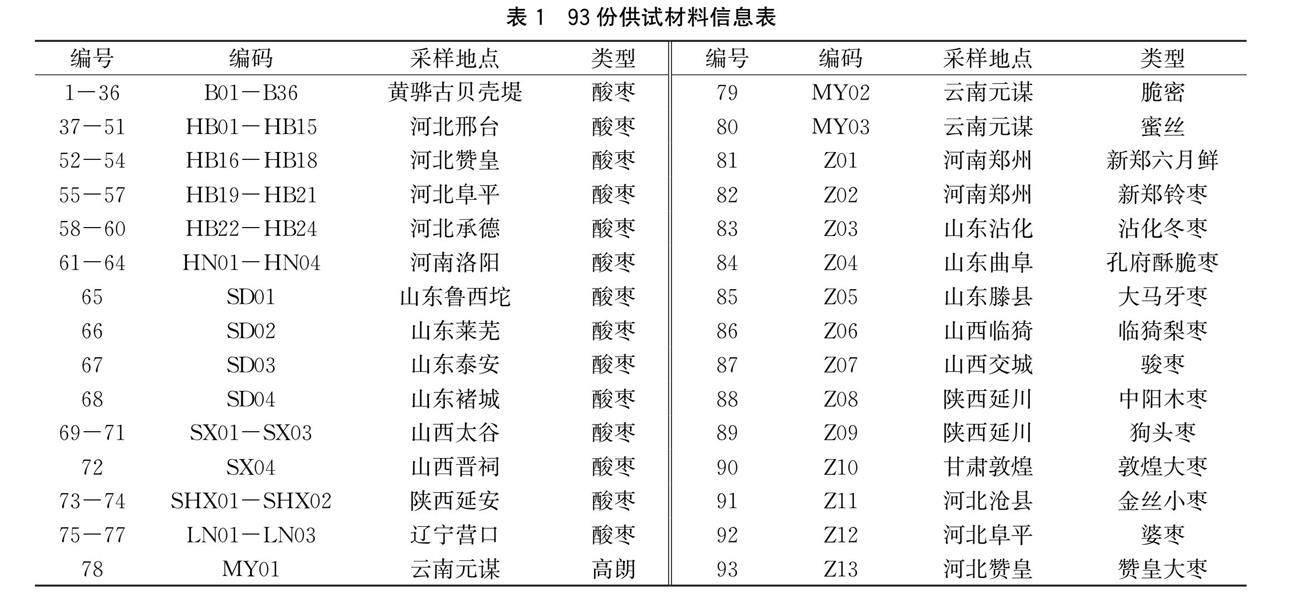
在河北省黄骅古贝壳堤,选取有代表性的酸枣样树36株,采集叶片样品。用保鲜袋封存后置于冰盒带回河北农业大学中国枣研究中心分子实验室,置于-20℃冰箱中保存,用于DNA提取。同時收集了41份来自6个省份的酸枣类型、13个主栽枣品种和3个毛叶枣(见表1)。
1.2 基因组DNA提取和SSR分析
采用CTAB法从嫩叶中提取基因组DNA。1.0%的琼脂糖凝胶电泳检测DNA质量,同时,在Nanodrop2000超微量核酸仪上进行DNA质量和浓度的检测。本试验采用肖京[23]设计的20对SSR引物(见表2)。聚合酶链反应(PCR)扩增采用12.5 μL的反应体系,其中0.5 μL 50 ng/μL基因组DNA模板,6.25 μL 2×Taq Master Mix (Tiangen),正向和反向引物各0.5 μL,用ddH2O补足体积。扩增程序为94 ℃预变性3 min,然后在94 ℃下变性30 s, 50~60℃退火反应30 s, 72 ℃延伸30 s,共28个循环,最后在72 ℃下延伸10 min,4 ℃保存。点3 μL PCR产物于8%变性聚丙烯酰胺凝胶上,置于1倍TBE缓冲液中,恒压200 V电泳50 min,银染显色后拍照记录。
1.3 遗传多样性分析
将原始0,1数据转换成AB数据,利用POPGENE 32软件分析遗传多样性,包括等位基因数目(Na)、有效等位基因数(Ne)、Shonnons信息指数(I)、观察杂合度(Ho)、期望杂合度(He)、近交系数(Fis, Fit, Fst)、Neis多样性指数(H)、Neis遗传距离(D)、遗传一致度(I)等的计算。
原始数据经NTSYS-2.10软件处理,Qualitative data程序计算相似系数(GS),获得相似系数矩阵后,用SAHN程序中UPGMA(非加权配对算术)方法进行聚类分析,并通过Tree Plot模块生成聚类图绘制UPGMA亲缘关系树状图,分析遗传距离和种质关系。
1.4 群体结构分析
利用Structure 2.3.4软件[24]分析居群结构,用混合模型(Admixture Model)和等位变异发生频率相关模型(Allele Frequencies Correlated)进行群体遗传结构分析,其中贝叶斯聚类过程中的两个基本参数Length of burnin period和Number of MCMC Reps after Burnin分别设置为10 000和100 000,K值设置为1~15,运行40次。根据Evanno[25]运算ΔK,最优K值为第一个ΔK峰值。
2 结果与分析
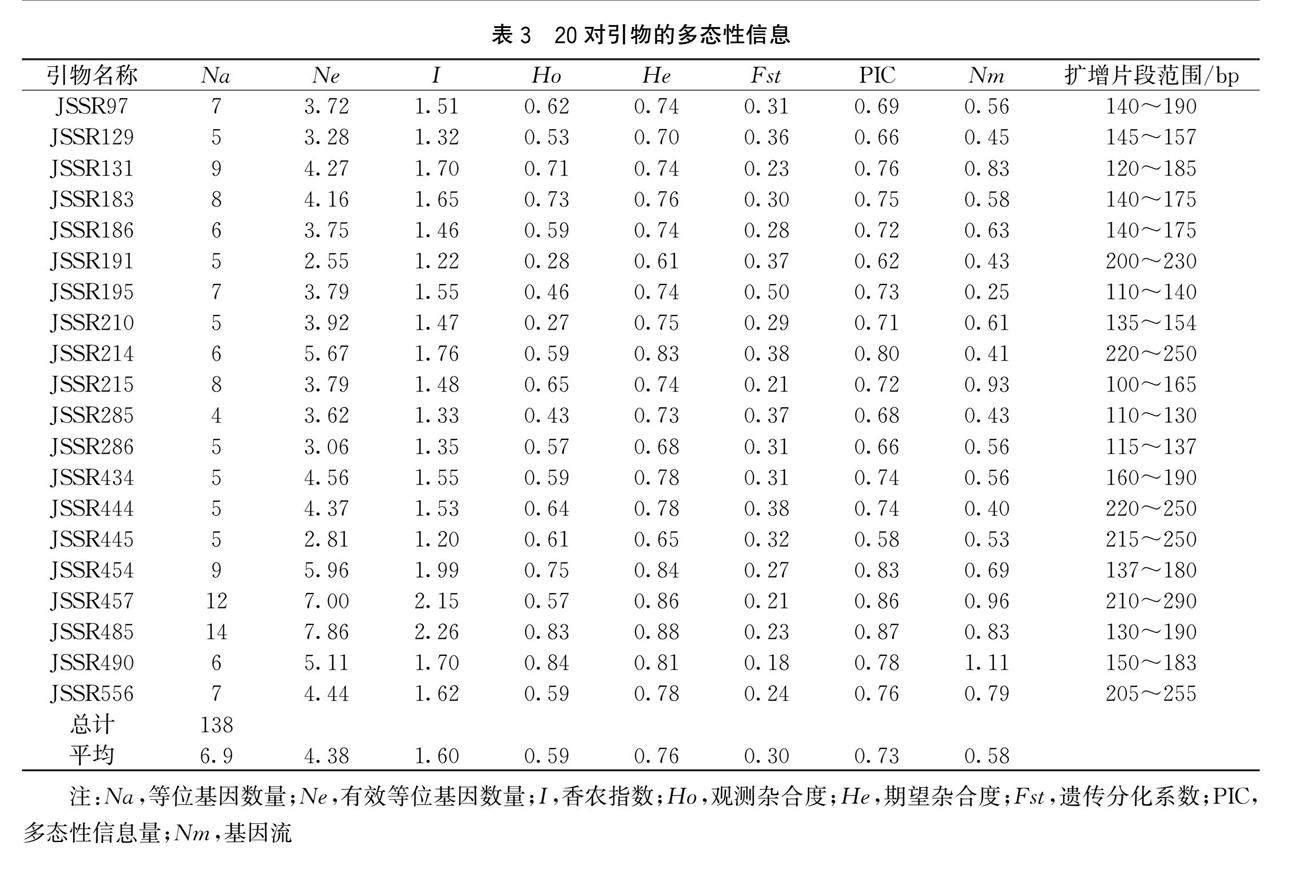
2.1 SSR引物多态性
20对SSR引物在93个样品中共检测到138个等位基因,平均每个位点6.9个等位基因。每对引物多态性谱带的百分率是100%,扩增片段范围为100~290 bp。不同的引物扩增出的等位基因数量也不尽相同。扩增出等位基因数量最多的是JSSR485,共计14个;相对最少的是JSSR285,是4个(见表3)。观测杂合度和期望杂合度的平均值分别为0.59和0.76,变幅分别为0.27~0.84 和0.61~0.88。香农指数的变化范围是1.20(JSSR445)和2.26(JSSR485),平均为1.60。基因流的变化范围是0.25(JSSR195)和1.11(JSSR490),平均为0.58。PIC的分布范围在0.58~0.87,分别在JSSR445和JSSR485,平均为0.73。筛选出的20对引物的PIC值全部大于0.5,表明全部为高度多态性引物,能较高信息量的反应出试材基因型多样性水平。
2.2 遗传多样性分析
在聚类阈值为0.72的情况下,将93个样品划分为9个主要类群(见图1)。第I大类包含黄骅古贝壳堤的全部 36 份酸枣样品和河北邢台的4份酸枣样品。第II大类和第III大类均为河北省酸枣,每个亚群分别有4个和7个酸枣类型。第Ⅳ大类包含3个酸枣类型,其中2个来自河北省,1个来自山西省。第Ⅴ大类组成较复杂,包含13个主栽的中国枣品种、7个河北省的酸枣类型、3个辽宁的酸枣类型、2个河南的酸枣类型、1个山西的酸枣类型和1个山东的酸枣类型。第Ⅵ大类由3个酸枣类型组成,其中1个来自山东省,剩余2个来自山西省。第Ⅶ大类包含4个酸枣类型,2个来自河南,2个来自陕西。第Ⅷ由2个酸枣类型组成,并且全部来自山东省。第Ⅸ大类由3个来自云南的毛叶枣组成。
为了阐明各大类群间的遗传分化,同时计算了Neis遗传距离与遗传一致度。由表4可知,遗传一致度的变幅为0.0979~0.6962,相应的遗传距离变幅为0.3621~2.3241。第Ⅲ大类和第Ⅴ大类最近,遗传一致度为0.6962,同时遗传距离最小为0.3621。第Ⅷ大类和第Ⅸ大类最远,其遗传一致度最低为0.0979,遗传距离最大为2.2341。包括所有贝壳堤样品在内的第I大类与第Ⅲ大类最近,其遗传一致度为0.6539,遗传距离为0.4247。很明显,第I大类与包含3个毛叶枣品种‘高朗‘脆密‘蜜丝在内的第Ⅸ大类最远,其遗传一致度为0.2407,遗传距离为1.4243。
分析了反映各大类群间的遗传多样性的指标,包括每个类群的观测到等位基因数量(Na)、有效等位基因数量(Ne)、香农指数(I)、观测杂合度(Ho)、期望杂合度(He)和固定指数(F)。由表5可知,9
大类群的香农指数(I)的变化范围是0.46~1.36,平均为1.02。观测杂合度(Ho)和期望杂合度(He)的变化范围分别为0.50~0.68和0.36~0.71,均值分别为0.61和0.64。大多数位点的期望杂合度高于观测杂合度。固定指数(F)的变化范围是0.4043~0.8055,平均为 0.4860。第Ⅴ大类遗传多样性最丰富(Na= 5.55、Ne= 3.47、I= 1.36)。其次就是包含 36 个黄骅古贝壳堤酸枣类型的第Ⅰ大类(Na=5.40、Ne=3.18、I = 1.30)。聚类Ⅸ多样性最低(Na=1.86, Ne=2.69, I=0.46)。
2.3 群體结构分析
根据20个SSR标记的基因分型数据对群体结构进行分析(见图2)。根据模型统计表明,在K=9时,ΔK=3.75,显著高于其他处峰值,将样品划分为9个群体,依次进行编号(A~I)。与本研究的距离聚类相一致的是,包含36个黄骅古贝壳堤酸枣类型的群体 E 极少有与其他8个群体的相互混杂成分。
纵坐标表示各群体中的每个个体占某群体祖先成分系数(Q);横坐标的数字表示每个个体的编号,与表1中第一列的编号一致另外,一些群体(如A、B群体)中遗传背景比较一致,全部来源于河北省,混杂程度相对较低;而有的群体(如H、I群体)中分配率较高,个体间混合程度相对较高,来源于不同的栽培区域,群体间的遗传物质交流相对较多。
Q值可以反映各样品所含不同类群遗传成分的多少(见表6)。群体B、C中Q≥0.6是100%,全部是来自河北省的酸枣类型,没有其他类群的遗传成分。其次就是黄骅古贝壳堤群体(E)Q≥0.6是97.4%,Q值大于0.8和0.9的样品占92.1%和86.8%,说明黄骅古贝壳堤群体中基本没有含有其他类群的遗传成分。
3 讨论与结论
聚类分析可以反映亲缘关系的远近。本研究第Ⅴ大类中,13个主栽枣品种与14个酸枣聚在一起,即酸枣与枣没有完全分开,其他亚组中则没有酸枣和枣聚在一起的现象,说明枣和酸枣亲缘关系近,这与李瑞环等[12]的结果一致。所有黄骅古贝壳堤酸枣都聚集在第Ⅰ大类,而作为外对照,其他6个省的
酸枣类型并没有根据地理位置的不同而区分开来,只有贝壳堤酸枣能很好的和外对照酸枣、主栽枣品种以及毛叶枣区分开。因此,不能简单根据地理位置划分组别,而贝壳堤酸枣较为独特。毛叶枣种质可以单独聚类到一起,与其他的遗传相似系数为0.67,说明毛叶枣跟酸枣和枣的亲缘关系较远[26]。
高的杂合度意味着高的遗传多样性[27-28]。本试验中,黄骅古贝壳堤酸枣群体的观测杂合度(Ho)和期望杂合度(He)分别为0.56和0.68。同样利用SSR标记,在酸枣上报道过更高水平的多态性(Ho=0.812,He=0.805[29]。相对于其他地区,黄骅古贝壳堤酸枣遗传多样性低,可能是由于地理位置特殊,相对闭塞,与外地的酸枣种质基因交流少的结果。
群体结构分析是关联分析的重要步骤,可有效避免错误的相似性或伪造关联性,从而可以更有效的对自然群体做关联分析[24,30]。本研究只有黄骅古贝壳堤群体(E)、云南毛叶枣群体(C)和大部分辽宁酸枣群体(F)可很明显的独立成一个群体,而其他地区酸枣则被划分到不同的群体或有一部分与其他地区样品结合。例如样品数量仅次于黄骅古贝壳堤酸枣的河北省酸枣群体分布在A、B、D、I 4个群体中,这表明任何来自同一地理区域内的酸枣材料都存在多种血缘来源或较多的遗传变异类型。I组中包括河北、河南、山西、陕西四地的酸枣,这种结果可能是由于酸枣的多点起源且相互交流所导致的。尽管酸枣的群体结构和迁徙情况很复杂,但黄骅古贝壳堤酸枣仍然自己聚在一起,原因可能是黄骅古贝壳堤酸枣极其特殊的地理位置和生长环境,导致古贝壳堤酸枣较为封闭,交流少。此外,Q值反映各自交系所含不同类群遗传成分的比例[31]。本研究解析93个样品遗传成分发现,93个样品中有 18.3% (17个)的最大Q值小于0.6,说明有少量样品融合了多个类群的遗传成分,在黄骅古贝壳堤群体(E)中,36个来自黄骅古贝壳堤的样品最大Q值全部大于0.6。由此可见,贝壳堤酸枣几乎没有跨类群的遗传成分。处于濒危的黄骅古贝壳堤酸枣资源独特,应进一步加强保护利用。
中文致谢
参考文献
[1] HUANG J, YANG X, ZHANG C, et al. Development of chloroplast microsatellite markers and analysis of chloroplast diversity in Chinese jujube (Ziziphus jujuba Mill.) and wild jujube (Ziziphus acidojujuba Mill.)[J]. PLoS One, 2015, 10(9): e0134519.
[2] ZHANG C, HUANG J, YIN X, et al. Genetic diversity and population structure of sour jujube, Ziziphus acidojujuba[J]. Tree Genetics & Genomes, 2015, 11: 1-12.
[3] 曲泽洲,王永蕙.中国果树志·枣卷[M].北京:中国林业出版社, 1993.
[4] 刘孟军, 汪民.中国枣种质资源[M].北京:中国林业出版社, 2009.
[5] XUE X, ZHAO A, WANG Y, et al. Metabolomics-based analysis of flavonoid metabolites in Chinese jujube and sour jujube fruits from different harvest periods[J]. Journal of Food Science, 2022, 87(9): 3752-3765.
[6] WANG Z, AN X, CHITRAKAR B, et al. Spatial and temporal distribution of phenolic and flavonoid compounds in sour jujube (Ziziphus. acidojujuba Cheng et Liu) and their antioxidant activities[J]. Plant Foods for Human Nutrition, 2023, 78(1): 46-51.
[7] 张鹏飞,尉东峰,刘亚令,等.枣与酸枣的SSR遗传多样性研究[J].华北农学报,2015,30(2):150-155.
[8] 胡晓艳.酸枣遗传多样性、谱系地理及种群历史动态变迁研究[D].山西农业大学,2021.
[9] 赵希涛.中国贝壳堤发育及其对海岸线变迁的反映[J].地理科学,1986(4):293-304.
[10] 薛春汀.渤海西岸自然保护区内贝壳堤现状和应对措施[J].海洋地质动态,2010,26(1):41-44.
[11] 岳军,张宝华,耿秀山,等.渤海湾西岸的几道贝壳堤[J].地质学报,2012,86(3):522-534.
[12] 李瑞环,李新岗,黄建,等.枣和酸枣亲缘关系的RAPD分析[J].果树学报,2012,29(3):366-373.
[13] WANG J R, DAI L, LIU P, et al. Acquirement of hybrids via controlled hybridization in Chinese jujube[J]. Acta Horticulturae, 2016 (1116): 71-76.
[14] DAGHIGHI S, ALIZADEH Z, HABIBI H. Determination of Chromosome Number and Genetic Diversity using SSR and RAPD Markers in Ziziphus jujuba Mill[J]. Iranian Journal of Science and Technology, Transactions A: Science, 2021, 45: 77-89.
[15] FARAHANI F, SEDIGHZADEGAN A, SHEIDAI M, et al. Population genetic studies in Ziziphus jujuba Mill.: multiple molecular markers (ISSR, SRAP, ITS, Cp-DNA)[J]. Caryologia, 2019, 72(4): 51-60.
[16] 王若溪.遼西地区酸枣经济性状SSR标记关联分析及果实品质研究[D].沈阳农业大学,2022.
[17] SAREEN A, SHARMA V, GUPTA R C. Assessment of genetic diversity and population structure in wild Ziziphus species from northwest India using SSR marker technique[J]. Journal of Genetic Engineering and Biotechnology, 2023, 21(1): 1-11.
[18] BARAKET G, CHATTI K, SADDOUD O, et al. Comparative assessment of SSR and AFLP markers for evaluation of genetic diversity and conservation of fig, Ficus carica L., genetic resources in Tunisia[J]. Plant Molecular Biology Reporter, 2011, 29: 171-184.
[19] CAMPOY J A, RUIZ D, EGEA J, et al. Inheritance of flowering time in apricot (Prunus armeniaca L.) and analysis of linked quantitative trait loci (QTLs) using simple sequence repeat (SSR) markers[J]. Plant Molecular Biology Reporter, 2011, 29: 404-410.
[20] ZAKI N M, SINGH R, ROSLI R, et al. Elaeis oleifera genomic-SSR markers: exploitation in oil palm germplasm diversity and cross-amplification in Arecaceae[J]. International journal of molecular sciences, 2012, 13(4): 4069-4088.
[21] 王若溪,常婧,曲凯伦,等.酸枣经济性状关联分析及优异等位基因挖掘[J/OL].西北农林科技大学学报(自然科学版),2023(6):1-12.
[22] 闫芬芬,郑兴娟,罗智,等.枣和酸枣杂交后代遗传多样性的SSR分析[J].西北林学院学报,2018,33(3):91-97,152.
[23] XIAO J, ZHAO J, LIU M, et al. Genome-wide characterization of simple sequence repeat (SSR) loci in Chinese jujube and jujube SSR primer transferability[J]. PLoS One, 2015, 10(5): e0127812.
[24] PRITCHARD J K, STEPHENS M, DONNELLY P. Inference of population structure using multilocus genotype data[J]. Genetics, 2000, 155(2): 945-959.
[25] EVANNO G, REGNAUT S, GOUDET J. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study[J]. Molecular ecology, 2005, 14(8): 2611-2620.
[26] 李慧.枣种质SSR指纹图谱构建及遗传多样性分析[D].保定:河北农业大学, 2014.
[27] SLATKIN M, BARTON N H. A comparison of three indirect methods for estimating average levels of gene flow[J]. Evolution, 1989, 43(7): 1349-1368.
[28] Russell J R, Fuller J D, Macaulay M, et al. Direct comparison of levels of genetic variation among barley accessions detected by RFLPs, AFLPs, SSRs and RAPDs[J]. Theoretical and Applied genetics, 1997, 95: 714-722.
[29] 張春梅,殷晓,李新岗,等.黄河沿岸酸枣遗传多样性研究[J].西北农林科技大学学报, 2013, 41(12)107-112.
[30] KING R A, HARRIS S L, KARP A, et al. Characterisation and inheritance of nuclear microsatellite loci for use in population studies of the allotetraploid Salix alba-Salix fragilis complex[J]. Tree Genetics & Genomes, 2010, 6: 247-258.
[31] 秦君,李英慧,刘章雄,等.黑龙江省大豆种质遗传结构及遗传多样性分析[J].作物学报,2009,35(2):228-238.
收稿日期:2023-11-06中文收稿日期
基金项目:河北省重点研发计划项目(21326304D-1)。
第一作者简介:尚国丽(1998-),女,在读硕士,主要从事枣属植物发掘利用研究。E-mail:sgl15224701115@163.com
通信作者:王玖瑞(1972-),男,博士,教授,主要从事枣属植物发掘利用等研究。E-mail:wjrjujube@126.com
