脂蛋白相关lncRNA参与炎症反应致冠心病的分子机制
2024-04-29解晨曦毕波
解晨曦 毕波

摘要 目的:探讨脂蛋白相关lncRNA H19(H19)参与炎症反应导致冠心病的分子机制。方法:选取2019年1月—2022年1月100例冠状动脉造影后新诊断为冠心病的病人和100例因不明原因的胸痛或疑似冠心病症状而接受冠状动脉造影但最终被确定患有冠心病以外疾病的受试者(对照组)。收集血浆样本,通过逆转录定量聚合酶链反应检测H19和miR-212-5p,并通过酶联免疫吸附法(ELISA)测定炎性细胞因子。结果:冠心病组H19表达明显高于对照组[2.27(1.68,3.39)和1.00(0.60,1.41),P<0.001];H19诊断冠心病的受试者工作特征(ROC)曲线下面积(AUC)为0.903[95%CI(0.847,0.958)]。lncRNASNP2、Starbase和LncBook数据库预测miR-212-5p与H19结合。冠心病组miR-212-5p表达低于对照组[0.44(0.32,0.70)和1.00(0.78,1.37),P<0.001];miR-212-5p诊断冠心病的AUC为0.839[95%CI(0.760,0.918)]。冠心病组H19和miR-212-5p呈负相关(r=-0.436,P<0.001)。H19表达与
Gensini评分呈正相关(r=0.430,P<0.001);miR-212-5p表达与Gensini评分呈负相关(r=-0.315,P=0.006)。冠心病病人H19表达与TNF-α(r=0.273,P=0.008)和IL-17(r=0.310,P=0.003)呈正相关。miR-212-5p表达与TNF-α(r=-0.272,P=0.001)、IL-1β(r=-0.223,P=0.030)、IL-6(r=-0.295,P=0.004)和IL-17(r=-0.348,P<0.001)呈负相关。结论:循环H19及其靶标miR-212-5p与冠心病疾病的严重程度和炎症水平相关。
关键词 冠心病;长链非编码RNA H19;miR-212-5p;炎症反应
doi:10.12102/j.issn.1672-1349.2024.02.022
基金项目 2020年度省部共建中亚高发病成因与防治国家重点实验室项目(No.SKL-HIDCA-2020-WF4)
作者单位 新疆医科大学第五附属医院(乌鲁木齐 830011),E-mail:41200630@qq.com
引用信息 解晨曦,毕波.脂蛋白相关lncRNA参与炎症反应致冠心病的分子机制[J].中西医结合心脑血管病杂志,2024,22(2):326-330.
冠心病(coronary heart disease,CHD)是一种常见的疾病,每年死亡人数超过1 700万例,是全球人类疾病死亡的主要原因[1]。冠心病的早期发现和治疗(即药物、介入或手术治疗)与随后的冠心病结局相关。近年来,许多研究报告了多种类型的生物标志物,例如心肌肌钙蛋白-I、脂蛋白A、纤维蛋白原和胱抑素C,用于预测冠心病风险[2-3]。尽管发现了这些生物标志物,但冠心病的早期识别和管理仍然存在不足。因此,有必要不断识别冠心病的生物标志物。长链非编码RNA(lncRNA)是一种长度超过200个核苷酸的非编码RNA。生物体内的lncRNA种类繁多,数量巨大,并参与多种疾病的病理进程[4]。其中,脂蛋白相关lncRNA-mRNA网络在冠心病病理过程中发挥重要作用[5]。lncRNA H19(H19)作为脂蛋白相关lncRNA,研究发现H19通过抑制264.7细胞中的Caspase-1减轻氧化低密度脂蛋白诱导的细胞焦亡[6]。此外,还有研究证实,H19下调通过诱导血管平滑肌细胞的凋亡来缓解冠心病[7]。然而,H19在冠心病过程中对炎症反应的作用尚不清楚,仍需要进一步研究其作为冠心病生物标志物的潜在作用。因此,本研究旨在探讨H19与冠心病病人冠状动脉狭窄程度、常见生化指标和炎性细胞因子的关系。
1 资料与方法
1.1 临床资料
纳入2019年1月—2022年1月因不明原因胸痛或疑似冠心病症状而在冠状动脉造影后新诊断为冠心病的病人100例。纳入标准:冠状动脉造影显示冠心病,年龄≥18岁,并且至少有1条主要的心外膜血管狭窄>50%。排除标准:1)除冠心病以外的其他心脏病;2)患有自身免疫性疾病、严重感染、严重的肝脏或肾脏疾病、血液系统疾病、恶性肿瘤;3)孕妇或哺乳期妇女。
招募100例因不明原因的胸痛或疑似冠心病症状而接受冠状动脉造影但最终被确定患有冠心病以外疾病的受试者作为对照组。在对照组的招募中,年龄限制在50~80岁,男性与女性比例限制在4∶1,旨在匹配冠心病病人和对照组的年龄和性别。对照组排除标准:1)伴有自身免疫性疾病、严重感染、严重的肝脏或肾脏疾病、血液系统疾病、恶性肿瘤;2)孕妇或哺乳期妇女。所有受试者均签署书面知情同意书。
1.2 数据记录
入组后记录所有受试者的人口统计学数据、病史、合并症和生化指标。通过冠状动脉造影计算Gensini评分,定量分析冠状动脉狭窄严重程度。
1.3 样本采集
在冠状动脉造影之前从所有登记的受试者中采集外周血。采血后,在4 ℃下以2 500×g离心15 min,将血浆样品与外周血样品分离。血浆样本用于检测H19和miR-212-5p的表达。测量冠心病病人血浆样品中肿瘤坏死因子α (TNF-α)、白细胞介素(IL)-1β、IL-6和IL-17水平。
1.4 H19和miR-212-5p表达检测
采用逆转录定量聚合酶链式反应(RT-qPCR)检测血浆样品中H19和miR-212-5p的表达。使用RNeasy Protect Mini Kit (德国Qiagen公司)从血浆样品中提取总RNA,然后使用带有随机引物的iScriptTMcDNA Synthesis Kit,美国Bio-Rad公司生产(25 ℃ 5 min,46 ℃ 20 min,95 ℃ 1 min)。随后,使用THUNDERBIRD SYBRqPCR Mix(日本Osaka公司)进行实时荧光定量聚合酶链式反应(qRT-PCR)以量化H19和miR-212-5p表达(95 ℃ 60 s,然后40个循环的95 ℃ 15 s和60 ℃持续60 s),均使用 2-ΔΔCt方法计算,分别以甘油醛-3-磷酸脱氢酶(GAPDH)和U6作为内部参考。用于聚合酶链式反应(PCR)的引物见表1。
1.5 炎性细胞因子测定
使用酶联免疫吸附实验(ELISA)测定炎性细胞因子TNF-α、IL-1β、IL-6和IL-17,试剂盒购自美国Thermo Fisher Scientific公司。
1.6 统计学处理
采用SPSS 25.0统计软件进行数据分析。根据变量分布和正态性的特点,使用均数、标准差、中位数(M)、四分位间距(IQR)、百分比(%)进行描述性分析。使用χ2检验、t检验或Wilcoxon秩和检验进行统计推断。使用Spearman秩相关检验估计两个连续变量之间的关联。受试者工作特征(ROC)曲线用于估计变量在区分冠心病病人和对照组方面的效能。以P<0.05为差异有统计学意义。
2 结 果
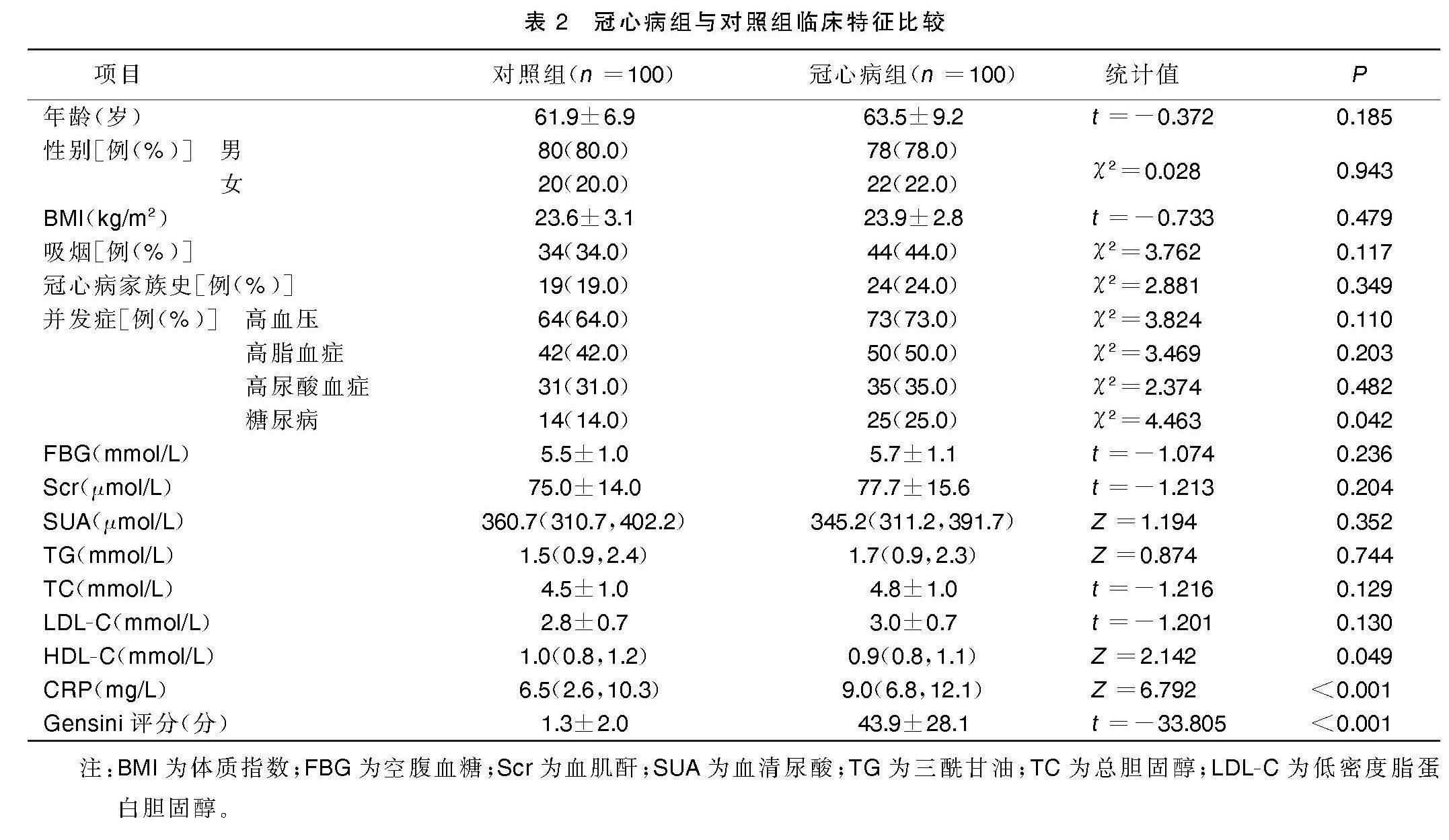
2.1 冠心病组与对照组临床特征比较
与对照组相比,冠心病组糖尿病比例、C反应蛋白(CRP)水平、Gensini评分明显增加(P<0.05),高密度脂蛋白胆固醇(HDL-C)水平明显降低(P<0.05)。详见表2。
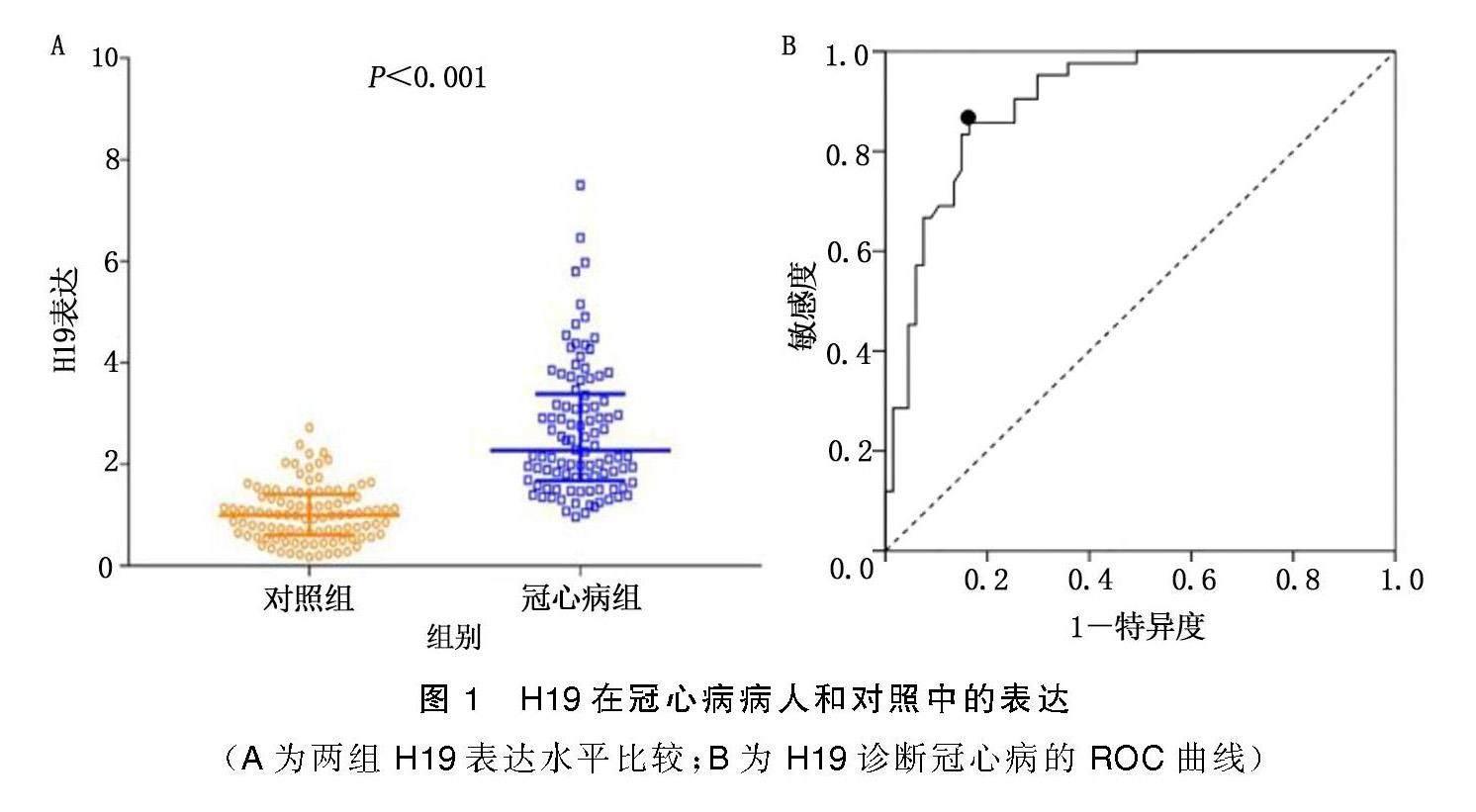
2.2 两组H19表达比较及H19诊断冠心病的效能
冠心病组H19表达明显高于对照组[2.27(1.68,3.39)与1.00 (0.60,1.41),P<0.001],详见图1A。H19诊断冠心病的ROC曲线下面积(AUC)为0.903[95%CI(0.847,0.958)],详见图1B。
2.3 H19作为miR-212-5p ceRNA发挥作用
作为ceRNA,H19竞争性结合miRNA并调节细胞质中的靶mRNA。miRNA靶点预测生物信息学(lncRNASNP2:http://bioinfo.life.hust.edu.cn/lncRNASNP#!/,Starbase:http://www.starbase.sysu.edu.cn/,LncBook:https://bigd.big.ac.cn/lncbook/index)用于寻找与H19相互作用的miRNA,共确定12种候选miRNA(见图2A)。其中,有研究报道miR-212-5p抑制心脏成纤维,具有保护心脏的作用[8]。因此,研究选择miR-212-5p进行进一步分析。冠心病组miR-212-5p表达低于对照组[0.44(0.32,0.70)与1.00(0.78,1.37),P<0.001]。详见图2B。miR-212-5p对冠心病具有良好的鉴别价值[AUC=0.839,95%CI(0.760,0.918)]。详见图2C。
2.4 冠心病病人H19、miR-212-5p、Gensini评分及生化指标之间的相关性
在对照组中,未发现H19和miR-212-5p之间存在相关性(r=-0.128,P=0.204);在冠心病组中,H19和miR-212-5p呈负相关(r=-0.436,P<0.001);H19表达与Gensini评分呈正相关(r=0.430,P<0.001);miR-212-5p表达与Gensini评分呈负相关(r=-0.315,P=0.006)。详见图3。此外,H19表达与冠心病病人HDL-C水平呈负相关(r=-0.271,P=0.009),与CRP水平呈正相关(r=0.460,P<0.001);miR-212-5p表达与冠心病病人TC (r=-0.232,P=0.023)和CRP(r=-0.423,P<0.001)水平呈负相关。详见表3。
2.5 冠心病病人H19和miR-212-5p与炎性细胞因子的相关性
在冠心病病人中,H19表达与TNF-α(r=0.273,P=0.008)和IL-17(r=0.310,P=0.003)水平呈正相关。miR-212-5p表达与TNF-α(r=-0.272,P=0.001)、IL-1β(r=-0.223,P=0.030)、IL-6(r=-0.295,P=0.004)和IL-17(r=-0.348,P<0.001)水平呈负相关。详见表4。
3 讨 论
有研究表明,几种非编码RNA具有作为冠心病生物标志物的潜力,例如lncRNA-FA2H-2、lncRNA GAS5及其潜在靶标miR-21和miR-194-3p[9-10]。本研究扩展了先前发现,并证实H19和miR-212-5p作为炎症调节因子在心血管系统的多种病理生理过程中发挥着至关重要的作用。本研究结果表明,冠心病病人中H19高表达,而miR-212-5p在心血管系统中表达不足。ROC曲线显示,H19和miR-212-5p均能够诊断冠心病,并且AUC值均超过0.8。同时,H19表达与冠心病病人的miR-212-5p呈负相关,原因可能是:1)H19调节系统性炎症[miR-22-3p/NOD样受体蛋白3(NLRP3)通路[11]]和内皮细胞的生长(通过miR-194-3p-靶向硫氧还蛋白相互作用蛋白轴[12]),而miR-212-5p调节炎性细胞因子[通过磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)]通路[13]。因此,H19和miR-212-5p的失调增加了冠心病的风险。2)H19与miR-212-5p之间的负相关可能是由于H19作为miR-212-5p的负调节因子[14]。本研究中,所有冠心病受试者均首次诊断为冠心病,且在当前研究之前没有接受任何针对冠心病的治疗。因此,可基本排除治疗对H19和miR-212-5p表达的影响。
Gensini评分是衡量冠心病冠状动脉狭窄一般严重程度的有意义的评分系统[15]。本研究表明,H19与冠心病病人Gensini评分呈正相关,而miR-212-5p与冠心病病人Gensini得分呈负相关。可能原因为:1)H19通过促进miR-21-5p介导的Toll样受体4(TLR4)/核转录因子-κB信号通路增强炎症,导致更严重的血管狭窄,从而加重糖尿病心血管疾病[16];2)miR-212-5p通过PAFAH1B2信号通路调节血管平滑肌细胞的增殖和迁移,介导冠心病的严重程度[17]。此外,本研究还表明H19与HDL-C呈负相关;同时,miR-212-5p与TC呈负相关,这可能是由于它们对动脉粥样硬化中胆固醇和细胞内脂质积累的调节[6]。有报道指出HDL-C和TC是冠心病的潜在危险因素[3]。因此,可以推断H19和miR-212-5p调节脂质代谢间接促进冠心病进展。
H19和miR-212-5p与心血管疾病病人的炎症水平相关。一项研究报道,H19在动脉粥样硬化进展过程中通过海绵状miR-221加重人髓系白血病单核细胞(THP)-1巨噬细胞的炎症反应[18]。另一项研究报告称,巨噬细胞中miR-212-5p的缺失会促进动脉粥样硬化形成过程中的血管炎症[19]。本研究表明,冠心病病人的H19表达与CRP、TNF-α和IL-17水平呈正相关,而miR-212-5p表达与CRP、TNF-α、IL-1β、IL-6和IL-17水平呈负相关。可能原因:1)H19通过多种途径增强炎性细胞因子的产生,例如miR-22-3p/NLRP3信号通路,触发CRP、TNF-α和IL-17水平升高[11];2)miR-212-5p通过c-Jun氨基末端激酶(JNK)信号通路和PI3K/AKT通路下调TNF-α、IL-1β、IL-6和IL-17,导致促炎细胞因子和CRP水平降低[13]。同时,H19和miR-212-5p与IL-17具有相关性,这可以通过H19和miR-212-5p对T辅助17平衡和分化的调节来解释。
4 小 结
本研究结果表明,H19和miR-212-5p与冠心病疾病的严重程度和炎症水平相关。基于这些发现,对H19和miR-212-5p的强化监测可能可以反映冠心病病人的疾病严重程度和炎症水平,从而对不同疾病严重程度或炎症水平的冠心病病人进行适当管理。
参考文献:
[1] CUSHMAN M,SHAY C M,HOWARD V J,et al.Ten-year differences in women′s awareness related to coronary heart disease:results of the 2019 American Heart Association national survey:a special report from the American Heart Association[J].Circulation,2021,143(7):e239-e248.
[2] LIMA B B,HAMMADAH M,KIM J H,et al.Relation of high-sensitivity cardiac troponin I elevation with exercise to major adverse cardiovascular events in patients with coronary artery disease[J].The American Journal of Cardiology,2020,136:1-8.
[3] MEDINA-LEYTE D J,ZEPEDA-GARCA O,DOMNGUEZ-PREZ M,et al. Endothelial dysfunction,inflammation and coronary artery disease:potential biomarkers and promising therapeutical approaches[J].International Journal of Molecular Sciences,2021,22(8):3850.
[4] WANG Q C,WANG Z Y,XU Q,et al.lncRNA expression profiles and associated ceRNA network analyses in epicardial adipose tissue of patients with coronary artery disease[J].Scientific Reports,2021,11(1):1567.
[5] ZHANG C J,ZHANG X,GONG Y T,et al.Role of the lncRNA-mRNA network in atherosclerosis using ox-low-density lipoprotein-induced macrophage-derived foam cells[J].Molecular Omics,2020,16(6):543-553.
[6] LIU S,XU D S,MA J L,et al.LncRNA H19 mitigates oxidized low-density lipoprotein induced pyroptosis via caspase-1 in raw 264.7 cells[J].Inflammation,2021,44(6):2407-2418.
[7] ZHANG B F,JIANG H,CHEN J,et al.LncRNA H19 ameliorates myocardial infarction-induced myocardial injury and maladaptive cardiac remodelling by regulating KDM3A[J].Journal of Cellular and Molecular Medicine,2020,24(1):1099-1115.
[8] WANG Z Q,FU M M,LI Y J.miR-142-5p and miR-212-5p cooperatively inhibit the proliferation and collagen formation of cardiac fibroblasts by regulating c-Myc/TP53INP1[J].Canadian Journal of Physiology and Pharmacology,2020,98(5):314-323.
[9] LI Y B,GENG Y,ZHOU B D,et al.Long non-coding RNA GAS5 worsens coronary atherosclerosis through microRNA-194-3p/TXNIP axis[J].Molecular Neurobiology,2021,58(7):3198-3207.
[10] CHEN Z H,SONG S X,ZHU J M,et al.Regulatory mechanism of miR-21 in formation and rupture of intracranial aneurysm through JNK signaling pathway-mediated inflammatory response[J].International Journal of Clinical and Experimental Pathology,2020,13(7):1834-1841.
[11] SUN J Y,MAO S,JI W.LncRNA H19 activates cell pyroptosis via the miR-22-3p/NLRP3 axis in pneumonia[J].American Journal of Translational Research,2021,13(10):11384-11398.
[12] SU W H,HUO Q,WU H,et al.The function of LncRNA-H19 in cardiac hypertrophy[J].Cell & Bioscience,2021,11(1):153.
[13] CHEN F F,SUN N,WANG Y,et al.miR-212-5p exerts tumor promoter function by regulating the Id3/PI3K/Akt axis in lung adenocarcinoma cells[J].Journal of Cellular Physiology,2020,235(10):7273-7282.
[14] REZAEI O,NATEGHINIA S,ESTIAR M A,et al.Assessment of the role of non-coding RNAs in the pathophysiology of Parkinson′s disease[J].European Journal of Pharmacology,2021,896:173914.
[15] 江业慧,张平洋,冉红,等.基于AFI的无室壁运动异常冠心病患者左室心肌运动及其与冠脉狭窄程度间关系的研究[J].中国超声医学杂志,2020,36(2):125-128.
[16] XIONG W,YAO M R,YANG Y Q,et al.Implication of regulatory networks of long noncoding RNA/circular RNA-miRNA-mRNA in diabetic cardiovascular diseases[J].Epigenomics,2020,12(21):1929-1947.
[17] KIM G R,ZHAO T W,KEE H J,et al.microRNA-212-5p and its target PAFAH1B2 suppress vascular proliferation and contraction via the downregulation of RhoA[J].PLoS One,2021,16(3):e0249146.
[18] HUANG S F,ZHAO G F,PENG X F,et al.The pathogenic role of long non-coding RNA H19 in atherosclerosis via the miR-146a-5p/ANGPTL4 pathway[J].Frontiers in Cardiovascular Medicine,2021,8:770163.
[19] BAI X Z,HE T,LIU M C,et al.Integrative analysis of microRNAs and mRNAs in LPS-induced macrophage inflammation based on adipose tissue stem cell therapy[J].Inflammation,2021,44(1):407-420.
(收稿日期:2022-07-21)
(本文编辑王丽)