右美托咪定对大鼠坐骨神经阻滞及LRRC4/SDF-1/CXCR4信号通路的影响
2024-04-29钟占鹏吴艳高彪华
钟占鹏 吴艳 高彪华
摘要 目的:研究右美托咪定对大鼠坐骨神经阻滞及富含亮氨酸重复序列C4蛋白(LRRC4)/基质细胞衍生因子1(SDF-1)/CXC趋化因子受体4(CXCR4)信号通路的影响。方法:取60只Wistar大鼠构建坐骨神经慢性结扎损伤(CCI)模型,以随机数字表法分为5组:模型组、右美托咪定(3 μg/kg)组、LRRC4 siRNA质粒组、空载质粒组、右美托咪定(3 μg/kg)+LRRC4 siRNA质粒组;另选12只大鼠只暴露坐骨神经,不结扎,作为假手术组。大鼠以3 μg/kg的右美托咪定和LRRC4 siRNA质粒分组经留置管鞘内给药干预后,检测大鼠疼痛症状,比较机械缩足阈值和热缩足潜伏期;检测大鼠坐骨神经阻滞持续时间,比较其运动和感觉阻滞持续时间;以试剂盒测定大鼠血清炎性因子前列腺素E2(PGE2)、白细胞介素-18(IL-18)、白细胞介素-6(IL-6)水平和脊髓组织氧化应激因子超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)水平;以实时荧光定量聚合酶链式反应(qRT-PCR)实验检测大鼠脊髓组织LRRC4、SDF-1及CXCR4 mRNA表达水平;以免疫印迹法检测大鼠脊髓组织LRRC4/SDF-1/CXCR4信号通路蛋白表达水平。结果:与假手术组比较,模型组大鼠机械缩足阈值、热缩足潜伏期、脊髓组织SOD、GSH-Px、LRRC4 mRNA和蛋白表达水平明显降低(P<0.05),血清PGE2、IL-18和IL-6水平、脊髓组织MDA水平、SDF-1、CXCR4 mRNA和蛋白表达水平明显升高(P<0.05)。与模型组、右美托咪定+LRRC4 siRNA质粒组分别比较,右美托咪定组大鼠机械缩足阈值、热缩足潜伏期、坐骨神经运动和感觉阻滞持续时间、脊髓组织SOD、GSH-Px、LRRC4 mRNA和蛋白表达水平均升高(P<0.05),血清PGE2、IL-18和IL-6水平、脊髓组织MDA水平、SDF-1、CXCR4 mRNA和蛋白表达水平均降低(P<0.05);LRRC4 siRNA质粒组大鼠机械缩足阈值、热缩足潜伏期、脊髓组织SOD、GSH-Px、LRRC4 mRNA和蛋白表达水平均降低(P<0.05),血清PGE2、IL-18和IL-6水平、脊髓组织MDA水平、SDF-1、CXCR4 mRNA和蛋白表达水平均升高(P<0.05);空载质粒组大鼠各指标水平差异均无统计学意义(P>0.05)。结论:右美托咪定可通过上调LRRC4表达,抑制SDF-1/CXCR4信号激活,从而增强坐骨神经阻滞,抵抗炎症和氧化应激反应,明显减轻CCI大鼠疼痛症状。
关键词 坐骨神经阻滞;慢性压迫性神经损伤;富含亮氨酸重复序列C4蛋白;基质细胞衍生因子1;CXC趋化因子受体4;右美托咪定;实验研究
doi:10.12102/j.issn.1672-1349.2024.02.014
作者单位 庆阳市第二人民医院(甘肃庆阳 745000)
通讯作者 高彪华,E-mail:495964167@qq.com
引用信息 钟占鹏,吴艳,高彪华.右美托咪定对大鼠坐骨神经阻滞及LRRC4/SDF-1/CXCR4信号通路的影响[J].中西医结合心脑血管病杂志,2024,22(2):286-291.
神经性疼痛(neuropathic pain,NP)是一种持续性、自发性痛觉超敏疾病,多是由神经系统受损引发,可造成病人长期的剧烈疼痛,极大地威胁其正常工作、生活和身心健康[1-2]。通过注射麻醉药至坐骨神经旁来阻滞其神经传导功能,暂时可达到手术无痛的目的,也可用于治疗神经性疼痛[3]。右美托咪定是进行外周神经阻滞常用的局部麻醉辅佐剂,还具有抗炎镇痛、抗焦虑及镇静的功效[4],可显著减轻大鼠神经病理性痛觉超敏症状[5]。神经性疼痛的发病过程与小胶质细胞激活、氧化应激、神经炎症密切相关,抑制氧化应激、炎症可明显减轻痛觉超敏,是神经性疼痛的有效治疗手法[6-7]。基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1),又叫重组人趋化因子12(recombinant human C-X-C motif chemokine 12,CXCL12),可结合CXC趋化因子受体4(CXC chemokine receptor-4,CXCR4)调控神经炎症,进而参与介导神经性疼痛的发生及病情进展过程,下调SDF-1、CXCR4表达可抑制神经损伤引发的炎症,降低神经病变导致的痛觉超敏[8-9]。富含亮氨酸重复序列C4蛋白(leucine-rich repeat containing 4,LRRC4)可直接介导SDF-1/CXCR4信号传导过程,降低LRRC4的表达可激活SDF-1/CXCR4通路[10]。由此可知,LRRC4/SDF-1/CXCR4信号是具有很好应用前景的神经性疼痛潜在治疗靶点。本研究通过构建坐骨神经慢性结扎损伤(CCI)大鼠模型,研究右美托咪定对大鼠坐骨神经阻滞及LRRC4/SDF-1/CXCR4信号通路的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
Wistar大鼠,雄性,体质量(210±15)g,无特定病原体(SPF)级,购自长沙市天勤生物技术有限公司[SCXK(湘)2019-0013]。所有大鼠分笼适应饲养在本院屏障环境动物房中,每笼4~6只,各种条件及操作严格遵照《中华人民共和国实验动物管理条例》进行。
1.1.2 试剂与仪器
盐酸右美托咪定注射液[国药准字H20133331,规格1 mL(0.1 mg)],由江苏恩华药业股份有限公司生产;总RNA提取试剂盒(R1200)、电化学发光(ECL)试剂盒(PE0010),由北京索莱宝科技有限公司生产;LRRC4 siRNA质粒、空载质粒、SDF-1、甘油醛-3-磷酸脱氢酶(GAPDH)、CXCR4及LRRC4引物、大鼠白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附实验(ELISA)试剂盒(D731010)、一步法反转录荧光定量试剂盒(B639277-0100)、RIPA裂解液(C500005-0050),由生工生物工程(上海)股份有限公司生产;白细胞介素-18(interleukin-18,IL-18)测试盒(H015)、前列腺素E2(prostaglandin E2,PGE2)ELISA试剂盒(D751014),由南京建成生物工程研究所有限公司生产;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(P0012S)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(S0056)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(S0109)、丙二醛(malondialdehyde,MDA)试剂盒(S0131S),由上海碧云天生物技术有限公司生产;兔源抗anti-CXCL12/SDF-1一抗(NBP2-29480),由上海优宁维生物科技股份有限公司生产;兔源重组anti-CXCR4(ab124824)、兔源anti-β-Tubulin抗体(ab21058)、兔源anti-LRRC4抗体(ab111572)、羊抗兔二抗(ab150077),由美国Abcam公司等生产。
Von Frey纤毛机械刺激针、热痛仪,由UGO公司(意大利)生产;Multiskan FC多功能酶标仪、PICO17微量高速离心机、ND-2000C超微量核酸分析仪,由Thermo Fisher Science公司(美国)生产;ChemiDoc XRS+化学发光成像分析系统、PowerPac Universal电泳仪、CFX96 Touch Deep Well荧光定量PCR仪、Trans-Blot SD转膜仪等,由Bio-Rad公司(美国)等生产。
1.2 方法
1.2.1 制备CCI模型大鼠及分组给药
取Wistar大鼠60只,参照文献[11]制备坐骨神经CCI模型:腹腔注射2.5%戊巴比妥钠45 mg/kg,深度麻醉大鼠,于左侧大腿处去毛、消毒、切开皮肤,分离股二头肌后暴露坐骨神经,以铬制羊肠线对其结扎4圈,间距1 mm,结扎强度以导致大鼠小腿肌肉轻度颤动为宜,同时在结扎部位埋置1个聚乙烯导管,伸出背部皮肤固定在大鼠后颈部,缝合切口即完成造模,将模型随机分为5组:模型组、右美托咪定(3 μg/kg)组、LRRC4 siRNA质粒组、空载质粒组、右美托咪定(3 μg/kg)+LRRC4 siRNA质粒组,另选12只大鼠只暴露坐骨神经,不结扎,作为假手术组。
各组大鼠均经留置管给药,右美托咪定剂量为3 μg/kg[12],LRRC4 siRNA质粒、空载质粒剂量参照说明书,均于手术第14天给药1次,模型组和假手术组给予等剂量生理盐水。
1.2.2 检测大鼠疼痛症状
给药后30 min,随机选取各组6只大鼠,安抚其安静后,采用Von Frey纤毛机械刺激针刺激大鼠手术侧足底6 s,力度以能使脚爪轻度弯曲为宜,探针克数由小至大分别刺激,当大鼠舔爪或缩足时,表示大鼠出现疼痛反应,此时探针克数即为机械缩足阈值,重复上述测量3次,取平均值。机械缩足阈值检测结束后,安抚大鼠安静,并将其放在热痛仪的热板上,温度设定为43~45 ℃,当大鼠撤回后肢或舔足时,表示大鼠出现疼痛反应,记录此时所用时间,即为热缩足潜伏期,为避免受伤,大鼠在热板上时间不超过60 s,若在60 s内大鼠均未出现疼痛反应,热缩足潜伏期记为60 s,重复上述测量3次,取平均值。
1.2.3 检测大鼠坐骨神经阻滞情况
给药后30 min,各组剩余6只大鼠检测坐骨神经运动和感觉功能恢复时间来评估大鼠坐骨神经阻滞情况,运动阻滞持续时间检测:提起大鼠躯干,使后肢自由下垂,观察其后足五趾展开情况,当发现大鼠后足第五趾外展时,表明其坐骨神经运动功能恢复,记录所用时间,即为坐骨神经运动阻滞持续时间(从给药后30 min开始观察计时)。感觉阻滞持续时间检测:大鼠用药前,以Von Frey纤毛机械刺激针测定大鼠机械缩足阈值,作为基础值,待大鼠给药并恢复运动功能后,马上再次测定大鼠机械缩足阈值,当其与基础值比较,无显著差异时,表示其坐骨神经感觉功能恢复,记录所用时间,即为坐骨神经感觉阻滞持续时间(从给药后30 min开始观察计时)。
1.2.4 测定大鼠血清PGE2、IL-18、IL-6水平和脊髓组织SOD、GSH-Px、MDA水平
坐骨神经阻滞情况与疼痛症状检测结束后,以1.2.1中方法麻醉所有大鼠,自颈动脉采血、4 ℃离心(15 min,1 000×g),吸出各组上清,以试剂盒测出其中PGE2、IL-18、IL-6水平;处死各组大鼠,解剖分离出脊髓,剪下0.6 g脊髓组织,加生理盐水匀浆、4 ℃离心(25 min,3 000×g),吸出各组上清,以试剂盒测出其中SOD、GSH-Px、MDA水平,具体操作均严格遵循各自试剂盒说明书指导进行。
1.2.5 测定大鼠脊髓组织LRRC4、SDF-1及CXCR4 mRNA表达水平
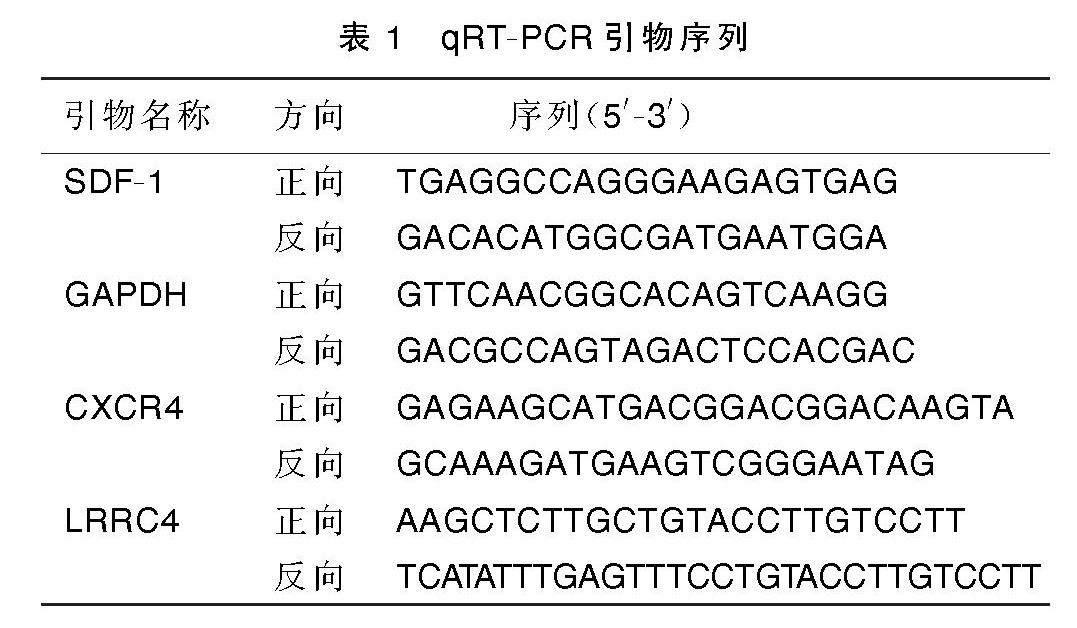
取1.2.4中剩余的脊髓组织,剪下0.5 g,加RIPA裂解液匀浆、4 ℃离心(25 min,3 000×g),吸出各组上清,以试剂盒测出其中蛋白总浓度后分组标记,将其保存在-80 ℃备用;再次剪下脊髓组织0.5 g,以试剂盒提取总RNA后,通过一步法进行反转录实时荧光定量PCR(qRT-PCR)实验,具体操作及反应条件设定均严格遵循各自试剂盒说明书指导进行,选用GAPDH基因作为内参,所得各组Ct值以2-ΔΔCt算法进行分析计算,可得出各基因相对表达水平,引物序列见表1。
取出1.2.5中保存的脊髓组织蛋白样品液,经解冻、变性处理,取出20 μg总蛋白上样,电泳分离、湿转转移、脱脂奶粉封闭后,自所得硝酸纤维膜上将LRRC4、SDF-1、β-Tubulin及CXCR4蛋白截下,以相应一抗孵育过夜,洗膜后二抗孵育1.5 h,再次洗膜、ECL显色、拍照,以Image J软件打开所得图片,定量各蛋白灰度值,对其进行统计分析,最终可得到各组蛋白相对表达水平。
1.3 统计学处理
采用SPSS 24.0软件进行统计分析。实验所得数据均采用均数±标准差(x±s)表示,两组间差异比较行t检验;多组间差异比较用单因素方差分析,组间进一步两两差异比较采用最小显著差异(LSD)-t检验。以P<0.05表示差异有统计学意义。
2 结 果
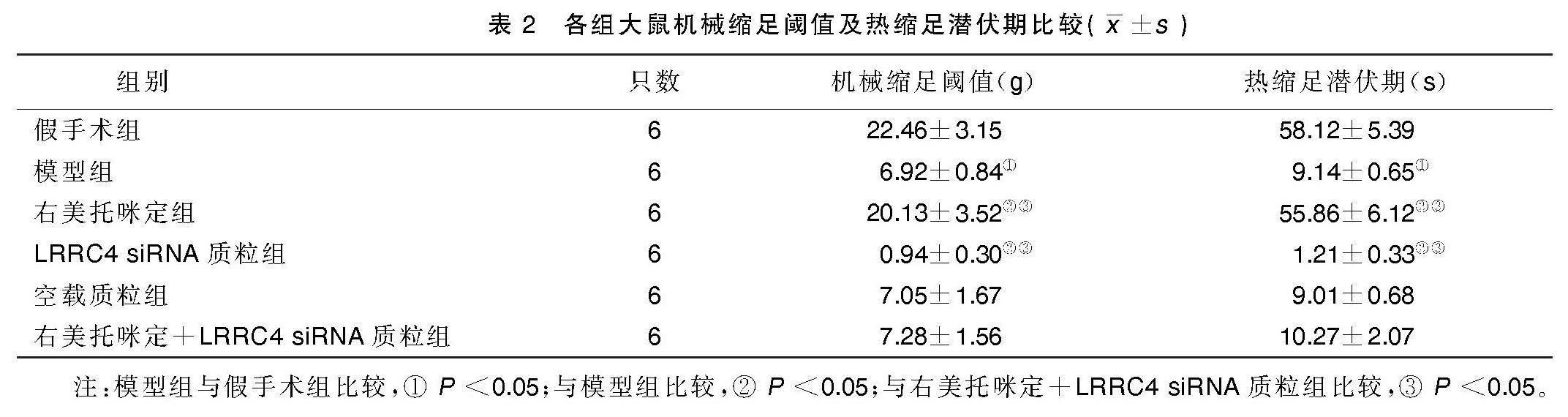
2.1 各组大鼠机械缩足阈值及热缩足潜伏期比较
与假手术组比较,模型组大鼠机械缩足阈值和热缩足潜伏期明显降低(P<0.05);与模型组、右美托咪定+LRRC4 siRNA质粒组分别比较,右美托咪定组大鼠机械缩足阈值和热缩足潜伏期均升高(P<0.05),LRRC4 siRNA质粒组大鼠机械缩足阈值和热缩足潜伏期均降低(P<0.05),空载质粒组大鼠机械缩足阈值和热缩足潜伏期差异均无统计学意义(P>0.05)。详见表2。
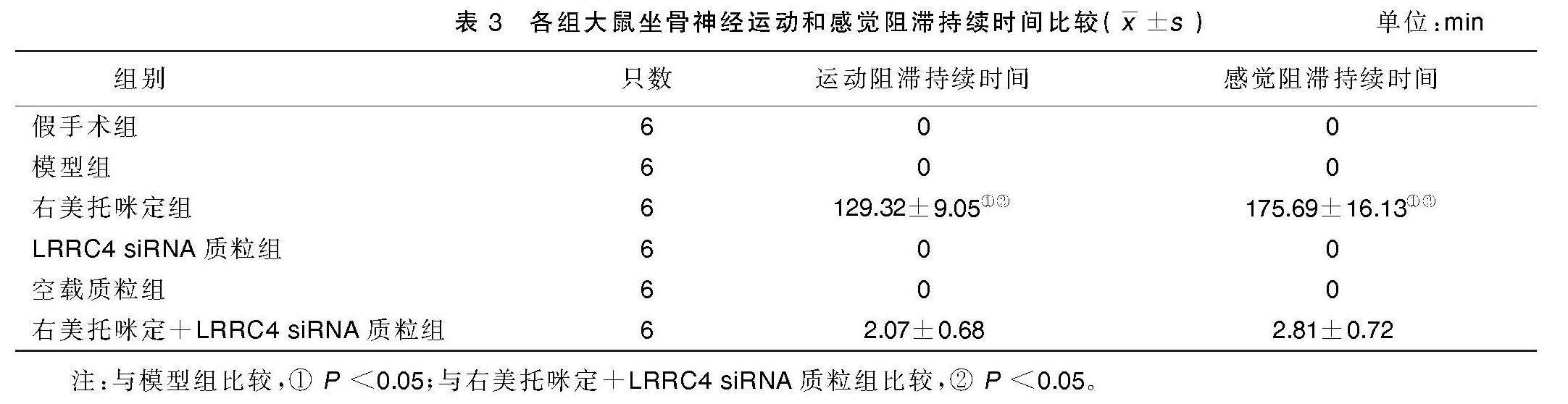
2.2 各组大鼠坐骨神经运动和感觉阻滞持续时间比较
与模型组比较,右美托咪定组大鼠坐骨神经运动和感觉阻滞持续时间均升高(P<0.05)。与右美托咪定+LRRC4 siRNA质粒组比较,右美托咪定组大鼠坐骨神经运动和感觉阻滞持续时间均升高(P<0.05)。详见表3。
2.3 各组大鼠血清炎性因子PGE2、IL-18、IL-6水平比较
与假手术组比较,模型组大鼠血清炎性因子PGE2、IL-18、IL-6水平明显升高(P<0.05);与模型组、右美托咪定+LRRC4 siRNA质粒组分别比较,右美托咪定组大鼠血清炎性因子PGE2、IL-18、IL-6水平降低(P<0.05),LRRC4 siRNA质粒组大鼠血清炎性因子PGE2、IL-18、IL-6水平均升高(P<0.05),空载质粒组大鼠血清炎性因子PGE2、IL-18、IL-6水平差异均无统计学意义(P>0.05)。详见表4。
2.4 各组大鼠脊髓组织SOD、GSH-Px、MDA水平比较
与假手术组比较,模型组大鼠脊髓组织抗氧化因子SOD、GSH-Px水平明显降低(P<0.05),氧化因子MDA水平明显升高(P<0.05)。与模型组、右美托咪定+LRRC4 siRNA质粒组分别比较,右美托咪定组大鼠脊髓组织抗氧化因子SOD、GSH-Px水平均升高(P<0.05),氧化因子MDA水平均降低(P<0.05);LRRC4 siRNA质粒组大鼠脊髓组织抗氧化因子SOD、GSH-Px水平均降低(P<0.05),氧化因子MDA水平均升高(P<0.05);空载质粒组大鼠脊髓组织SOD、GSH-Px、MDA水平差异均无统计学意义(P>0.05)。详见表5。
2.5 各组大鼠脊髓组织LRRC4、SDF-1及CXCR4 mRNA水平比较
与假手术组比较,模型组大鼠脊髓组织LRRC4 mRNA水平明显降低(P<0.05),SDF-1及CXCR4 mRNA水平明显升高(P<0.05)。与模型组、右美托咪定+LRRC4 siRNA质粒组分别比较,右美托咪定组大鼠脊髓组织LRRC4 mRNA水平均升高(P<0.05),SDF-1及CXCR4 mRNA水平降低(P<0.05);LRRC4 siRNA质粒组大鼠脊髓组织LRRC4 mRNA水平降低(P<0.05),SDF-1及CXCR4 mRNA水平均升高(P<0.05);空载质粒组大鼠脊髓组织LRRC4、SDF-1及CXCR4 mRNA水平差异均无统计学意义(P>0.05)。详见表6。
2.6 各组大鼠脊髓组织LRRC4、SDF-1及CXCR4蛋白表达水平比较
与假手术组比较,模型组大鼠脊髓组织LRRC4蛋白表达水平明显降低(P<0.05),SDF-1及CXCR4蛋白表达水平明显升高(P<0.05)。与模型组、右美托咪定+LRRC4 siRNA质粒组分别比较,右美托咪定组大鼠脊髓组织LRRC4蛋白表达水平均升高(P<0.05),SDF-1及CXCR4蛋白表达水平均降低(P<0.05);LRRC4 siRNA质粒组大鼠脊髓组织LRRC4蛋白表达水平均降低(P<0.05),SDF-1及CXCR4蛋白表达水平均升高(P<0.05);空载质粒组大鼠脊髓组织LRRC4、SDF-1及CXCR4蛋白表达水平差异均无统计学意义(P>0.05)。详见图1、表7。
3 讨 论
目前神经性疼痛的治疗药物包括阿片类镇痛药、抗癫痫及抗抑郁药,但长期应用存在药物成瘾风险,还会造成剥脱性皮炎、共济失调等,而神经性疼痛的患病人数众多,且趋向年轻化,给病人家庭及社会带来了沉重负担,因此,探寻更有效、安全的治疗策略是神经医学研究的热点和难点[1-2,13]。外周神经阻滞技术是临床手术时常用的局部麻醉方法,起到显著镇痛功效,在神经性疼痛的治疗中得到了广泛应用[3,14]。CCI模型是应用最广的神经性疼痛动物模型[15],本研究通过CCI诱发神经性疼痛,结果显示,造模大鼠血清炎性因子PGE2、IL-18和IL-6表达明显增强,脊髓组织抗氧化酶SOD、GSH-Px水平明显降低,引发严重炎症与氧化应激,导致坐骨神经损伤,使大鼠机械缩足阈值、热缩足潜伏期明显降低,造成痛觉超敏,表示模拟神经性疼痛病理过程的大鼠CCI模型建立成功。
免疫反应异常激活,造成促炎因子和抗炎因子表达失衡,引发的强烈炎症在神经性疼痛发病机制中起着至关重要的作用,抗炎治疗是减轻疼痛、改善神经性疼痛症状的有效策略[15-16]。右美托咪定作为临床常用的局部麻醉辅佐药剂,可有效增强罗哌卡因坐骨神经阻滞功效[17],还可抑制疼痛相关的炎症介质表达释放,减轻脊髓神经炎症[18],通过抗氧化作用缓解神经性疼痛大鼠痛觉超敏症状[12]。本研究通过留置管与坐骨神经旁给予右美托咪定,可明显降低血清炎性因子PGE2、IL-18和IL-6水平,减弱抗氧化酶SOD、GSH-Px活性,造成坐骨神经运动和感觉阻滞,升高大鼠机械缩足阈值,延长热缩足潜伏期,明显减轻大鼠疼痛症状,表明右美托咪定具有显著的镇痛作用,可广泛用于神经性疼痛的临床治疗。
SDF-1/CXCR4作为调控神经炎症的重要信号,在神经性疼痛致病机制中发挥着关键作用,鞘内注射CXCL12(SDF-1)中和抗体可抑制CXCR4表达,阻碍神经炎症发生发展[8],还可减轻脊神经结扎诱发的痛觉超敏反应,改善神经性疼痛大鼠疼痛症状[19]。LRRC4作为SDF-1/CXCR4信号的负调节因子[20],可作为治疗神经性疼痛的潜在作用靶点。本研究以LRRC4 siRNA质粒下调CCI大鼠LRRC4的表达,可上调SDF-1/CXCR4信号通路,促进炎性因子PGE2、IL-18和IL-6合成,进一步减弱抗氧化酶SOD、GSH-Px活性,加重大鼠疼痛症状,与右美托咪定合用,可拮抗其对炎症及氧化应激的抑制作用,降低其对坐骨神经阻滞持续时间,最终逆转右美托咪定对CCI大鼠的镇痛功能,表明右美托咪定缓解神经性疼痛痛觉超敏症状是通过上调LRRC4表达,从而激活SDF-1/CXCR4通路实现的。
总之,本研究表明右美托咪定可促进LRRC4表达,阻滞SDF-1/CXCR4信号途径传导,降低炎性因子表达水平,增强机体抗氧化能力,减轻脊髓神经炎症及氧化应激损伤,缓解CCI大鼠疼痛超敏反应,发挥明显的坐骨神经阻滞功效,调控LRRC4/SDF-1/CXCR4信号是右美托咪定起到上述镇痛作用的药理机制之一,本研究结果有利于神经性疼痛发病机制的明确阐述,并提供了新的神经性疼痛治疗靶点,对右美托咪定的临床推广做出了一定贡献。
参考文献:
[1] WANG H,HUO X,HAN C,et al.Ferroptosis is involved in the development of neuropathic pain and allodynia[J].Mol Cell Biochem,2021,476(8):3149-3161.
[2] 赵世享,孙圆圆,夏峰.带状疱疹病人血清NSE、T细胞亚群、炎性细胞因子变化与疼痛的相关性研究[J].蚌埠医学院学报,2021,46(9):1161-1163.
[3] NAJA Z,NAJA A S,RAJAB O,et al.Repetitive nerve block for neuropathic pain management:a case report[J].Scandinavian Journal of Pain,2018,18(1):125-127.
[4] 范俊,吕继鹏,顾凤香,等.右美托咪定应用于神经阻滞临床研究进展[J].中国疼痛医学杂志,2019,25(3):63-66.
[5] 吴秀霞,幸芳,卢锡华.脊髓Rac1信号通路在右美托咪定减轻大鼠神经病理性痛中的作用[J].中华麻醉学杂志,2020,40(9):1101-1104.
[6] BRIFAULT C,KWON H,CAMPANA W M,et al.LRP1 deficiency in microglia blocks neuro-inflammation in the spinal dorsal horn and neuropathic pain processing[J].Glia,2019,67(6):1210-1224.
[7] KHAN A,KHAN A,KHALID S,et al. 7β-(3-ethyl-cis-crotonoyloxy)-1α-(2-methylbutyryloxy)-3,14-dehydro-Z notonipetranone attenuates neuropathic pain by suppressing oxidative stress,inflammatory and pro-apoptotic protein expressions[J].Molecules,2021,26(1):181.
[8] MAI C L,TAN Z,XU Y N,et al.CXCL12-mediated monocyte transmigration into brain perivascular space leads to neuroinflammation and memory deficit in neuropathic pain[J].Theranostics,2021,11(3):1059-1078.
[9] DA SILVA JUNIOR C A,DE CASTRO JUNIOR C J,PEREIRA E M R,et al.The inhibitory effect of Phα1β toxin on diabetic neuropathic pain involves the CXCR4 chemokine receptor[J].Pharmacological Reports,2020,72(1):47-54.
[10] PIAO J M,WU W,YANG Z X,et al.MicroRNA-381 favors repair of nerve injury through regulation of the SDF-1/CXCR4 signaling pathway via LRRC4 in acute cerebral ischemia after cerebral lymphatic blockage[J].Cellular Physiology and Biochemistry,2018,46(3):890-906.
[11] 于恺,邹佳芮,于东海,等.舒芬太尼对神经性疼痛大鼠的神经阻滞作用及对Nrf-2/HO-1信号通路的影响[J].解剖科学进展,2021,27(1):79-82.
[12] 于东海,张振,赵博,等.右美托咪定激活Nrf2/HO-1信号通路抑制氧化应激缓解大鼠神经病理性疼痛[J].解剖科学进展,2021,27(2):169-173.
[13] FINNERUP N B,KUNER R,JENSEN T S.Neuropathic pain:from mechanisms to treatment[J].Physiological Reviews,2021,101(1):259-301.
[14] SELAME L A,MCFADDEN K,DUGGAN N M,et al.Ultrasound-guided transgluteal sciatic nerve block for gluteal procedural analgesia[J].The Journal of Emergency Medicine,2021,60(4):512-516.
[15] LI P,YU C,ZENG F S,et al.Licochalcone A attenuates chronic neuropathic pain in rats by inhibiting microglia activation and inflammation[J].Neurochemical Research,2021,46(5):1112-1118.
[16] SAKHAEE M H,SAYYADI S A H,SAKHAEE N,et al.Cedrol protects against chronic constriction injury-induced neuropathic pain through inhibiting oxidative stress and inflammation[J].Metabolic Brain Disease,2020,35(7):1119-1126.
[17] 王晓娜,王志学,刘冲,等.右美托咪定混合地塞米松对足踝手术患者罗哌卡因腘窝坐骨神经阻滞效果的影响[J].中华麻醉学杂志,2020,40(5):600-602.
[18] 夏黎,林欣,孙岩,等.右美托咪定对甲醛致疼痛小鼠炎症介质释放的干预研究[J].中华危重症医学杂志(电子版),2020,13(2):118-123.
[19] LIU Z Y,SONG Z W,GUO S W,et al.CXCL12/CXCR4 signaling contributes to neuropathic pain via central sensitization mechanisms in a rat spinal nerve ligation model[J].CNS Neuroscience & Therapeutics,2019,25(9):922-936.
[20] XUE Y,XU T,JIANG W.Dexmedetomidine protects PC12 cells from ropivacaine injury through miR-381/LRRC4/SDF-1/CXCR4 signaling pathway[J].Regenerative Therapy,2020,14:322-329.
(收稿日期:2022-08-16)
(本文编辑王丽)