lncRNA NEAT1调节miR-424-5p/ELK4轴对ox-LDL诱导的血管内皮细胞损伤、Lp-PLA2和CRP水平的影响
2024-04-29陈光远,边毓尧,王秀艳
陈光远,边毓尧,王秀艳


摘要 目的:探讨长链非编码RNA核旁斑组装转录本1(lncRNA NEAT1)在氧化型低密度脂蛋白(ox-LDL)诱导的血管内皮细胞损伤中的分子机制和功能。方法:收集健康人和动脉粥样硬化(AS)病人血液标本并通过实时荧光定量逆转录聚合酶链式反应(qRT-PCR)检测血清中lncRNA NEAT1、微小RNA-424-5p(miR-424-5p)和ETS域蛋白4(ELK4)mRNA表达水平。体外培养人脐静脉内皮细胞(HUVEC),qRT-PCR和蛋白免疫印迹法(Western Blot)检测细胞中lncRNA NEAT1、miR-424-5p和ELK4表达情况;细胞计数试剂盒(CCK-8)法和膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)法检测HUVEC细胞增殖活力和凋亡情况;酶联免疫吸附法(ELISA)测定HUVEC中乳酸脱氢酶(LDH)释放量、肿瘤坏死因子-α(TNF-α)和白细胞介素(IL)-1β含量、脂蛋白磷脂酶A2(Lp-PLA2)和C反应蛋白(CRP)水平;采用双荧光素酶报告基因测定lncRNA NEAT1、miR-424-5p和ELK4之间的靶向相互作用。进行动物实验以评估lncRNA NEAT1在体内AS进展中的作用。结果:lncRNA NEAT1在AS病人血清和ox-LDL诱导的HUVEC中显著上调(P<0.05)。lncRNA NEAT1的沉默可削弱ox-LDL引发的细胞毒性,降低Lp-PLA2和CRP水平,并减少ApoE-/-小鼠的脂质异常分泌(P<0.05)。miR-424-5p是lncRNA NEAT1在调节ox-LDL诱导的HUVEC损伤中的功能介质,ELK4是miR-424-5p的直接靶标(P<0.05)。miR-424-5p的抑制或ELK4的过表达逆转了lncRNA NEAT1沉默对ox-LDL诱导的HUVEC细胞损伤的影响(P<0.05)。结论:沉默lncRNA NEAT1可通过调控miR-424-5p/ELK4轴保护HUVEC免受ox-LDL触发的细胞毒性,降低Lp-PLA2和CRP水平。
关键词动脉粥样硬化;长链非编码RNA核旁斑组装转录本1,lncRNA NEAT1;氧化型低密度脂蛋白;微小RNA-424-5p;ETS域蛋白4;实验研究
doi:10.12102/j.issn.1672-1349.2024.04.012
Effect of lncRNA NEAT1 on ox-LDL-induced Vascular Endothelial Cell Injury, Lp-PLA2 and CRP Levels by Regulating miR-424-5p/ELK4 Axis
CHEN Guangyuan, BIAN Yuyao, WANG Xiuyan
Inner Mongolia People′s Hospital, Hohhot 010017, Inner Mongolia, China
Corresponding AuthorBIAN Yuyao, E-mail: 55029360@qq.com
AbstractObjective:To investigate the molecular mechanism and function of long non-coding RNA nuclear paraspeckle assembly transcript 1(lncRNA NEAT1) in oxidative low-density lipoprotein(ox-LDL)-induced vascular endothelial cell injury.Methods:Blood samples of healthy people and atherosclerosis(AS) patients were collected and serum lncRNA NEAT1,micrornA-424-5p(miR-424-5p) and ETS domain protein 4(ELK4) mRNA expression levels were detected by real-time fluorescent quantitative reverse transcription polymerase chain reaction(qRT-PCR).Human umbilical vein endothelial cells(HUVEC) were cultured in vitro,and the expressions of lncRNA NEAT1,miR-424-5p and ELK4 were detected by qRT-PCR and Western Blot.Cell counting kit(CCK-8) and Annexin V-FITC/PI method were used to detect the proliferation and apoptosis of HUVEC cells.Lactate dehydrogenase(LDH) release,tumor necrosis factor-α(TNF-α) and interleukin-1β contents,lipoprotein phospholipase A2(Lp-PLA2) and C-reactive protein(CRP) levels in HUVEC were determined by enzyme-linked immunosorbent assay(ELISA).Targeting interactions between lncRNA NEAT1,miR-424-5p and ELK4 were determined by dual luciferase reporter genes.Animal experiments were performed to evaluate the role of lncRNA NEAT1 in the progression of AS in vivo.Results:lncRNA NEAT1 was significantly up-regulated in AS patients' serum and ox-LDL-induced HUVECs(P<0.05).Silencing of lncRNA NEAT1 attenuated ox-LDL-induced cytotoxicity,reduced Lp-PLA2 and CRP levels,and reduced abnormal lipid secretion in ApoE-/- mice(P<0.05).miR-424-5p mediated lncRNA NEAT1 in regulating ox-LDL-induced HUVEC injury,and ELK4 was the direct target of miR-424-5p(P<0.05).Inhibition of miR-424-5p or overexpression of ELK4 reversed the effect of lncRNA NEAT1 silencing on ox-LDL-induced HUVEC cell damage(P<0.05).Conclusion:Silencing lncRNA NEAT1 protects HUVEC from ox-LDL-triggered cytotoxicity and reduces Lp-PLA2 and CRP levels,in part by regulating the miR-424-5p/ELK4 axis.
Keywordsatherosclerosis; long non-coding RNA nuclear paraspeckle assembly transcript 1, lncRNA NEAT1; oxidative low-density lipoprotein; microRNA-424-5p; ETS-domain protein 4; experimental study
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症性疾病[1]。内皮细胞功能障碍在AS的进展中起重要作用[2]。氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)通过多种机制促进AS的发生和发展,包括诱导内皮细胞功能障碍[3]。因此,了解ox-LDL如何驱动内皮细胞损伤对于开发抑制AS进展的有效方法至关重要。因此,本研究选择ox-LDL诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)作为AS细胞模型研究AS的调节机制。
长链非编码RNA(long non-coding RNA,lncRNA)是AS和其他复杂疾病的主要调节剂,其可调节炎症反应、脂质代谢等多方面功能[4],如下调lncRNA微小染色体维持蛋白3相关蛋白反义链1(MCM3AP-AS1)可明显抑制AS的发展[5]。lncRNA核旁斑组装转录本1(nuclear paraspeckle assembly transcript 1,lncRNA NEAT1)已被证实是细胞分化和生长中的关键基因[6]。研究显示,lncRNA NEAT1与ox-LDL介导的内皮细胞AS进展有关[7]。尽管部分lncRNA NEAT1调控网络已在AS发病机制中得到强调,如lncRNA NEAT1/微小RNA-30c-5p/转录因子7网络[8],但目前对lncRNA NEAT1的分子基础的理解仍然有限。miRNA通过沉默靶基因成为AS发病机制中的重要调节因子[9]。微小RNA-424-5p(microRNA-424-5p,miR-424-5p)是AS中低表达的miRNA,研究显示,miR-424-5p在AS动物模型中发挥潜在的抗AS活性[10]。当通过生物信息学分析来识别lncRNA NEAT1的分子基础时,在lncRNA NEAT1、miR-424-5p和ETS域蛋白4(ETS-domain protein4,ELK4)之间发现了结合序列。基于以上原因,本研究探讨lncRNA/miRNA/mRNA调控网络在ox-LDL触发的HUVEC损伤中的作用。
1材料与方法
1.1血清样本
采集于内蒙古自治区人民医院体检中心进行检查的30名健康人和30例AS病人的血液样本。静置过夜后提取血清,储存于-20 ℃用于提取总RNA。两组受试者的基线资料(性别、年龄等)比较,差异无统计学意义(P>0.05)。本研究获得内蒙古自治区人民医院伦理委员会批准,所有受试者均签署知情同意书。
1.2细胞与主要试剂
HUVEC(PCS-100-013)购自美国ATCC公司,ox-LDL(jk-002b)购自上海经科公司;TRIzol(9108-1)、SYBR Green I试剂盒(RR091A)均购自日本Takara公司;FastQuant RT试剂(KR106-02)购自北京天根公司;lncRNA NEAT1的si-RNA(si-lncRNA NEAT1)及其阴性对照(si-NC)、miR-424-5p抑制剂(in-miR-424-5p)与ELK4过表达(oe-ELK4)以及miR-424-5p模拟物(miR-424-5p)与其阴性对照(miR-NC)均购自广东Ribobio公司;Lipofectamine 3000(L3000-015)购自美国Invitrogen公司;RIPA缓冲液(89900)和增强化学发光法(ECL)检测试剂盒(32109)均购自美国Pierce公司;一抗ELK4(ab86002)和β-actin(ab8227)购自英国Abcam公司;pMIRGLO荧光素酶载体(E1330)、双荧光素酶检测试剂盒(E2610)均购自美国Promega公司;细胞计数试剂盒(CCK-8)(CK04)购自日本同仁公司;膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)试剂盒(70-APCC101)购自杭州MultiSciences公司;乳酸脱氢酶(LDH)酶联免疫吸附法(ELISA)试剂盒(EK-H11454)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(EK-H12145)和白细胞介素(IL)-1β ELISA试剂盒(EK-H10327)均购自上海EK-Bioscience公司;脂蛋白磷脂酶A2(Lp-PLA2)ELISA试剂盒(HAS-54960)购自深圳海思安生物技术公司;C反应蛋白(CRP)ELISA试剂盒(SHR10172)购自南京赛泓瑞生物公司;含有lncRNA NEAT1的shRNA(sh-lncRNA NEAT1)或乱序shRNA(sh-RNA)的慢病毒构建体购自上海Genomeditech公司;三酰甘油(TG)试剂盒(F001-1-1)、总胆固醇(TC)试剂盒(F002-1-1)和低密度脂蛋白胆固醇(LDL-C)试剂盒(A113-2-1)均购自南京建成生物工程研究所。
1.3方法
1.3.1细胞培养与ox-LDL处理
在37 ℃和5% CO2环境下,HUVEC在含有10%胎牛血清和1%抗生素的PRMI-1640培养基中生长。同时,将购买的ox-LDL稀释至不同的浓度梯度,将HUVEC与0、25、50、100 μg/mL的ox-LDL[11]孵育24 h,在不同时间点(0、12、24和48 h)以50 μg/mL浓度孵育,使用实时荧光定量逆转录聚合酶链式反应(qRT-PCR)测定评估HUVEC中lncRNA NEAT1表达水平。
1.3.2细胞转染
HUVEC细胞分为Control组(不做处理)、ox-LDL组(ox-LDL处理)、si-NC组(转染si-NC后ox-LDL处理)、si-lncRNA NEAT1组(转染si-lncRNA NEAT1后ox-LDL处理)、si-lncRNA NEAT1+in-miR-424-5p组(转染si-lncRNA NEAT1和in-miR-424-5p后ox-LDL处理)和si-lncRNA NEAT1+oe-ELK4组(转染si-lncRNA NEAT1和oe-ELK4后ox-LDL处理)。使用Lipofectamine 3000试剂瞬时转染对应组HUVEC,24 h后用100 mg/mL的ox-LDL处理24 h,收集细胞用于后续实验。qRT-PCR和蛋白免疫印迹法(Western Blot)检测转染效率。
1.3.3qRT-PCR反应
使用TRIzol从血清样品或细胞中获取总RNA,通过FastQuant RT试剂转录形成cDNA,在ABI 7500荧光定量聚合酶链式反应(PCR)系统(美国Applied Biosystems)上使用SYBR Green进行qRT-PCR反应。所有的数据均标准化为U6或GAPDH。目的基因的相对表达量采用2-ΔΔCt法计算。qRT-PCR的主要引物序列如下:lncRNA NEAT1正向为5′-TGTCCCTCGGCTATGTCAGA,lncRNA NEAT1反向为5′-GAGGGGACGTGTTTCCTGAG-3′;miR-424-5p正向为5′-GCGGCCAGCAGCAATTCATG-3′,miR-424-5p反向为5′-CAGCCACAAAAGAGCACAAT-3′;ELK4正向为5′-GGGTTAGAACTGGCACCCAC-3′, ELK4反向为5′-GCTGGACTTAGGGGAGCAAC-3′;U6正向为5′-GCTTCGGCAGCACATATACTAAAAT-3′,U6反向为 5′-CGCTTCACGAATTTGCGTGTCAT-3′;GAPDH正向为5′-TGACCACAGTCCATGCCATCAC-3′,GAPDH反向为5′-GCCTGCTTCACCACCTTCTTGA-3′。
1.3.4Western Blot检测
将按照1.3.3方法培养的各组HUVEC通过RIPA缓冲液裂解提取总蛋白。蛋白质定量变性后通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并将蛋白质转移到聚偏二氟乙烯膜(PVDF)上。在4 ℃下,添加一抗ELK4和β-actin(1∶1 000)过夜孵育,然后加入二抗。最后,通过ECL检测试剂盒检测信号。
1.3.5CCK-8检测
收集按照1.3.3方法培养的HUVEC,向每孔中加入10 mL CCK-8试剂并于37 ℃下孵育4 h进行细胞活力测定。使用酶标仪检测光密度值。细胞活力与450 nm处的光密度值成正比。
1.3.6Annexin V/PI双染法
收集按照1.3.3方法培养的HUVEC,通过用5 mL FITC标记的Annexin V和2 mL PI双染法进行细胞凋亡测定。使用FACScan流式细胞仪(英国BD Biosciences)对凋亡率进行分析。
1.3.7ELISA检测
收集按照1.3.3方法培养的HUVEC上清液,根据供应商的方案使用对应的试剂盒分析收集细胞培养上清液中LDH释放量、TNF-α和IL-1β含量、Lp-PLA2和CRP水平。最后检测405 nm处的吸光度,并根据标准曲线方程进行计算。
1.3.8双荧光素酶报告基因检测
通过StarBase预测lncRNA NEAT1和miR-424-5p的结合位点,使用TargetScan搜索miR-424-5p的潜在靶标ELK4。构建野生型或突变型lncRNA NEAT1(WT-lncRNA NEAT1或MT-lncRNA NEAT1)和ELK4-3′-UTR(WT-ELK4或MT-ELK4)片段,并将其插入到pMIRGLO荧光素酶载体中。使用Lipofectamine 3000将上述质粒与miR-424-5p或miR-NC共转染至ox-LDL处理的HUVEC。然后,通过双荧光素酶检测试剂盒检测荧光素酶活性。
1.3.9动物实验
用pMD2.G和psPAX2将慢病毒构建体(sh-lncRNA NEAT1或sh-RNA)单独转染到293T细胞中以产生病毒颗粒。用无菌过滤器纯化含病毒的悬浮液,并储存于-80 ℃以进行进一步实验。雄性8周龄ApoE-/-小鼠18只和野生型C57BL/6J小鼠6只购自北京Vital River公司,许可证号SCXK(京)2021-0011。所有小鼠均饲养在无特定病原体的生物医学研究所饲养动物所设置的环境中。ApoE-/-小鼠喂食高脂肪饮食(15.8%脂肪和1.25%胆固醇),野生型C57BL/6J小鼠喂食正常食物。在第6周,ApoE-/-小鼠被随机分为Control组、sh-NC组和sh-lncRNA NEAT1组,每组6只。sh-NC组和sh-lncRNA NEAT1组小鼠每周尾静脉注射慢病毒颗粒(50 mL),Control组注射等量的PBS,连续注射4周。实验结束时,采集血液样本,并收集血清样本用于进一步分析。lncRNA NEAT1、miR-424-5p和ELK4 mRNA的表达水平通过qRT-PCR进行测量。根据制造商说明,使用市售试剂盒检测TG、TC和LDL-C水平。
1.4统计学处理
采用SPSS 25.0软件进行数据分析。符合正态分布的定量资料以均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析和SNK-q检验。以P<0.05为差异有统计学意义。
2结果
2.1lncRNA NEAT1在AS病人血清和ox-LDL处理HUVEC中的过表达
与健康人血清lncRNA NEAT1(1.05±0.38)比较,AS病人(3.64±0.96)升高(P<0.05)。此外,ox-LDL刺激导致HUVEC中lncRNA NEAT1的表达以剂量和时间依赖性方式上调(P<0.05)。详见表1、表2。因此,采用100 μg/mL的ox-LDL浓度处理24 h的HUVEC细胞进行进一步的实验。
2.2沉默lncRNA NEAT1可减轻ox-LDL引发的HUVEC损伤
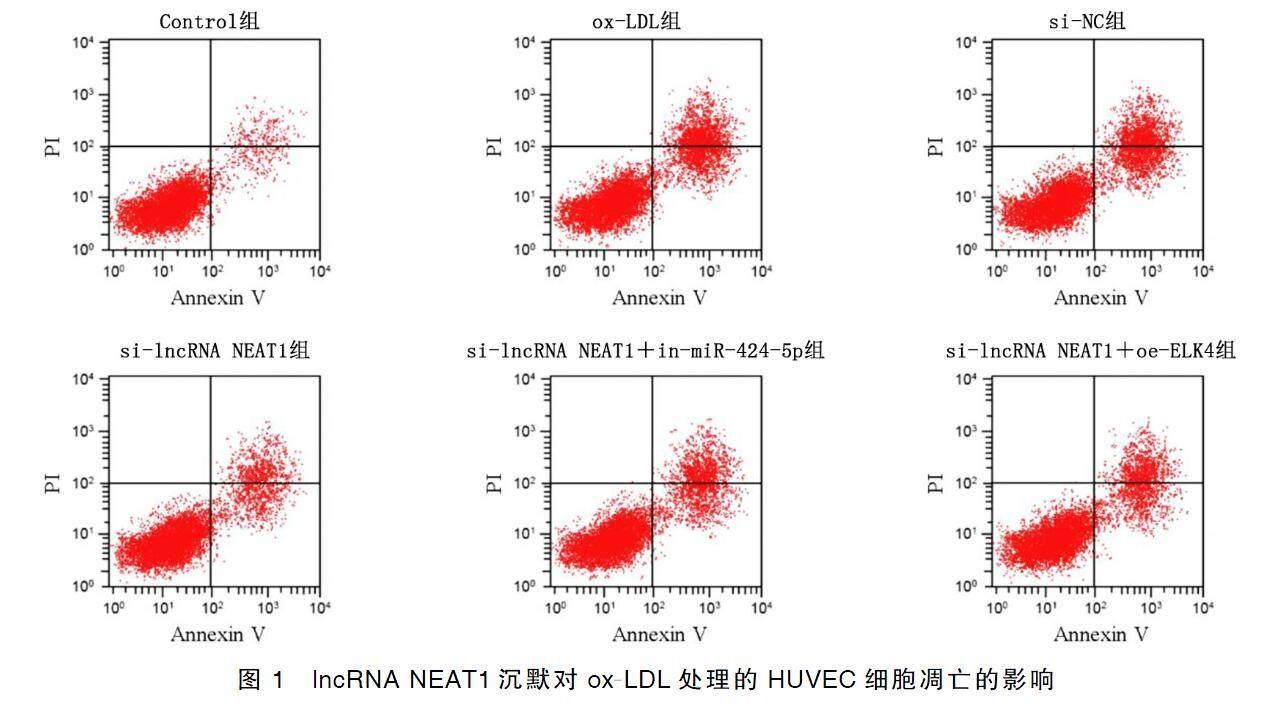
与Control组比较,ox-LDL组HUVEC细胞中lncRNA NEAT1和ELK4水平均明显升高,miR-424-5p水平降低(P<0.05);HUVEC细胞增殖活力下调,细胞凋亡率上调(P<0.05)。与si-NC组比较,si-lncRNA NEAT组HUVEC细胞中lncRNA NEAT1和ELK4水平均明显降低,miR-424-5p水平明显升高(P<0.05);HUVEC细胞增殖活力上调,细胞凋亡率下调(P<0.05)。与si-lncRNA NEAT1组比较,si-lncRNA NEAT1+in-miR-424-5p组或si-lncRNA NEAT1+oe-ELK4组ELK4水平升高(P<0.05);HUVEC细胞增殖活力下调,细胞凋亡率上调(P<0.05)。详见表3及图1、图2。此外,对健康人和AS病人血清中miR-424-5p和ELK4 mRNA水平检测发现,与健康人比较,AS病人血清中miR-424-5p水平降低(0.39±0.12与1.04±0.36,P<0.05),ELK4 mRNA水平升高(1.95±0.68与1.01±0.40,P<0.05)。
2.3沉默lncRNA NEAT1可减轻ox-LDL引发的HUVEC中炎性因子和Lp-PLA2、CRP的水平
与Control组比较,ox-LDL组HUVEC细胞上清液中LDH释放量、TNF-α和IL-1β含量、Lp-PLA2和CRP水平均明显升高(P<0.05)。与si-NC组比较,si-lncRNA NEAT组HUVEC细胞上清液中LDH释放量、TNF-α和IL-1β含量、Lp-PLA2和CRP水平均明显降低(P<0.05)。与si-lncRNA NEAT1组比较,si-lncRNA NEAT1+in-miR-424-5p组和si-lncRNA NEAT1+oe-ELK4组HUVEC细胞上清液中LDH释放量、TNF-α和IL-1β含量、Lp-PLA2和CRP水平均明显升高(P<0.05)。详见表4。
2.4lncRNA NEAT1在HUVEC细胞中的作用机制分析
使用基于网络的生物信息资源“starBase”和“TragerScan”预测miR-424-5p与lncRNA NEAT1或ELK4之间的结合位点。双荧光素酶报告基因检测结果显示,与miR-NC组比较,miR-424-5p组HUVEC共转染WT-lncRNA NEAT1或WT-ELK4可明显降低荧光素酶相对活性(P<0.05),而共转染MT-lncRNA NEAT1或MT-ELK4则对荧光素酶活性无明显影响(P>0.05)。详见图3、表5。
2.5沉默lncRNA NEAT1降低ApoE-/-小鼠血脂水平
与野生型C57BL/6J小鼠比较,喂食高脂饮食的ApoE-/-小鼠血清样本中lncRNA NEAT1水平明显上调(2.54±0.25与1.03±0.08,P<0.05),miR-424-5p表达下调(0.36±0.04与1.03±0.05,P<0.05),ELK4 mRNA水平上调(1.87±0.12与1.01±0.05,P<0.05)。值得注意的是,sh-lncRNA NEAT1转染导致血清样本中lncRNA NEAT1水平下降,更重要的是lncRNA NEAT1的表达降低显著降低了喂食高脂饮食的ApoE-/-小鼠血清样本中TG、TC和LDL-C水平(P<0.05)。此外,lncRNA NEAT1的表达降低导致血清样本中miR-424-5p表达增加和ELK4 mRNA表达降低(P<0.05)。详见表6。
3讨论
脂代谢紊乱是AS病变的基础[12]。ox-LDL介导的内皮细胞损伤是AS发生和进展的关键因素。AS是一种炎症性疾病,是导致冠心病、脑梗死和外周血管疾病的主要原因,这些疾病是当今世界疾病死亡的主要原因[1]。因此,研究ox-LDL诱导的内皮细胞损伤的机制至关重要。研究表明,在AS发病过程中存在多种lncRNA介导的机制,特别是lncRNA/miRNA/mRNA网络[8]。
本研究结果显示,lncRNA NEAT1在AS病人血清和ox-LDL刺激的HUVEC中过表达,与之前的研究结果一致[7-8]。在肺腺癌等多种癌症中lncRNA NEAT1高表达[13]。此外,lncRNA NEAT1通过paraspeckle形成参与调节巨噬细胞中ox-LDL引发的炎症和脂质摄取[14];且阻断lncRNA NEAT1通过调节人巨噬细胞中miR-342-3p抑制炎症反应和脂质摄入[15]。结合以上研究,推测沉默lncRNA NEAT1可保护HUVEC免受ox-LDL诱导损伤。另外,Lp-PLA2与临床上的几种心血管风险标志物和心血管事件密切相关,且Lp-PLA2在ox-LDL暴露的HUVEC中被诱导表达[16];CRP是炎症和血栓形成之间的重要机制联系,增加CRP表达可增强对血管损伤的血栓形成反应[17]。结合本研究结果得出,沉默lncRNA NEAT1保护HUVEC免受ox-LDL诱导的细胞毒性。ApoE-/-小鼠是发生高胆固醇血症和AS的经典动物模型,血清中TC、TG和LDL-C水平异常升高是AS脂质紊乱的特征之一。本研究发现,沉默lncRNA NEAT1可减轻脂质紊乱,抑制ApoE-/-小鼠的AS进展。本研究还证明了lncRNA NEAT1与miR-424-5p存在靶向调控关系。miR-424-5p是宫颈癌等人类癌症的关键调节剂[18]。此外,miR-424-5p还与骨性关节炎[19]、缺血性脑卒中[20]等疾病发展有关。本研究结果表明,miR-424-5p在AS病人血清中低表达,表明其表达可能与AS有关。进一步结果显示,抑制miR-424-5p可部分逆转lncRNA NEAT1沉默对ox-LDL诱导的HUVEC损伤的缓解作用。随后,将ELK4鉴定为HUVEC中miR-424-5p的直接靶标。ELK4是Ets转录因子家族的成员,已有多项研究表明,ELK4在许多癌症中起关键作用[21]。本研究结果显示,ELK4在AS病人血清中高度表达,与之前的研究相似,且研究指出miR-3188通过直接靶向上调ELK4促进AS恶性进展[22]。本研究结果显示,沉默lncRNA NEAT1可作为miR-424-5p海绵在ox-LDL诱导的HUVEC中下调ELK4的表达。且进一步研究结果证实,ELK4过表达可部分逆转lncRNA NEAT1沉默对ox-LDL诱导的HUVEC损伤的保护作用。结合以上结果得出,沉默lncRNA NEAT1通过影响ox-LDL诱导的HUVEC中miR-424-5p的表达调节ELK4的表达。
综上所述,本研究在ox-LDL诱导的HUVEC功能障碍中发现了一个新的调控网络,即lncRNA NEAT1/miR-424-5p/ELK4轴。本研究证据表明,lncRNA NEAT1是AS中显著过表达的lncRNA,通过靶向miR-424-5p/ELK4轴调节ox-LDL触发的HUVEC损伤,突出了AS管理有希望的分子靶点。深入探究lncRNA NEAT1/miR-424-5p/ELK4信号传导是否影响与内皮细胞损伤相关的某些通路的激活将是进一步研究的主题。
参考文献:
[1]CHEN Z H,YANG M H,WEN Y H,et al.Prediction of atherosclerosis using machine learning based on operations research[J].Mathematical Biosciences and Engineering,2022,19(5):4892-4910.
[2]张辉,赵东升,王云豹.增强型体外反搏通过调节endocan-1和vaspin水平改善血管内皮功能障碍[J].中国动脉硬化杂志,2022,30(2):141-146.
[3]GAO H M,GUO Z H.LncRNA XIST regulates atherosclerosis progression in ox-LDL-induced HUVECs[J].Open Medicine,2021,16(1):117-127.
[4]REN K,XU X D,YU X H,et al.LncRNA-modulated autophagy in plaque cells:a new paradigm of gene regulation in atherosclerosis?[J].Aging,2020,12(21):22335-22349.
[5]张维新,刘红,石志坚,等.下调lncRNA MCM3AP-AS1通过调控miR-205-5p/NEGR1轴抑制动脉粥样硬化的机制[J].中国老年学杂志,2022,42(3):687-693.
[6]TAIANA E,RONCHETTI D,TODOERTI K,et al.LncRNA NEAT1 in paraspeckles:a structural scaffold for cellular DNA damage response systems?[J].Non-Coding RNA,2020,6(3):26.
[7]ZHANG X,GUAN M X,JIANG Q H,et al.NEAT1 knockdown suppresses endothelial cell proliferation and induces apoptosis by regulating miR-638/AKT/mTOR signaling in atherosclerosis[J].Oncology Reports,2020,44(1):115-125.
[8]GUO J T,WANG L,YU H B.Knockdown of NEAT1 mitigates ox-LDL-induced injury in human umbilical vein endothelial cells via miR-30c-5p/TCF7 axis[J].European Review for Medical and Pharmacological Sciences,2020,24(18):9633-9644.
[9]秦合伟,张勤生,李彦杰,等.黄芪甲苷调控miR-17-5p与PCSK9/VLDLR信号通路抗动脉粥样硬化的分子机制研究[J].中国中药杂志,2022,47(2):492-498.
[10]LI C F,ZHANG M,DAI Y C,et al.MicroRNA-424-5p regulates aortic smooth muscle cell function in atherosclerosis by blocking APOC3-mediated nuclear factor-κB signalling pathway[J].Experimental Physiology,2020,105(6):1035-1049.
[11]LU Y,XI J,ZHANG Y,et al.SNHG1 inhibits ox-LDL-induced inflammatory response and apoptosis of HUVECs via up-regulating GNAI2 and PCBP1[J].Frontiers in Pharmacology,2020,11:703.
[12]周艳,高洁,柴艺汇,等.基于“心与小肠相表里” 理论的肠道菌群对动脉粥样硬化性心血管疾病的影响探讨[J].时珍国医国药,2021,32(1):154-156.
[13]刘天旭,王梦杰,田聪,等.lncRNA NEAT1通过抑制DNA损伤促进肺腺癌PC-9细胞的增殖[J].中国肿瘤生物治疗杂志,2019,26(8):845-849.
[14]HUANG-FU N,CHENG J S,WANG Y,et al.Neat1 regulates oxidized low-density lipoprotein-induced inflammation and lipid uptake in macrophages via paraspeckle formation[J].Molecular Medicine Reports,2018,17(2):3092-3098.
[15]WANG L,XIA J W,KE Z P,et al.Blockade of NEAT1 represses inflammation response and lipid uptake via modulating miR-342-3p in human macrophages THP-1 cells[J].Journal of Cellular Physiology,2019,234(4):5319-5326.
[16]OU M H,HAO S B,CHEN J,et al.Downregulation of interleukin-6 and C-reactive protein underlies a novel inhibitory role of microRNA-136-5p in acute lower extremity deep vein thrombosis[J].Aging,2020,12(21):21076-21090.
[17]FRANSN K,PETTERSSON C,HURTIG-WENNLF A.CRP levels are significantly associated with CRP genotype and estrogen use in the Lifestyle,Biomarker and Atherosclerosis (LBA) study[J].BMC Cardiovascular Disorders,2022,22(1):170.
[18]王佳佳,丁佳,常永霞,等.hsa-miRNA-424-5p靶向GPR30对宫颈癌恶性生物学行为的影响[J].山东医药,2021,61(28):42-46.
[19]符传恭,陆志夫,宋世锋,等.MiR-424-5p靶向PHD2对骨性关节炎软骨细胞凋亡及炎症因子分泌的影响[J].郑州大学学报(医学版),2021,56(1):1-5.
[20]XIANG Y X,ZHANG Y Y,XIA Y N,et al.LncRNA MEG3 targeting miR-424-5p via MAPK signaling pathway mediates neuronal apoptosis in ischemic stroke[J].Aging,2020,12(4):3156-3174.
[21]ZHENG L,XU H M,DI Y,et al.ELK4 promotes the development of gastric cancer by inducing M2 polarization of macrophages through regulation of the KDM5A-PJA2-KSR1 axis[J].Journal of Translational Medicine,2021,19(1):342.
[22]LI N,CHEN J H,ZHAO J R,et al.MicroRNA-3188 targets ETS-domain protein 4 and participates in RhoA/ROCK pathway to regulate the development of atherosclerosis[J].Die Pharmazie,2017,72(11):687-693.
(收稿日期:2022-06-01)
(本文编辑邹丽)