茯苓酸通过调节Nrf2/SLC7A11/GPX4信号通路抑制氧糖剥夺/复氧诱导的心肌细胞铁死亡
2024-04-29王飞飞陈伯艳李琼
王飞飞 陈伯艳 李琼
摘要 目的:探究茯苓酸通过调节核因子E2相关因子2(Nrf2)/溶质载体家族7成员11(SLC7A11)/谷胱甘肽过氧化物酶4(GPX4)信号通路抑制氧糖剥夺/复氧(OGD/R)诱导的心肌细胞铁死亡的机制。方法:体外培养大鼠心肌细胞H9c2,诱导建立细胞OGD/R模型后以0、1.0、2.5、5.0、10.0、20.0 μmol/L茯苓酸处理24 h,通过细胞计数试剂盒-8(CCK-8)法检测各处理组细胞活力后筛选出合适的茯苓酸作用浓度。将H9c2细胞随机分为对照组、模型组、茯苓酸组、ML385组(Nrf2抑制剂组)、茯苓酸+ML385组,除对照组外其余各组建立细胞OGD/R模型后以茯苓酸、ML385分组处理,采用CCK-8法与流式细胞实验分别检测各组H9c2细胞活力、凋亡率;采用试剂盒检测各组H9c2细胞培养基上清中乳酸脱氢酶(LDH)、促炎因子[前列腺素E2(PGE2)、肿瘤坏死因子-α(TNF-α)]、抗炎因子白细胞介素(IL)-10水平及细胞抗氧化因子[过氧化氢酶(CAT)、谷胱甘肽(GSH)]、铁死亡相关指标[铁含量、丙二醛(MDA)]水平;采用免疫印迹实验检测各组H9c2细胞凋亡及Nrf2/SLC7A11/GPX4信号通路相关蛋白表达。结果:与对照组比较,模型组细胞凋亡率、LDH释放量、细胞培养基上清中PGE2及TNF-α水平、细胞铁含量、MDA水平及Bax、Caspase-3蛋白表达均升高(P<0.05),细胞活力、细胞培养基上清中IL-10水平、细胞CAT及GSH水平、Bcl-2及Nrf2、SLC7A11、GPX4蛋白表达降低(P<0.05)。与模型组比较,茯苓酸组细胞凋亡率、LDH释放量、细胞培养基上清中PGE2及TNF-α水平、细胞铁含量、MDA水平及Bax、Caspase-3蛋白表达均降低(P<0.05),细胞活力、细胞培养基上清中IL-10水平、细胞CAT及GSH水平、Bcl-2及Nrf2、SLC7A11、GPX4蛋白表达升高(P<0.05);ML385组细胞凋亡率、LDH释放量、细胞培养基上清中PGE2及TNF-α水平、细胞铁含量、MDA水平及Bax、Caspase-3蛋白表达均升高(P<0.05),细胞活力、细胞培养基上清中IL-10水平、细胞CAT及GSH水平、Bcl-2及Nrf2、SLC7A11、GPX4蛋白表达降低(P<0.05)。与茯苓酸组比较,茯苓酸+ML385组细胞凋亡率、LDH释放量、细胞培养基上清中PGE2及TNF-α水平、细胞铁含量、MDA水平及Bax、Caspase-3蛋白表达均升高(P<0.05),细胞活力、细胞培养基上清中IL-10水平、细胞CAT及GSH水平、Bcl-2及Nrf2、SLC7A11、GPX4蛋白表达降低(P<0.05)。结论:茯苓酸可通过激活Nrf2/SLC7A11/GPX4信号而抑制OGD/R诱导的心肌细胞炎症、脂质过氧化与铁死亡,增强其抗氧化活性及细胞活力,最终减轻其细胞凋亡损伤。
关键词 氧糖剥夺/复氧;心肌细胞;茯苓酸;核因子E2相关因子2/溶质载体家族7成员11/谷胱甘肽过氧化物酶4;铁死亡;实验研究
doi:10.12102/j.issn.1672-1349.2024.02.011
Tumulosic Acid Inhibits Oxygen-glucose Deprivation/Reoxygenation-induced Cardiomyocyte Ferroptosis by Regulating Nrf2/SLC7A11/GPX4 Signaling Pathway
WANG Feifei, CHEN Boyan, LI Qiong
Xi′an Gaoxin Hospital, Xi′an 710000, Shaanxi, China
Corresponding Author LI Qiong, E-mail: 554739296@qq.com
Abstract Objective:To explore the mechanism of tumulosic acid inhibiting oxygen-glucose deprivation/reoxygenation(OGD/R)-induced cardiomyocyte ferroptosis.Methods:Rat cardiomyocytes H9c2 were cultured in vitro and treated with 0,1.0,2.5,5.0,10.0,20.0 μmol/L tumulosic acid for 24 h immediately after the establishment of the cell OGD/R model.The cell viability of each treatment group was detected by CCK-8 method,and the appropriate concentration of tumulosic acid was screened out.H9C2 cells were randomly divided into control group,model group, tumulosic acid group,ML385 group[nuclear factor erythroid-2-related factor 2(Nrf2) inhibitor group],and tumulosic acid+ML385 group,except for the control group,the rest of the groups were treated with tumulosic acid and ML385 immediately after the establishment of the cell OGD/R model.The viability and apoptosis rate of H9c2 cells in each group were detected by CCK-8 method and flow cytometry respectively.The kits were applied to detect the levels of lactate dehydrogenase(LDH),pro-inflammatory factors[prostaglandin E2(PGE2),and tumor necrosis factor-α(TNF-α)],anti-inflammatory factor interleukin(IL)-10 levels,cellular antioxidant factors[catalase(CAT) and glutathione(GSH)],ferroptosis-related indicators[iron content and malondialdehyde(MDA)] in the supernatant of H9c2 cell culture medium in each group.The apoptosis of H9c2 cells in each group and the expression of Nrf2/solute carrier family 7 member 11(SLC7A11)/glutathione peroxidase 4(GPX4) signal-related proteins were detected by Western Blotting.Results:Compared with control group,the apoptosis rate,LDH release,PGE2 and TNF-α levels in cell culture supernatant,cellular iron content,MDA level,and Bax and Caspase-3 protein expression increased in model group(P<0.05),the cell viability,IL-10 level in cell culture supernatant,cellular CAT and GSH levels,Bcl-2 and Nrf2,SLC7A11,GPX4 protein expression decreased(P<0.05).Compared with model group,the apoptosis rate,LDH release(PGE2) and TNF-α levels in cell culture supernatant,cellular iron content,MDA level,and Bax and Caspase-3 protein expression decreased in tumulosic acid group(P<0.05),the cell viability,IL-10 level in cell culture supernatant,cellular CAT and GSH levels,Bcl-2 and Nrf2,SLC7A11,GPX4 protein expression increased(P<0.05);the apoptosis rate,LDH release,PGE2,and TNF-α levels in cell culture supernatant,cellular iron content,MDA level,and Bax and Caspase-3 protein expression increased in ML385 group(P<0.05),the cell viability,IL-10 level in cell culture supernatant,cellular CAT and GSH levels,Bcl-2 and Nrf2,SLC7A11,GPX4 protein expression decreased(P<0.05).Compared with tumulosic acid group,the apoptosis rate,LDH release,PGE2,and TNF-α levels in cell culture supernatant,cellular iron content,MDA level,and Bax and Caspase-3 protein expression increased in tumulosic acid+ML385 group(P<0.05),the cell viability,IL-10 level in cell culture supernatant,cellular CAT and GSH levels,Bcl-2 and Nrf2,SLC7A11,GPX4 protein expression decreased(P<0.05).Conclusion:Tumulosic acid can inhibit OGD/R-induced myocardial cell inflammation,lipid peroxidation,and ferroptosis by activating Nrf2/SLC7A11/GPX4 signaling,enhance antioxidant activity and cell viability,and ultimately alleviate apoptosis injury.
Keywords oxygen glucose deprivation/reoxygenation; cardiomyocytes; tumulosic acid; nuclear factor erythroid-2-related factor 2/solute carrier family 7 member 11/glutathione peroxidase 4; ferroptosis; experimental study
作者单位 西安高新医院(西安 710000)
通讯作者 李琼,E-mail:554739296@qq.com
引用信息 王飞飞,陈伯艳,李琼.茯苓酸通过调节Nrf2/SLC7A11/GPX4信号通路抑制氧糖剥夺/复氧诱导的心肌细胞铁死亡[J].中西医结合心脑血管病杂志,2024,22(2):267-273.
心肌梗死造成的心肌缺血、缺氧是引发心源性猝死的重要原因之一,通过再灌注恢复供血是主要的治疗策略,可有效降低病人死亡率,但在此过程中心肌细胞会因为缺血再灌注损伤发生凋亡,进一步加重心肌结构损伤和功能障碍,导致病人预后不佳[1-2]。心肌缺血再灌注期间由于血氧的突然再补给可引发活性氧(reactive oxygen species,ROS)生成过多和铁离子的积累,破坏氧化还原平衡,造成脂质过氧化和谷胱甘肽(glutathione,GSH)耗竭,引发铁死亡,导致心肌细胞损伤凋亡,通过抑制铁死亡可预防心肌缺血再灌注损伤,是一种有效的心脏保护策略[3-4]。研究发现,铁死亡与缺血再灌注引发的各种组织细胞损伤密切相关,核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)/溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)/谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)信号通路参与介导其过程,激活该信号通路可增强抗氧化能力,抑制氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)诱导的神经元脂质过氧化和铁死亡,保护神经元免受脑缺血再灌注损伤[5],上调Nrf2及其下游GPX4的表达,可降低心肌细胞内ROS、炎性因子和铁水平,提高抗氧化活性,防止炎症和铁死亡,进而挽救心肌免受缺血再灌注损伤[6-7],因此,激活Nrf2/SLC7A11/GPX4可能是减轻OGD/R诱导的心肌细胞铁死亡的有效方法。茯苓酸是一种存在于茯苓、灵芝等中草药中的天然羊毛甾烷型三萜化合物,具有抗氧化、抗纤维化及抗炎特性,可通过抑制心肌纤维化减轻阿霉素诱导的心脏收缩力缺陷和心力衰竭[8],还可增强铁死亡相关蛋白Nrf2、血红素加氧酶1(HO-1)、SLC7A11、GPX4的表达,降低炎性因子及脂质过氧化产物生成,通过抑制肾脏铁死亡减轻缺血再灌注诱导的小鼠急性肾损伤[9],因而预测茯苓酸可能通过下调Nrf2/SLC7A11/GPX4信号通路抑制OGD/R诱导的心肌细胞铁死亡。本实验体外培养大鼠心肌细胞H9c2,诱导建立细胞OGD/R模型后以茯苓酸干预处理,对上述预测做验证。
1 材料与方法
1.1 主要试剂及仪器
大鼠心肌细胞H9c2(货号:SNL-029)购自武汉尚恩生物技术有限公司;DMEM无糖培养基(货号:11966025)、DMEM低糖培养基(货号:10567022)购自赛默飞世尔科技(中国)有限公司;D-无水葡萄糖(纯度≥99.8%,货号:G8150)、茯苓酸(纯度:HPLC≥98%,货号:IP0010)、ML385(纯度≥98%,货号:IM1020)、铁含量检测试剂盒(货号:BC4355)、丙二醛(malondialdehyde,MDA)含量检测试剂盒(货号:BC0025)、乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒(货号:BC0685)、大鼠白细胞介素(interleukin,IL)-10酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒(货号:SEKH-0028)、大鼠前列腺素E2(prostaglandin E2,PGE2)ELISA试剂盒(货号:SEKR-0053)均购自北京索莱宝科技有限公司;细胞计数试剂盒(CCK-8)试剂盒(货号:E606335)、大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(货号:D731168)、异硫氰酸荧光素(FITC)/碘化丙啶(PI)双染法膜联蛋白Ⅴ(Annexin Ⅴ)凋亡检测试剂盒(货号:E606336)均购自生工生物工程(上海)股份有限公司;过氧化氢酶(catalase,CAT)测定试剂盒(货号:A007-1-1)、GSH测定试剂盒(货号:A006-2-1)均购自南京建成生物工程研究所有限公司;兔源抗大鼠anti-SLC7A11一抗(货号:ab175186)、小鼠抗大鼠anti-β-actin一抗(货号:ab8226)、兔源抗大鼠anti-Nrf2抗体(货号:ab92946)、兔源抗大鼠anti-GPX4一抗(货号:ab125066)、辣根过氧化物酶(HRP)偶联山羊抗兔二抗(货号:ab6721)、HRP偶联兔抗小鼠二抗(货号:ab97046)均购自美国Abcam公司。
酶标分析仪(型号:AMR-100)购自上海聚慕医疗器械有限公司;流式细胞分选仪(型号:FACSMelody)购自美国BD公司;垂直电泳槽(型号:KEEBIO-VE180)、电泳仪电源(型号:KEEBIO-600N)、转移电泳槽(型号:KEEBIO-VE186)均购自上海金鹏分析仪器有限公司。
1.2 方法
1.2.1 茯苓酸作用浓度筛选
购买的冻存大鼠心肌细胞H9c2置于40 ℃水浴中快速解冻,离心后以磷酸盐缓冲液(PBS)洗涤,然后加入含10%胎牛血清的DMEM低糖培养基重悬H9c2细胞,接种在25 mm2培养瓶中培养至约80%细胞融合,传代并以1×104个/孔的密度接种在96孔板培养24 h,然后诱导建立细胞OGD/R模型:将培养基更换为DMEM无糖培养基后将H9c2细胞置于低氧培养箱(37 ℃、94%N2、5%CO2、1%O2)中培养24 h进行氧糖剥夺处理,然后将培养基更换为含糖DMEM培养基并放入正常培养箱(37 ℃、5%CO2、95%O2)中培养6 h行复氧处理[10],细胞建模后立即以0、1.0、2.5、5.0、10.0、20.0 μmol/L茯苓酸处理24 h(以0 μmol/L茯苓酸处理细胞作为对照组)[11],每孔加入20 μL CCK-8试剂孵育1 h,参照CCK-8试剂盒说明指导测出各处理组细胞吸光度,计算其细胞活力,细胞活力=药物处理组吸光值/对照组吸光值×100%。
1.2.2 分组处理H9c2细胞后收集标本
取H9c2细胞传代并以2.5×105个/孔的密度接种在小培养皿中培养24 h,随机分为对照组、模型组、茯苓酸组、ML385(Nrf2抑制剂)组、茯苓酸+ML385组,除对照组外,其余各组细胞按照1.2.1中方法建立OGD/R模型,然后马上进行药物处理:茯苓酸组以10.0 μmol/L茯苓酸处理,ML385组以2.0 μmol/L ML385处理[12],茯苓酸+ML385组以10.0 μmol/L茯苓酸和2.0 μmol/L ML385联合处理,对照组正常培养且不进行任何处理,各组均于处理24 h后收集其细胞沉淀及培养基,细胞沉淀存于液氮中备用,培养基于离心后存于-80 ℃备用。
1.2.3 CCK-8法与流式细胞实验分别检测各组H9c2细胞活力、凋亡率
取H9c2细胞传代并以1×104个/孔的密度接种在96孔板中培养24 h,遵照1.2.2中方法进行分组处理24 h后通过CCK-8法测定各组细胞活力,具体步骤参照1.2.1。
取H9c2细胞传代并以2.5×105个/孔的密度接种在小培养皿中培养24 h,遵照1.2.2中方法进行分组处理24 h,以胰酶消化后收集各组细胞,采用预冷PBS洗涤、重悬后计数,每组取出5×105个细胞进行FITC/PI双染法后采用流式细胞仪测定各组细胞凋亡率,具体步骤按照Annexin Ⅴ凋亡检测试剂盒说明书操作。
1.2.4 采用试剂盒检测各组H9c2细胞培养基上清中LDH、PGE2、TNF-α、IL-10水平及细胞CAT、GSH与MDA水平、铁含量
取1.2.2中收集的各组细胞培养基上清,置于4 ℃冰箱中缓慢解冻后,采用试剂盒检测其中LDH、PGE2、TNF-α、IL-10水平,具体操作步骤按照各自制造商试剂盒说明书进行。取1.2.2中收集的各组细胞分别加入适量RIPA裂解液混匀,裂解2 h后离心提取其中总蛋白,采用二喹啉甲酸(BCA)蛋白检测试剂盒测出其浓度,各组分别取300 mL细胞样品液(剩余样品液存于-80 ℃进行蛋白表达检测),采用试剂盒检测其中CAT、GSH与MDA水平、铁含量,具体操作步骤按照各自制造商试剂盒说明书进行。
1.2.5 免疫印迹法检测各组H9c2细胞凋亡及Nrf2/SLC7A11/GPX4信号通路相关蛋白表达
取1.2.4中剩余细胞样品液置于冰水浴中缓慢冻融后,根据蛋白浓度测定结果每组取出15 mg总蛋白,煮沸变性后上样跑电泳、湿转,将胶中分离后的蛋白移到硝酸纤维素膜上,37.5 ℃下以3%牛血清白蛋白溶液孵育蛋白2 h后将B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、Nrf2、β-actin、SLC7A11及GPX4剪下,分别孵育兔源抗大鼠anti-Bcl-2、anti-Bax、anti-Caspase-3、anti-Nrf2、anti-β-actin、anti-SLC7A11及anti-GPX4一抗,洗涤后根据一抗宿主物种分别孵育HRP偶联山羊抗兔二抗、HRP偶联兔抗小鼠二抗,洗涤后采用化学发光试剂显色偶联二抗的HRP,采集各蛋白条带图像后,运用Image J软件定量其灰度值,以内参β-actin为标准量化各蛋白相对表达水平。
1.3 统计学处理
运用SPSS 26.0软件进行统计学分析。定量资料用均数±标准差(x±s)表示,两组间差异比较采用t检验,多组间差异比较行单因素方差分析,组间进一步两两差异比较进行SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 茯苓酸对OGD/R诱导的H9c2细胞活力的影响
不同浓度的茯苓酸均可提升OGD/R诱导的H9c2细胞活力,且剂量越高,其提升作用越强,在浓度为10.0 μmol/L时对细胞活力的提升作用进入平台期,因而后续实验选择10.0 μmol/L的茯苓酸进行。
2.2 茯苓酸对OGD/R诱导的H9c2细胞凋亡损伤的影响
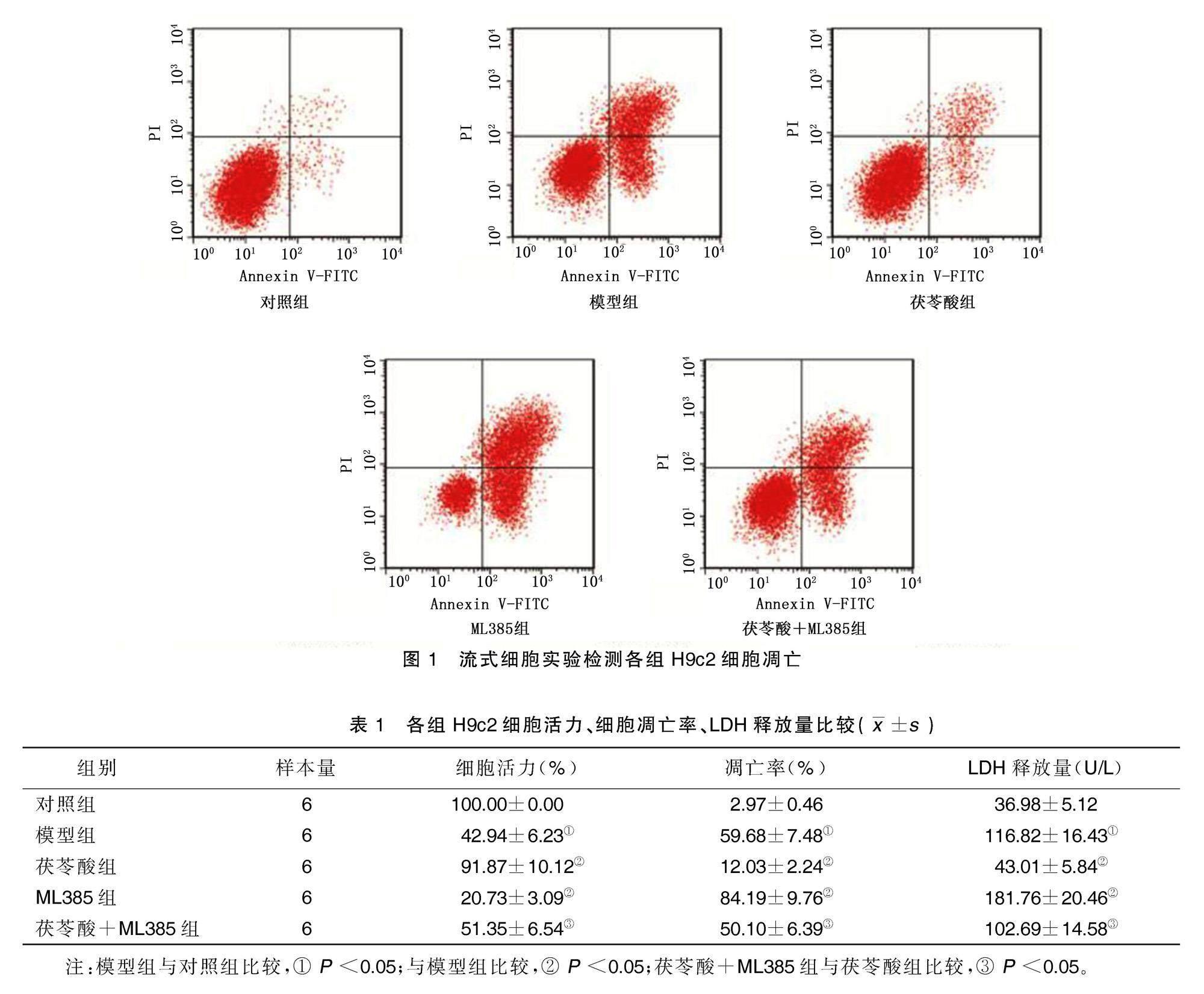
与对照组比较,模型组细胞凋亡率、LDH释放量均升高(P<0.05),细胞活力降低(P<0.05)。与模型组比较,茯苓酸组细胞凋亡率、LDH释放量均降低(P<0.05),细胞活力升高(P<0.05);ML385组细胞凋亡率、LDH释放量均升高(P<0.05),细胞活力降低(P<0.05)。与茯苓酸组比较,茯苓酸+ML385组细胞凋亡率、LDH释放量均升高(P<0.05),细胞活力降低(P<0.05)。详见图1、表1。
2.3 茯苓酸对OGD/R诱导的H9c2细胞促炎因子与抗炎因子释放的影响
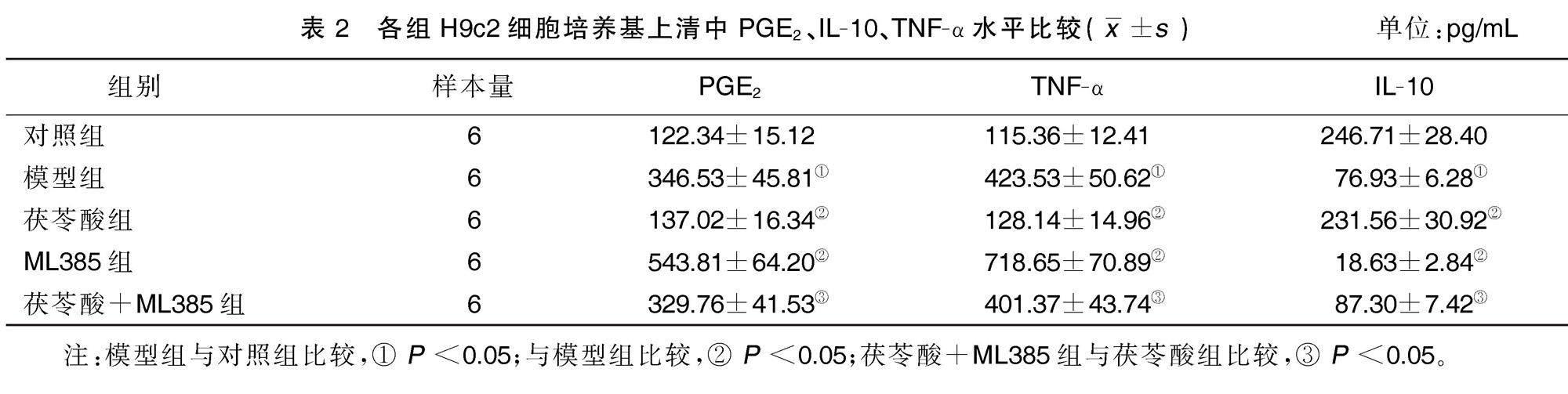
与对照组比较,模型组细胞培养基上清中PGE2、TNF-α水平均升高(P<0.05),IL-10水平降低(P<0.05)。与模型组比较,茯苓酸组细胞培养基上清中PGE2、TNF-α水平均降低(P<0.05),IL-10水平升高(P<0.05);ML385组细胞培养基上清中PGE2、TNF-α水平均升高(P<0.05),IL-10水平降低(P<0.05)。与茯苓酸组比较,茯苓酸+ML385组细胞培养基上清中PGE2、TNF-α水平均升高(P<0.05),IL-10水平降低(P<0.05)。详见表2。
2.4 茯苓酸对OGD/R诱导的H9c2细胞抗氧化因子及铁死亡相关指标水平的影响
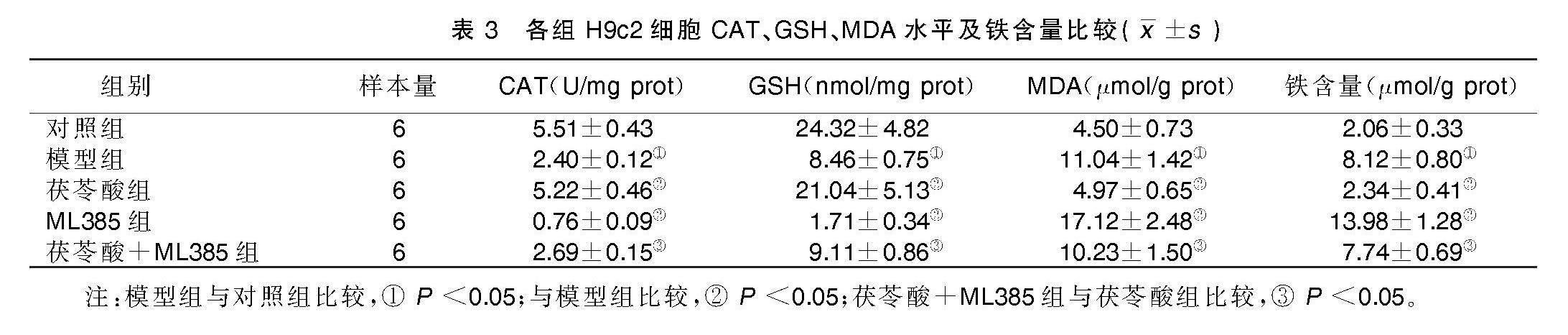
与对照组比较,模型组细胞CAT、GSH水平均降低(P<0.05),MDA水平、铁含量均升高(P<0.05)。与模型组比较,茯苓酸组细胞CAT、GSH水平均升高(P<0.05),MDA水平、铁含量均降低(P<0.05);ML385组细胞CAT、GSH水平均降低(P<0.05),MDA水平、铁含量均升高(P<0.05)。与茯苓酸组比较,茯苓酸+ML385组细胞CAT、GSH水平均降低(P<0.05),MDA水平、铁含量均升高(P<0.05)。详见表3。
2.5 茯苓酸对OGD/R诱导的H9c2细胞凋亡相关蛋白表达的影响
与对照组比较,模型组细胞Bcl-2蛋白表达降低(P<0.05),Bax、Caspase-3蛋白表达均升高(P<0.05)。与模型组比较,茯苓酸组细胞Bcl-2蛋白表达升高(P<0.05),Bax、Caspase-3蛋白表达均降低(P<0.05);ML385组细胞Bcl-2蛋白表达降低(P<0.05),Bax、Caspase-3蛋白表达均升高(P<0.05)。与茯苓酸组比较,茯苓酸+ML385组细胞Bcl-2蛋白表达降低(P<0.05),Bax、Caspase-3蛋白表达均升高(P<0.05)。详见图2、表4。
2.6 茯苓酸对OGD/R诱导的H9c2细胞Nrf2/SLC7A11/GPX4信号通路相关蛋白表达的影响
与对照组比较,模型组细胞Nrf2、SLC7A11、GPX4蛋白表达均降低(P<0.05)。与模型组比较,茯苓酸组细胞Nrf2、SLC7A11、GPX4蛋白表达均升高(P<0.05);ML385组细胞Nrf2、SLC7A11、GPX4蛋白表达均降低(P<0.05)。与茯苓酸组比较,茯苓酸+ML385组细胞Nrf2、SLC7A11、GPX4蛋白表达均降低(P<0.05)。详见图3、表5。
3 讨 论
临床研究发现,心肌梗死治疗过程中,心肌组织会因血流再灌注发生氧化应激、炎性浸润及心肌细胞死亡等缺血再灌注损伤症状,是影响病人预后的关键,因此对其进行防治对于提升心肌梗死病人治疗效果有重大临床意义[13-14]。本实验对体外培养的大鼠心肌细胞H9c2进行OGD/R处理,诱导建立体外心肌缺血再灌注损伤细胞模型,结果显示,OGD/R诱导细胞促炎因子PGE2、TNF-α水平升高,抗炎因子IL-10及抗氧化因子CAT、GSH水平降低,引发细胞炎症与过氧化损伤,造成LDH释放量提升及细胞活力降低,最终诱发细胞凋亡,揭示OGD/R细胞模型构建成功。
铁死亡是引发脑、心肌等组织器官缺血再灌注损伤的主要因素之一,可引发缺血再灌注后细胞内脂质过氧化水平升高和铁蓄积,最终导致细胞损伤死亡,通过抑制铁死亡可减轻OGD/R诱导的海马神经元细胞损伤,保护心肌免于缺血再灌注损伤[15-16]。茯苓酸是一种有明显抗炎及抗氧化特性的天然三萜类化合物,广泛分布于灵芝、茯苓等名贵中草药中,可通过抑制铁死亡保护肾脏组织,避免缺血再灌注引发的急性病理损伤[9],还可通过减轻氧化应激抑制氧化型低密度脂蛋白诱导的内皮细胞损伤[17],缓解血管紧张素Ⅱ诱导的心肌细胞肥大和凋亡[11],因而推测茯苓酸可能对OGD/R诱导的心肌细胞铁死亡具有抑制作用。本实验以0、1.0、2.5、5.0、10.0、20.0 μmol/L茯苓酸处理OGD/R诱导的大鼠心肌细胞H9c2,均可提升其细胞活力,且剂量越高,其提升作用越强,以10.0 μmol/L的茯苓酸处理OGD/R诱导的H9c2细胞,可降低细胞凋亡率、LDH释放量、细胞培养基上清中PGE2及TNF-α水平、细胞铁含量、MDA水平及Bax、Caspase-3蛋白表达,升高细胞活力、细胞培养基上清中IL-10水平、细胞CAT及GSH水平、Bcl-2蛋白表达,表明茯苓酸可减少促炎因子和ROS产生,提高抗炎和抗氧化因子水平,缓解脂质过氧化和细胞内铁沉积,抑制铁死亡,最终减轻OGD/R诱导的心肌细胞凋亡损伤,并提升其活力,发挥细胞保护作用,且剂量越高,功效越强。
研究显示,Nrf2信号可通过调控SLC7A11和GPX4表达而介导细胞铁蓄积、ROS产生和氧化损伤过程,激活Nrf2信号可上调SLC7A11、GPX4表达,缓解ROS产生和铁沉积,减轻铁死亡引发的细胞损伤,对OGD/R诱导的肺上皮细胞发挥保护作用,并可减轻缺血再灌注引起的大鼠心肌组织炎症和脂质过氧化,抑制铁死亡,从而减轻心肌损伤[18-20]。刘凤等[17]研究显示茯苓酸可通过激活Nrf2/HO-1信号通路改善氧化型低密度脂蛋白导致的人脐静脉内皮细胞损伤,因而推测激活Nrf2/SLC7A11/GPX4信号通路可能是茯苓酸抑制OGD/R诱导的心肌细胞铁死亡的作用机制。本研究结果显示,以Nrf2抑制剂ML385处理OGD/R诱导的H9c2细胞,可下调SLC7A11、GPX4蛋白表达,促进ROS及促炎因子表达,减少抗炎及抗氧化因子生成,加重OGD/R诱导的心肌细胞炎症与过氧化损伤,增强铁死亡,最终进一步促进细胞损伤凋亡,而茯苓酸可上调OGD/R诱导的H9c2细胞Nrf2、SLC7A11、GPX4蛋白表达,表明Nrf2/SLC7A11/GPX4参与介导OGD/R诱导的心肌细胞铁死亡及茯苓酸对其可能有抑制作用。以茯苓酸和ML385联合处理OGD/R诱导的H9c2细胞,相比茯苓酸单独处理,可升高细胞凋亡率、LDH释放量、细胞培养基上清中PGE2及TNF-α水平、细胞铁含量、MDA水平及Bax、Caspase-3蛋白表达,降低细胞活力、细胞培养基上清中IL-10水平、细胞CAT及GSH水平、Bcl-2及Nrf2、SLC7A11、GPX4蛋白表达,表明ML385可减弱茯苓酸对炎症和脂质过氧化的减轻作用,拮抗其对OGD/R诱导的心肌细胞铁死亡和凋亡损伤的抑制作用,最终逆转茯苓酸对心肌细胞的保护作用,揭示茯苓酸抑制OGD/R诱导的心肌细胞铁死亡是通过激活Nrf2信号实现的。
总之,本实验证实了茯苓酸可增强Nrf2/SLC7A11/GPX4通路蛋白表达,减少ROS和促炎因子产生,提高抗氧化因子和抑炎因子水平,缓解OGD/R诱导的心肌细胞脂质过氧化和铁沉积,抑制铁死亡,减轻OGD/R导致的心肌细胞凋亡损伤,促进Nrf2/SLC7A11/GPX4信号途径传导可能是其分子机制之一,本研究为茯苓酸用于心肌缺血再灌注损伤的临床防治提供了新的理论依据,有利于心肌梗死治疗方法的改进。
参考文献:
[1] LI Y N,QU M C,XING F,et al.The protective mechanism of dexmedetomidine in regulating Atg14L-Beclin1-Vps34 complex against myocardial ischemia-reperfusion injury[J].Journal of Cardiovascular Translational Research,2021,14(6):1063-1074.
[2] LIN H,XU W S,LIU X W,et al.Macrophages induce the expression of lncRNA ATB via the secretion of TGF-β to relieve ischemia-reperfusion injury in cardiomyocytes[J].Experimental and Therapeutic Medicine,2021,22(3):910.
[3] LIU X L,QI K,GONG Y,et al.Ferulic acid alleviates myocardial ischemia reperfusion injury via upregulating AMPKα2 expression-mediated ferroptosis depression[J].Journal of Cardiovascular Pharmacology,2021,79(4):489-500.
[4] LI T,TAN Y,OUYANG S,et al.Resveratrol protects against myocardial ischemia-reperfusion injury via attenuating ferroptosis[J].Gene,2022,808:145968.
[5] YUAN Y,ZHAI Y Y,CHEN J J,et al.Kaempferol ameliorates oxygen-glucose deprivation/reoxygenation-induced neuronal ferroptosis by activating Nrf2/SLC7A11/GPX4 axis[J].Biomolecules,2021,11(7):923.
[6] HWANG J W,PARK J H,PARK B W,et al.Histochrome attenuates myocardial ischemia-reperfusion injury by inhibiting ferroptosis-induced cardiomyocyte death[J].Antioxidants,2021,10(10):1624.
[7] LV Z Q,WANG F E,ZHANG X F,et al.Etomidate attenuates the ferroptosis in myocardial ischemia/reperfusion rat model via Nrf2/HO-1 pathway[J].Shock,2021,56(3):440-449.
[8] YOUNIS N N,SALAMA A,SHAHEEN M A,et al.Pachymic acid attenuated doxorubicin-induced heart failure by suppressing miR-24 and preserving cardiac junctophilin-2 in rats[J].International Journal of Molecular Sciences,2021,22(19):10710.
[9] JIANG G P,LIAO Y J,HUANG L L,et al.Effects and molecular mechanism of pachymic acid onferroptosis in renal ischemia reperfusion injury[J].Molecular Medicine Reports,2021,23(1):63.
[10] SONG Y B,ZHANG Y Q,WAN Z F,et al.CTRP3 alleviates cardiac ischemia/reperfusion injury via LAMP1/JIP2/JNK signaling pathway[J].Aging,2022,14(3):1321-1335.
[11] 袁园,李芳芳,吴青青,等.茯苓酸对血管紧张素Ⅱ诱导的H9c2细胞肥大和凋亡的影响及其机制的研究[J].广西医学,2018,40(6):656-661.
[12] 黄庆洋,纪东东,田绣云,等.小檗碱通过激活Nrf2-HO-1/GPX4通路抑制小鼠海马神经元HT22细胞的铁死亡[J].南方医科大学学报,2022,42(6):937-943.
[13] LI Y,SUN X Z,ZHUANG J Q,et al.Donepezil ameliorates oxygen glucose deprivation/reoxygenation induced cardiac microvascular endothelial cell dysfunction through PARP1/NF-κB signaling[J].Molecular Medicine Reports,2022,25(4):121.
[14] LI Y F,WEI T W,FAN Y,et al.Serine/threonine-protein kinase 3 facilitates myocardial repair after cardiac injury possibly through the glycogen synthase kinase-3β/β-catenin pathway[J].Journal of the American Heart Association,2021,10(22):e022802.
[15] MAO R,LIU H.Depletion of mmu_circ_0001751(circular RNA Carm1) protects against acute cerebral infarction injuries by binding with microRNA-3098-3p to regulate acyl-CoA synthetase long-chain family member 4[J].Bioengineered,2022,13(2):4063-4075.
[16] ZHANG Y B,REN X Y,WANG Y,et al.Targeting ferroptosis by polydopamine nanoparticles protects heart against ischemia/reperfusion injury[J].ACS Applied Materials & Interfaces,2021,13(45):53671-53682.
[17] 刘凤,刘增长.茯苓酸通过激活Nrf2/HO-1信号通路改善OX-LDL诱导的人脐静脉内皮细胞损伤[J].中国免疫学杂志,2020,36(2):164-168;179.
[18] SONG J X,AN J R,CHEN Q,et al.Liraglutide attenuates hepatic iron levels and ferroptosis in db/db mice[J].Bioengineered,2022,13(4):8334-8348.
[19] DONG H,XIA Y Y,JIN S L,et al.Nrf2 attenuates ferroptosis-mediated IIR-ALI by modulating TERT and SLC7A11[J].Cell Death & Disease,2021,12(11):1027.
[20] XU S J,WU B X,ZHONG B Y,et al.Naringenin alleviates myocardial ischemia/reperfusion injury by regulating the nuclear factor-erythroid factor 2-related factor 2(Nrf2)/system xc-/glutathione peroxidase 4(GPX4) axis to inhibit ferroptosis[J].Bioengineered,2021,12(2):10924-10934.
(收稿日期:2022-08-11)
(本文编辑王丽)