磁液悬浮离心血泵左心室辅助植入实验麻醉的探讨
2024-04-29荣彦生王鹤昕薛玉良王洪武
荣彦生 王鹤昕 薛玉良 王洪武

摘要 目的:通过分析实验动物的成活率与麻醉相关的死亡率,探讨合适的改进措施及合适的大动物麻醉方法。方法:回顾2010年8月—2018年1月在泰达国际心血管病医院实验动物中心实施的磁液悬浮离心血泵左心室辅助装置植入36只小尾寒羊的实验,统计实验羊6 h拔管率与麻醉相关的死亡率,通过尸检组织学病理特征分析麻醉相关死亡原因。结果:回顾分3个阶段,2010年8月—2013年8月,共16只羊完成麻醉,其中1只羊麻醉采血,15只羊实施了左心室辅助装置植入实验,长期成活2只,麻醉相关死亡8只,6 h拔管率13%,麻醉相关死亡率50%;2014年11月—2015年3月,共8只羊完成左心室辅助装置植入实验,麻醉相关死亡3只,通过改进麻醉方案,麻醉相关死亡率降低至38%,术后6 h拔管率43%,长期带泵存活3只;2017年10月—2018年1月,共12只羊完成左心室辅助装置植入实验,继续优化麻醉策略,无麻醉相关死亡,术后6 h拔管率83%,8只羊术后顺利恢复无并发症,6只存活达到了研究设定的90 d。结论:通过改进麻醉方案,优化麻醉策略,全身麻醉插管,静吸复合麻醉可以提高大动物实验成功率。
关键词 磁液悬浮离心血泵;左心室辅助;优化麻醉策略;全身麻醉插管;静吸复合麻醉
doi:10.12102/j.issn.1672-1349.2024.02.010
基金项目 国家重点研发计划项目(No.2017YFC0111005)
作者单位 1.泰达国际心血管病医院(天津 300457);2.航天泰心科技有限公司
通讯作者 王洪武,E-mail:wanghw1967@163.com
引用信息 荣彦生,王鹤昕,薛玉良,等.磁液悬浮离心血泵左心室辅助植入实验麻醉的探讨[J].中西医结合心脑血管病杂志,2024,22(2):261-266.
心力衰竭是指由于心脏的收缩和舒张功能发生障碍所导致的心脏循环障碍症候群,心力衰竭易导致一系列并发症,给人们的生活带来了极大的影响。晚期心力衰竭若未进行合理的治疗可引起严重的并发症,甚至导致病人短时间内死亡。心脏移植是晚期心力衰竭治疗的有效手段[1],在今后很长时期内晚期心力衰竭病人的数量将远远大于可提供心脏移植的供体数量,左心室辅助装置不仅可挽救病人生命,还为病人提供了能够维持正常生活的可能[2]。左心室辅助装置是将心室血液引流到辅助装置,通过血泵再回输到动脉系统,起到部分或全部替代心脏做功,维持血液循环的作用,欧美发达国家已经成功用于临床十几年[3-4],国内刚刚起步,泰达国际心血管病医院联合火箭空间技术研究院研发了第三代左心室辅助装置磁液悬浮离心血泵[5],经过10余年不断实验、摸索、改进,终于成功植入羊体,取得了较好的临床预期效果,现将麻醉处理过程及结果报告如下。
1 预实验阶段(2010年8月—2013年8月)
此阶段共计完成16只小尾羊实验的麻醉(1只采血羊麻醉,15只羊实施了左心室辅助装置植入实验)。1.1 前期血泵性能实验测试(采集实验用羊血)遵循天津市实验动物管理条例进行,经过泰达国际心血管病医院动物伦理委员会批准,选取健康成年绵羊1只,体质量50 kg,陆眠宁(吉林省华牧动物保健品有限公司生产)1 mg/kg肌肉注射,复合丙泊酚(西安力邦制药有限公司生产)0.2~0.5 mg/kg静脉推注,麻醉起效后备皮,经颈静脉穿刺置入双腔中心静脉导管至上腔静脉,抽取静脉血1 000 mL,注入含有抗凝剂的储血袋,同时补充胶体液1 000 mL。
1.2 心室辅助装置植入实验
1.2.1 实验设备
磁液悬浮离心血泵,重量180 g,主体由钛合金制成,包括血泵、电控系统、手术工具、植入附件。
1.2.2 手术方法及步骤
实验羊采取右侧卧位,经左侧第四、五肋间进胸,逐层剥离充分显露主动脉弓降部及心尖部,通过非体外循环手术将血泵安装在实验羊左心室,血泵入口插入实验羊左心尖,血泵出口经人造血管连接到羊的降主动脉,血液从左心室流入泵体,经泵体流入降主动脉,泵体直接安装在心包腔内。遵循天津市实验动物管理条例进行实验,经过泰达国际心血管病医院动物伦理委员会批准,2010年8月—2013年8月共15只羊完成左心室辅助装置植入实验。
1.3 麻醉步骤
1.3.1 基础麻醉
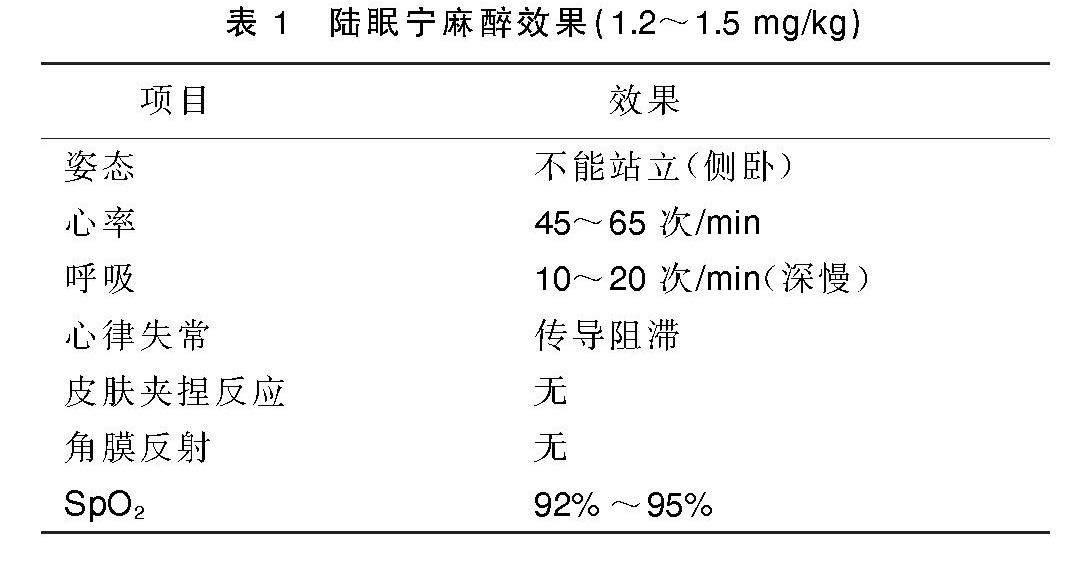
实验羊术前禁食12 h,陆眠宁(吉林省华牧动物保健品有限公司生产)1.2~1.5 mg/kg基础麻醉后,将羊移至手术室,抬至手术床上,对羊制动固定肢体,监测血氧饱和度(SpO2),进行耳缘动脉穿刺,穿刺成功后缝合固定,进行连续有创动脉压监测,采集动脉血进行基础血气分析。麻醉效果见表1。
1.3.2 慢诱导气管插管
具体操作:静脉注射丙泊酚(西安力邦制药有限公司)0.5~1.0 mg/kg,待羊睫毛反射消失后,保持羊侧卧,颈部伸直状态下,由一助手将羊上下颌用力拉开,插管者将直接喉镜从舌背插入,暴露会厌后用镜片挑起会厌明视下行气管插管(使用临床8.5号气管插管),导管插入后,根据呼出气流证明位置无误后,将导管及牙垫妥善固定,气囊充气,给予肌肉松弛剂氯化琥珀胆碱(上海旭东海普药业有限公司生产)50 mg或阿曲库铵(江苏恒瑞医药股份有限公司生产)5 mg,连接麻醉机(Ohmeda7100,美国),麻醉机设置:潮气量10 mL/kg,呼吸频率8~12次/min,吸呼比1∶2,吸入氧浓度60%。
1.3.3 中心静脉穿刺
具体操作:将羊颈部垫高,暴露出颈静脉,局部消毒铺无菌孔单,穿刺导针刺入静脉后,置入导丝,局部用扩张器扩皮,导入穿刺导管,送入20 cm,局部缝合固定,插胃管胃肠减压,开皮前30 min预防性使用抗生素。
1.3.4 手术部位消毒开皮开胸
持续静脉注射丙泊酚4~6 mg/(kg·h),芬太尼(宜昌人福药业有限公司生产)0.1~0.2 mg静脉注射,给予地塞米松(天津金耀集团有限公司生产)5~10 mg,抗炎及抗休克,凝血时间测试仪(型号:HR-7564,美国)监测激活全血凝固时间(ACT)生理值,给予肝素(常州千红生化制药股份有限公司生产)1 mg/kg,防止人工血管凝血。
1.3.5 心室辅助装置植入
人工血管与主动脉吻合时,根据血压情况,如血压过高,加大醚的吸入浓度,也可以使用硝普钠(广东众生药业股份有限公司生产)控制血压。缝合左心室缝合环时,由于局部刺激多伴有心率增快,加深麻醉及使用艾司洛尔(齐鲁制药有限公司生产)0.05 mg/(kg·min)控制心率,心尖打孔及置入心室辅助装置时血压一般难以维持,准备钙剂(上海信谊金朱药业有限公司生产)、多巴胺(上海和丰制药有限公司生产)、肾上腺素(北京市永康药业有限公司),如出现血压过低情况,间断推注以上药物。
1.3.6 关胸及术中注意事项
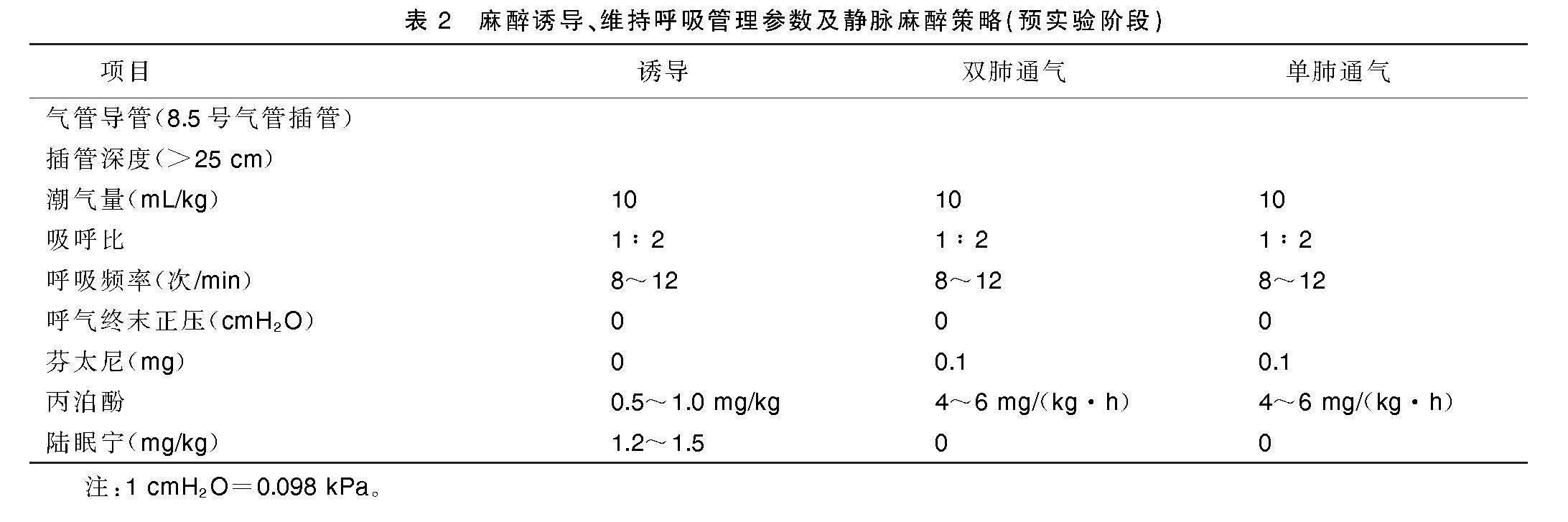
间隔 1~2 h复查血气(血气分析仪,IL-1430,美国),术中监测血糖,如果血糖过高,给予胰岛素泵入。术中根据中心静脉压数值、血泵的转速及流量调整补液速度10~15 mL/(kg·h),晶体及胶体的比例为1∶1,晶体液包括乳酸钠林格氏液,生理盐水,5%、10%葡萄糖注射液(天津大冢制药有限公司生产),胶体溶液为血定安(苏州贝朗医疗有限公司)。术中每30 min间断吸痰,根据肌松恢复情况小剂量追加氯化琥珀胆碱。关胸前复查ACT,根据具体情况决定是否给予鱼精蛋白(上海第一生化药业有限公司),如果ACT不超过300 s,可以不给鱼精蛋白中和。降低丙泊酚泵入浓度,肺膨胀满意,关胸结束转接呼吸机(型号:SIEMENS3000,瑞典)。具体麻醉策略见表2。
1.4 实验结果 外科操作左室碎肉误入至血泵停止工作5只,麻醉相关死亡8只(心室颤动死亡2只,气管插管脱管死亡2只,肺水肿死亡2只,肾衰竭无尿死亡2只),麻醉相关死亡率50%,1只术后血泵左心辅助59 h,因观察血泵对羊短时间的影响人为主动停泵,存活75 d。1只术后6 h顺利脱机,血泵正常工作,健康存活120 d。麻醉后长期成活2只,6 h拔管率13%。详见表3。
2 批量动物实验阶段(2014年11月—2015年3月)
此阶段共8只羊完成左心室辅助装置植入实验,通过第一阶段的实验教训,本研究进行了麻醉改进,前期使用的陆眠宁剂量偏大,绵羊出现心率减慢、偶发传导阻滞、氧合下降等麻醉过深情况,此阶段将陆眠宁由1.2~1.5 mg/kg降至0.8~1.0 mg/kg;增加术前抗胆碱药物的使用,探索使用长托宁术前30 min肌肉注射2 mg,实验羊的气道分泌物减少,术前及术后的血气分析对比差异不明显,氧合指数维持正常;气管导管由临床使用的8.5号气管插管改为特制加长加粗导管,有效防止了气管导管漏气以及脱管。此阶段由于外科操作心尖打孔左室碎肉误入至血泵停止工作2只,麻醉相关死亡3只(心室颤动死亡1只,肺水肿死亡1只,肾衰竭无尿死亡1只),通过改进麻醉方案,麻醉相关死亡率降至38%,术后6 h拔管长期带泵存活3只,均存活超过90 d,6 h拔管率43%。陆眠宁降低剂量麻醉效果见表4,麻醉呼吸管理策略见表5,实验羊存活情况见表6。
3 左心室辅助泵上市前期批量动物实验(2017年10月—2018年1月)
此阶段共12只羊完成左心室辅助装置植入实验,在上阶段工作的基础上继续优化麻醉方案,采取利多卡因1~2 mg/(kg·h)持续泵入防止心室颤动;右旋美托咪定0.5~1.0 μg/(kg·h)持续泵入联合七氟烷2%~4%静吸复合麻醉,发挥七氟烷可控性好、术后苏醒迅速的特点;静脉给予乌司他丁肺保护,单肺通气期间给予保护性通气策略;关胸期间给予罗哌卡因0.25%肋间神经阻滞;采用限制液体策略,保证血泵最低有效运转的容量。结果1只羊术后第1天突发心室颤动死亡,1只羊术后6 h因失血休克死亡,2只羊因外科操作残留心肌组织误入血泵致停止工作,血泵里残留心肌组织,考虑没有长期存活价值放弃。以上4只羊死亡均与麻醉无关,其余8只羊术后顺利恢复无并发症,6 h内拔管率上升至83%,无麻醉相关死亡,麻醉管理策略及实验动物信息见表7、表8。
泰达国际心血管病医院联合火箭空间技术研究院研发第三代左心室辅助装置磁液悬浮离心血泵[6],历经3个阶段不断实验、摸索、改进,终于成功植入羊体,血泵运转良好,取得了较好的临床预期效果,麻醉也不断改进,高质量配合完成了动物实验。各阶段6 h拔管率及麻醉相关死亡率见图1。
4 讨 论
心力衰竭是全球呈增长趋势的心脏疾病,目前全球范围有超过2 600万例心力衰竭病人。虽然目前对晚期心力衰竭的最佳治疗方法仍首推心脏移植,但由于供体心脏来源受限,离体心脏保存时间短,急性心力衰竭发作死亡率高;同时部分病人不适合心脏移植手术,因此,早期研制可替代心脏做功的机械装置,就是针对这一类病人而提出的解决方案,而动物实验又是检验心室辅助装置有效性、稳定性的重要组成部分。
欧美第三代血泵(磁液悬浮离心血泵)已经成功用于临床[6-10]。泰达国际心血管病医院联合火箭空间技术研究院成功研发第三代血泵,于2017年10月—2018年1月成功植入羊体,6只长期存活超过90 d,生理功能未受到明显影响,取得了较好的临床预期效果。
磁液悬浮离心血泵心室辅助装置植入实验要求动物具有和人类似的生理,同时又要满足术后易监护的特点,羊是最佳选择。大动物实验国内开展有限,缺乏可借鉴的麻醉经验,因手术是侧开胸单肺通气,同时在左心室心尖打孔,势必造成心肌损伤以及冠状动脉缺血,增加了术后长期存活的难度。我院在实践中总结了一套行之有效的大动物实验麻醉常规,取得了良好的麻醉效果,高质量配合完成动物实验。
第一,适当的术前禁食。羊有4个胃:瘤胃、网胃、瓣胃、皱胃。皱胃是唯一具有分泌消化液功能的胃,反刍动物的胃排空非常复杂,反刍需要8 h,反刍胃粗饲料停留时间可长达48 h,做到完全胃排空需要相当长的时间,过长的禁食时间对于羊的手术并不合适,我院常规禁食12~24 h,禁水12 h,如果出现胃胀气,常规置入胃管胃肠减压。第二,抑制腺体分泌。羊唾液分泌量非常大,6~16 L/d,造成脱水欠容,且极易出现肺部并发症,影响术后恢复。给予长托宁2 mg静脉注射,30 min血药浓度达到高峰,维持8~12 h,持续抑制腺体分泌。第三,慢诱导保留自主呼吸气管插管。羊的口咽距离长,使用特制的加长喉镜,由于插管有一定的难度,必须保留自主呼吸,成年羊气管内径3.0~3.5 cm,门齿距离气管分叉60~65 cm,为防止气管导管脱出及套囊破裂,经过改进使用定制的套囊加强型加长气管导管。第四,外周动脉及中心静脉的置入。心室辅助装置的置入要有可靠的外周动脉及中心静脉,以往国外报道的是颈动脉、股动脉或开胸乳内动脉或升主动脉监护[11-12],但关胸以后使用受到限制,而耳缘动脉由于比较表浅,穿刺容易,术后易于护理。羊的颈静脉左右各一,肩部垫高,较易暴露穿刺。第五,保护性肺通气模式及肺保护药物的使用。绵羊的肺非常脆弱,早期的动物实验很多脱离呼吸机困难,本课题组在实践中摸索改进,单肺通气期间给予小潮气量通气6 mL/kg,快频率22~24次/min,合适的呼气终末正压6~8 cmH2O,防止肺萎陷。乌司他丁10万U/h,抑制炎症反应介质的释放,稳定溶酶体膜,改善微循环。绵羊术后快速拔管及血气分析也说明了良好的肺保护作用。第六,容量适度控制。由于术前禁食,绵羊处于欠容状态。如果过度补液,势必造成血液稀释,影响实验羊的凝血机制,造成术后胸腔引流液过多,渗血增加,同时肺水增加,术后脱机拔出气管导管困难,早期绵羊实验死亡率过高,补液过多也是原因之一。因此,补液尽量控制在1 000 mL以内,晶体及胶体各500 mL,保证左心室辅助装置能正常工作的最低容量。
动物实验是人类直接认识生命现象的重要媒介,很多科研成果都是通过动物实验得出的。动物实验尤其是动物模型的建立在医学各个领域中都有广泛的应用。国外双心室辅助也已应用于临床[13-16],国内近年陆续开展左心室辅助装置在体动物实验[17-19],本研究探讨大动物实验合适的麻醉方法,取得了预期的临床效果,为国产羊长期在体实验提供了很好的参考依据,提高了实验成功率,有利于国产心室辅助装置早日应用于临床。
参考文献:
[1] 胡盛寿.中国心脏移植现状[J].中华器官移植杂志,2017,38(8):449-454.
[2] LIU X Y,KIMMELSTIEL C,COUPER G S,et al.Echocardiographic assessment of left ventricular assist device outflow velocity during percutaneous decommissioning[J].Journal of Cardiothoracic and Vascular Anesthesia,2021,35(5):1534-1538.
[3] FEGLEY M W,GUPTA R G,ELKASSABANY N,et al.Elective total knee replacement in a patient with a left ventricular assist device-navigating the challenges with spinal anesthesia[J].Journal of Cardiothoracic and Vascular Anesthesia,2021,35(2):662-669.
[4] HESS N R,SEESE L M,HICKEY G W,et al.The predictive value of preimplant pulmonary function testing in LVAD patients[J].Journal of Cardiac Surgery,2021,36(1):105-110.
[5] 本刊讯.第三代全磁悬浮左心辅助装置人工心脏[J].生物医学工程学进展,2019,40(4):230.
[6] LITTLEFIELD A J,JONES G,CIOLEK A M,et al.A reappraisal of the pharmacologic management of gastrointestinal bleeding in patients with continuous flow left ventricular assist devices[J].Heart Failure Reviews,2021,26(2):277-288.
[7] MIRZA K K,XIE R,COWGER J,et al.Comparative analysis of regional outcomes and adverse events after continuous-flow left ventricular assist device implantation:an IMACS analysis[J].The Journal of Heart and Lung Transplantation,2020,39(9):904-914.
[8] MONDAL S,SANKOVA S,LEE K,et al.Intraoperative and early postoperative management of patients undergoing minimally invasive left ventricular assist device implantation[J].Journal of Cardiothoracic and Vascular Anesthesia,2021,35(2):616-630.
[9] JEFFERSON H L,KENT W D T,MACQUEEN K T,et al.Left ventricular assist devices:a comprehensive review of major clinical trials,devices,and future directions[J].Journal of Cardiac Surgery,2021,36(4):1480-1491.
[10] VEEN KEVIN M,MOKHLES MOSTAFA M,OSAMA S,et al.Clinical impact and 'natural' course of uncorrected tricuspid regurgitation after implantation of a left ventricular assist device:an analysis of the European Registry for Patients with Mechanical Circulatory Support(EUROMACS)[J].European Journal of Cardio-thoracic Surgery,2021,59(1):207-216.
[11] ALLISON B J,BRAIN K L,NIU Y G,et al.Altered cardiovascular defense to hypotensive stress in the chronically hypoxic fetus[J].Hypertension,2020,76(4):1195-1207.
[12] SINGH REETU R,VARSHA S,BOOTH LINDSEA C,et al.Catheter-based renal denervation exacerbates blood pressure fall during hemorrhage[J].Journal of the American College of Cardiology,2017,69(8):951-964.
[13] RENE S,MICHIEL M,MICHAEL S,et al.Current perspectives on mechanical circulatory support[J].European Journal of Cardio-thoracic Surgery,2018,55(Sup1):i31-i37.
[14] SHAH P,HA R,SINGH R,et al.Multicenter experience with durable biventricular assist devices[J].The Journal of Heart and Lung Transplantation,2018,37(9):1093-1101.
[15] COYAN G N,ZINN M D,WEST S C,et al.Heart transplantation from biventricular support in infant with novel SMYD1 mutation[J].Pediatric Cardiology,2019,40(8):1745-1747.
[16] MARASCO S,SIMON A R,TSUI S,et al.International experience using a durable,centrifugal-flow ventricular assist device for biventricular support[J].The Journal of Heart and Lung Transplantation,2020,39(12):1372-1379.
[17] 吴广辉,蔺嫦燕,徐创业,等.一款国产置入式心室辅助装置动物在体研究[J].中华胸心血管外科杂志,2016,32(4):238-241.
[18] 刘修健,吴广辉,徐创业,等.ChinaHeart左心辅助装置的动物在体存活实验[J].中国生物医学工程学报,2012,31(5):736-741.
[19] 张冬,杨伯清,陈海波,等.CH-VAD左心辅助装置动物体内实验研究[J].中国生物医学工程学报,2016,35(6):705-711.
(收稿日期:2022-08-08)
(本文编辑王丽)