基于网络药理学分析葛兰心宁软胶囊治疗冠心病的疗效与机制
2024-04-29孙琳洁俞佳利李屹龙宋徽薛金贵
孙琳洁 俞佳利 李屹龙 宋徽 薛金贵


摘要 目的:探讨葛兰心宁软胶囊治疗冠心病的作用机制。方法:通过中药系统药理数据库和分析平台(TCMSP)数据库,筛选出葛根总黄酮、绞股蓝总皂苷、山楂的有效成分,借助 PubChem、GeneCard等获得本方及疾病靶点,绘制韦恩图后得到共同靶点,筛选得到关键靶点。构建药物-疾病靶点相互作用网络图并行基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析,以Cytoscape 3.9.1行可视化分析。结果:葛兰心宁软胶囊与冠心病的交集靶点59个,血清清蛋白(ALB)、肿瘤坏死因子(TNF)、白细胞介素-6(IL-6)、蛋白激酶B1(AKT1)、甘油醛-3-磷酸脱氢酶(GAPDH)、血管内皮生长因子A(VEGFA)等在药物-疾病相互作用中尤为重要。GO分析显示作用机制可能与基因表达的正向调控有关,KEGG分析获得155条相关通路,其中与冠心病相关的主要是脂质和动脉粥样硬化通路。结论:葛兰心宁软胶囊通过多靶点、多通路发挥抗冠心病作用,本研究为进一步研究葛兰心宁软胶囊治疗冠心病的机制提供了理论依据。
关键词 冠心病;葛兰心宁软胶囊;网络药理学;机制研究
doi:10.12102/j.issn.1672-1349.2024.02.004
冠心病为临床常见病,严重危害人类健康,近年来其致死率居高不下。冠心病是由于冠状动脉粥样硬化导致冠状动脉狭窄、缺血以及痉挛,从而引起心肌缺血缺氧性心脏病。以往的研究已证实,动脉粥样硬化是冠心病心绞痛的主要病理基础,炎症反应、血管内皮障碍、血栓形成、血小板激活聚集均是其主要病理机制[1]。在临床实践中,中医药治疗冠心病的临床应用日益增多,葛兰心宁软胶囊由葛根总黄酮、山楂提取物及绞股蓝总皂苷组成,具有活血化瘀、通络止痛的作用,用于瘀血闭阻所致的冠心病、心绞痛。本研究利用网络药理学方法对葛兰心宁软胶囊进行分析,进一步证实其抗动脉粥样硬化的可能机制。
1 资料与方法
1.1 葛兰心宁软胶囊的有效成分及相关靶点预测 检索中药系统药理数据库和分析平台(TCMSP)(https://www.Tcmsp.e.com/)并筛选葛兰心宁软胶囊的有效成分,其中葛根和绞股蓝以“口服生物利用度
作者单位 上海中医药大学附属曙光医院(上海 200021)
通讯作者 薛金贵,E-mail:13916465889@139.com
引用信息 孙琳洁,俞佳利,李屹龙,等.基于网络药理学分析葛兰心宁软胶囊治疗冠心病的疗效与机制[J].中西医结合心脑血管病杂志,2024,22(2):220-230.
(OB)>30%、类药性(DL)>0.18”为条件筛选有效成分,并进一步筛选葛根有效成分中的黄酮类成分及绞股蓝有效成分中的皂甙成分。同时,因TCMSP数据库未收录山楂,查阅文献收集山楂的化学成分,通过PubChem数据库(https://pubchem.Ncbi.Nlm.Nih.gov/)获取
相关成分的化学结构,其中未被PubChem平台收录的成分,使用ChemDraw软件绘制其化学结构,并将文件保存为sdf格式,再通过SwissADME数据库(http://www.swissadme.ch/)将sdf文件进行筛选,筛选条件如下:GI absorption为High,Druglikeness(Lipinski、Ghose、Veber、Egan、Muegge)中5 项至少符合2项,以得到具有较高的口服利用度和类药性的化学成分。将已获得的葛兰心宁软胶囊中全部有效成分通过PubChem(https://pubchem.Ncbi.Nlm.nih.gov/)获取SMILES,后将其全部导入Swiss Targets Prediction(http://swisstargetsprediction.ch/),物种选择“Homo sapiens”,得到“Probability>0”的所有潜在靶点。
1.2 冠心病的靶点筛选及其与葛兰心宁软胶囊相关靶点的交集靶点的获取
在GeneCard(https://www.genecards.org/)数据库检索 “coronaryheartdisease”,并根据相关度(relevancescore)由大到小排序,以第二分之一位数为条件进行筛选获得冠心病靶点,通过Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)获得葛兰心宁软胶囊与冠心病的交集靶点,绘制韦恩图。
1.3 药物-疾病交集靶点蛋白互作(PPI)网络的构建
将交集靶点导入STRING数据库,条件选择“Homo sapiens”,获得tsv文件。将获得的文件导入Cytoscape 3.9.1,利用Network Analyzer插件行网络拓扑学分析,筛选“Degree值≥第3个四分位数”的节点为关键靶点,并构建关键靶点网络图。
1.4 基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析
经DAVID数据库(https://david.ncifcrf.gov/)对关键靶点进行GO和KEGG富集分析,以P<0.01为条件,富集基因数由大到小进行排序,筛选出排前20位的生物过程和通路。利用微生信平台(http://www.bioinformatics.com.cn/)绘制柱形图和气泡图,进行可视化分析。
1.5 成分-靶点-通路网络的构建
选择KEGG富集分析基因富集数前20位的通路,筛选得到与治疗冠心病相关的靶向通路,获取富集在这些通路上的潜在靶点,并将靶点与药物的活性成分相对应。以活性成分、靶点、通路为节点,导入Cytoscape 3.9.1软件,构建葛兰心宁软胶囊治疗冠心病相关的成分-靶点-通路网络图。
1.6 分子对接
选取葛兰心宁软胶囊治疗冠心病的核心靶点与连接度值(Degree值)最高的核心药物成分进行分子对接,并计算其结合能,选择结合能最小的靶点和药物成分进行分子对接可视化。
2 结 果
2.1 葛兰心宁软胶囊的有效成分及其相关靶点的预测分析
从TCMSP数据库中筛选得到葛根总黄酮4个有效成分,绞股蓝总皂苷24个有效成分;检索相关文献并收集山楂化学成分229个,建立山楂化学成分数据库,通过 SwissADME数据库筛选,得到105个具有良好吸收、分布、代谢、排泄(ADME)性质的潜在活性化学成分,详见表1。使用Swiss Targets Prediction数据库获得葛兰心宁软胶囊的潜在靶点并汇总,删除重复值后得到葛兰心宁软胶囊的有效靶点共743个。
2.2 冠心病相关靶点的筛选与交集靶点
检索GeneCard数据库并筛选,得到冠心病的基因靶点1 790个,通过Venny 2.1将冠心病与葛兰心宁软胶囊的靶点取交集,最终得到229个共同靶点。详见图1。
2.3 靶点PPI网络的构建
将229个交集靶点导入STRING数据库,以“Homo sapiens”为条件筛选,得到tsv文件。将得到的文件导入Cytoscape 3.9.1,得到靶点间相互作用与联系的PPI网络。详见图2。PPI网络共有229个节点、4 484条相互作用连线。并依据Degree值大小设置节点大小和颜色深浅。Degree值越大,节点越大,颜色越深,表明葛兰心宁软胶囊通过作用于这些关键靶点从而在冠心病中发挥作用的可能性越大。经计算,整个网络节点Degree值第3个四分位数为51,以“Degree值≥第3个四分位数”为条件筛选关键靶点,共筛选得到葛兰心宁软胶囊治疗冠心病的关键靶点59个、1 283条相互作用连线,详见图3。
2.4 GO和KEGG富集分析
经DAVID数据库对交集靶点进行GO和KEGG富集分析,并通过微生信网站将结果可视化。以富集数(count)为纵坐标制作GO富集三合一柱状图(见图4),结果显示,排名从前往后生物过程(BP)依次为:基因表达的正向调控、凋亡过程负向调控、平滑肌细胞增殖的正向调节、RNA聚合酶Ⅱ启动子的转录正调控等通路;细胞组分(CC)依次为:大分子复合物、小窝、质膜、细胞质等通路;分子功能(MF)依次为:酶结合、相同的蛋白质结合、丝氨酸/苏氨酸/酪氨酸蛋白激酶活性、蛋白磷酸酶结合等。KEGG分析共富集到155条通路,主要为:癌症的通路、蛋白质聚糖在癌症中的应用、脂质和动脉粥样硬化、晚期糖基化终末产物(AGE)及晚期糖基化终末产物受体(RAGE)信号通路在糖尿病并发症中的作用、表皮生长因子受体(EGFR)酪氨酸激酶抑制剂的耐药性、卡波西肉瘤相关疱疹病毒感染、磷脂酰肌醇-3-激酶(PI3K)-蛋白激酶B(AKT)信号通路等。KEGG富集分析置信度较高的前20条通路绘制气泡图,详见图5,纵轴代表通路(term),横轴代表富集倍数(fold enrichment),基因的置信度(P-value)用气泡的颜色表示,基因数用气泡大小表示,气泡越大表明该途径基因富集数量越多,气泡颜色越红表示富集程度越显著,即置信度越小。
2.5 成分-靶点-通路网络的构建
通过KEGG通路富集分析结果筛选出葛兰心宁软胶囊治疗冠心病的潜在通路,并与活性成分和靶点一一对应。将数据导入Cytoscape 3.9.1绘制葛兰心宁软胶囊的成分-靶点-通路相互作用的网络图。详见图6。网络图包含192个节点、814条边线,活性成分用圆形表示,潜在靶点用六边形表示,通路用菱形表示。可见葛兰心宁软胶囊治疗冠心病是多成分、多靶点、多通路共同作用的结果。
2.6 分子对接
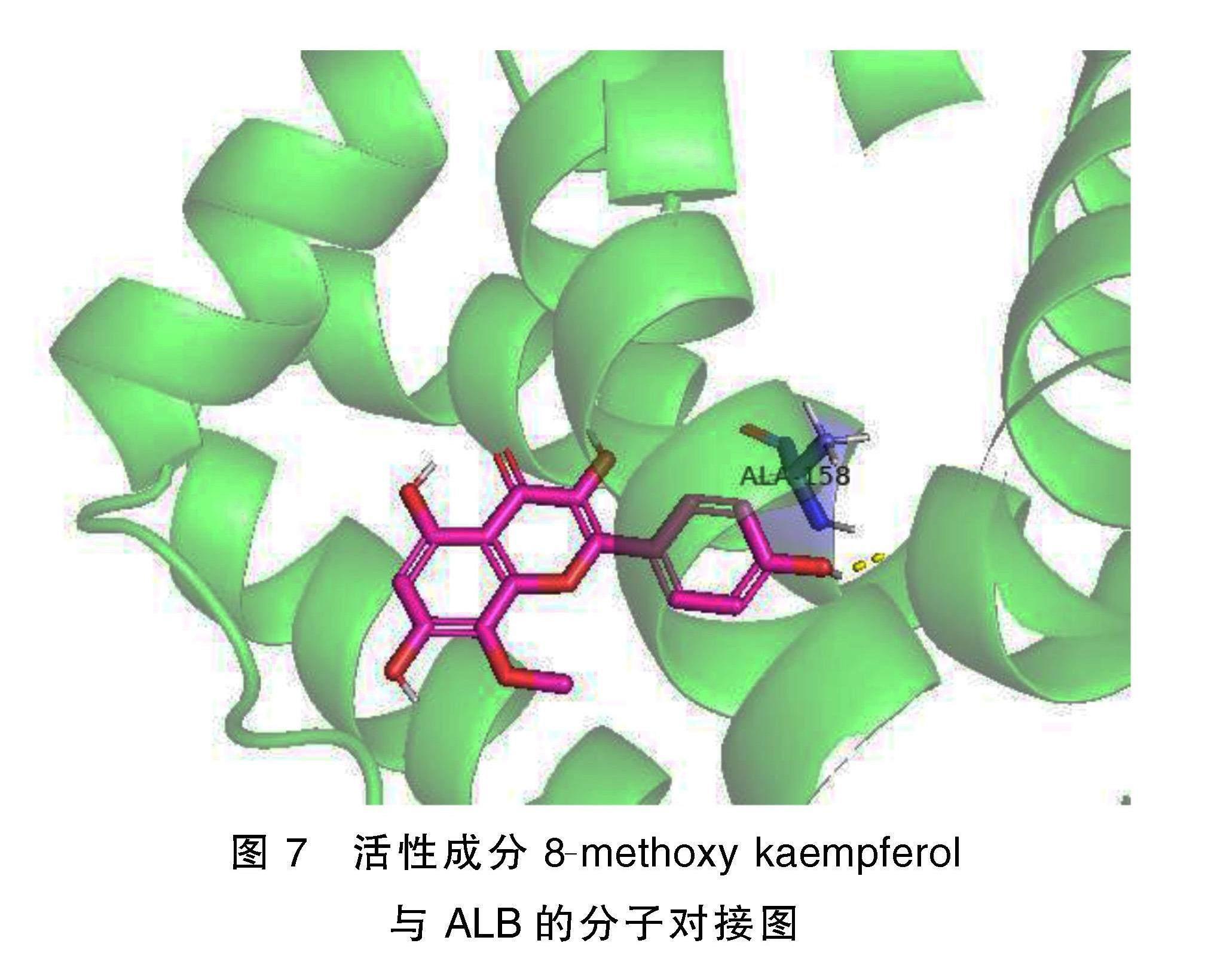
选取葛兰心宁软胶囊治疗冠心病的5个核心靶点血清清蛋白(ALB)、肿瘤坏死因子(TNF)、白细胞介素(IL)-6、蛋白激酶B1(AKT1)、甘油醛-3-磷酸脱氢酶(GAPDH)作为蛋白受体,与Degree值最高的9个核心药物成分8-methoxy kaempferol、cyanidin、kaempferol、quercetin、rhamnazin、gypenoside ⅩⅩⅤ_qt、gypenoside ⅩⅩⅦ_qt、gypenoside ⅩⅩⅧ_qt、gypentonoside A_qt作为分子配体,进行分子对接,并计算其结合能,结果见表2。研究表明,小分子配体与蛋白受体之间结合能<0 kJ/mol表示两者能自发的结合,结合能越小,构象越稳定。结合能<-17.79 kJ/mol,说明两者之间有一定的结合活性;结合能<-20.93 kJ/mol,说明两者之间有较好的结合活性[2]。ALB与8-methoxy kaempferol结合能<-20.93 kJ/mol,有较强烈的结合活性,其可视化结果见图7。
3 讨 论
冠心病属于中医学“胸痹、心痛、真心痛”范畴,其病机为“阳微阴弦”,为本虚标实之证,瘀血、痰浊、寒凝、气滞为标,气、血、阴、阳亏虚为本[3]。葛兰心宁软胶囊由葛根总黄酮、绞股蓝总皂苷、山楂组成,其中葛根总黄酮能够活血化瘀、引药上行,山楂提取物活血散瘀降脂,绞股蓝总皂苷益气健脾化痰,以上药物成分共同发挥活血化瘀、通络止痛之效[4]。现代药理学中,葛根总黄酮能够抗血小板聚集,促进纤溶,降低血黏度,降低血脂,并能够清除动脉血栓,同时可以扩张冠状动脉,减轻心脏负荷,并能够发挥受体阻滞作用,降低心肌耗氧,改善心肌代谢,葛根总黄酮中的葛根素成分能够抗心律失常,保护心肌,改善心肌缺血[5-7]。葛根素还能够减少氧自由基生成,并增加其清除率,同时能降低血黏度,从而减少内皮细胞损伤[8]。山楂及绞股蓝也具有降低血脂、扩张血管的作用,其中山楂中的山楂总黄酮还可以增强机体抗氧化能力,并在缺氧时减少自由基损伤[9],绞股蓝总苷还能防治血栓,改善心绞痛病人的临床症状,发挥保护心脑血管的作用[10-11]。临床研究发现,葛兰心宁能够抑制血栓形成,降低血脂,改善内皮功能[12]。王阶等[13]研究表明葛兰心宁具有降低红细胞聚集、血小板黏附、血黏度、调节血液流变性、改善微循环的作用,葛兰心宁软胶囊的作用关键在于“调血通脉”,以达到“心脑同治”的临床效应[14]。
一氧化氮(NO)及内皮素(ET)水平与冠心病病人病情严重程度相关[15]。ET是一种血管活性物质,具有较强的血管收缩作用,其对冠状动脉的作用十分敏感[16],具有正性肌力作用,能够刺激血管心脏重构[17]。NO主要由血管内皮细胞合成,发挥扩血管、抑制血小板聚集、黏附、血管平滑肌细胞增殖及抗血栓和改善微循环等作用,对于冠心病的治疗具有重要意义。有研究表明,葛兰心宁软胶囊能显著降低冠心病病人ET水平,同时升高NO水平,从而扩张冠状动脉, 改善微循环,增加组织灌注,改善代谢,减轻心肌损伤[8]。同时,葛根素可减少内皮细胞损伤,导致NO合成释放增加,ET合成减少,可能为葛兰心宁软胶囊治疗冠心病的重要机制。
脂代谢异常引发的冠状动脉粥样硬化是冠心病的重要病理基础。研究表明,氧化型低密度脂蛋白(ox-LDL)可在动脉硬化发生发展全过程中发挥作用,ox-LDL既可以促进血管平滑肌细胞的增殖及迁移,并刺激血小板形成血栓,促进内皮细胞中黏附分子的表达等,又可以增加泡沫细胞生成,促进动脉粥样硬化的形成。 而葛兰心宁软胶囊可显著降低冠心病心绞痛病人ox-LDL水平[18]。低密度脂蛋白胆固醇(LDL-C)经过氧化修饰后致动脉粥样硬化的作用更强,因此,降低LDL-C水平是治疗中的关键目标之一[19]。
本研究运用网络药理学原理,获取葛兰心宁软胶囊与冠心病的共同靶点后构建PPI网络,筛选出其中的核心靶点。TNF与肿瘤坏死因子受体1(TNFR1)结合后能够激活丝裂原活化蛋白激酶(MAPK)以及核转录因子-κB(NF-κB)、c-Jun通路,促进细胞中IL-1、IL-6等促炎因子的表达并介导炎性反应的发生[20-22]。TNF与肿瘤坏死因子受体2(TNFR2)结合后激活PI3K/AKT通路,AKT1同时也是PI3K/AKT通路的重要组成部分,AKT1能够促进内皮型一氧化氮合酶(eNOS)及NO的生成,进而导致颈动脉粥样硬化斑块不稳定[23-24]。TNF-α存在于粥样硬化损伤部位,能够诱导免疫反应、炎症反应,同时还导致斑块的不稳定并促进血栓形成[25],对血管壁细胞的增殖、坏死及凋亡起到调控作用,首先可以直接损伤血管内皮细胞,介导血栓形成,同时也可反过来增加TNF-α释放使单核细胞向内皮细胞趋化并黏附,并诱导血管平滑肌细胞的内膜迁移趋势[26]。
同时,在冠状动脉粥样硬化发生过程中,TNF-α能够增加IL-6的释放[27-28],IL-6是一种促炎因子,参与机体炎症反应,促进动脉粥样硬化发生发展[29-32]。二者协同作用可使大量免疫复合物沉积于血管内皮,加快血栓形成。IL-6能够诱导黏附分子和其他炎症介质在血管内皮细胞中的表达,促进炎症反应的发生,同时还能诱导脂质沉积从而促进动脉粥样斑块的形成,并刺激血管平滑肌细胞的增殖,增加冠状动脉血栓的形成。另外,IL-6可促进基质降解酶合成从而侵蚀斑块基质,导致斑块不稳定甚至破裂。因此,有研究提出,血清IL-6水平能够预测冠心病的严重程度及其预后[33-36]。
MAPK3/1即细胞外信号调节激酶(ERK)1/2,不仅与肿瘤发生关系密切[37-38],同时炎症反应也与ERK通路的激活密切相关[39]。MAPK通路抑制剂能够通过抑制多种炎性因子的产生从而明显阻断炎症反应的发生[39-40]。PI3K/AKT通路能够通过影响巨噬细胞的脂质代谢、极化分型、自噬等过程[41-42],影响冠心病发生发展进程。SRC是一种蛋白激酶,能够激活ERK1/ERK2、p38/MAPK、PI3K/AKT等与细胞增殖相关的通路,导致内皮功能紊乱,刺激血管内皮细胞的增殖和迁移[43-45],同时能刺激巨噬细胞合成并分泌炎性因子,促进炎症反应的发生,加快冠心病进展[46]。
炎性因子还能够通过Janus激酶2(JAK2)/信号转导和转录激活子3(STAT3)通路的介导,促进动脉内膜的增厚[47]。有研究发现,增加JAK2/STAT3信号通路介导的抗炎性因子可以消退动脉斑块[48]。STAT3还能够促进血管平滑肌细胞增殖迁移,从而导致冠心病的发生发展[49],因此,抑制IL-6/STAT3通路能够降低心血管疾病的风险[50]。血管内皮生长因子A(VEGFA)是一种特异性促血管生成因子,具有促进血管内皮细胞增殖分裂,刺激体内新生血管生成及增加血管通透性等多种功能[51-52],缺血缺氧、牵拉、炎性细胞因子等因素均促进血管内皮生长因子(VEGF)分泌,但其中最主要的是缺血缺氧[53]。正常人血清VEGF含量极低 ,但其在炎症、肿瘤等病理情况下显著升高。研究表明,梗死的心肌周围的血管平滑肌细胞、心肌和受损心肌中 VEGF基因均呈高表达[52,54]。一旦冠状动脉狭窄解除,血清VEGF水平迅速下降至正常[55]。由此可见,冠心病病人血清VEGF水平可作为了解冠状动脉病变程度和心肌缺血程度的敏感指标。
缺氧诱导因子-1α(HIF-1α)是生理和病理条件下维持人体氧稳态的关键调节因子,在缺氧条件下,HIF-1α能在其他大部分蛋白质合成下降时仍然可继续翻译,其主要在肾脏及心脏中高度表达,并在血管形成中起重要作用,其失调与缺血性疾病病理学有关[56]。
趋化因子8(CXCL8)参与炎性反应的发生[57],CXCL8可通过影响基质金属蛋白酶-9(MMP-9)从而促进细胞外基质降解以及血管平滑肌细胞的迁移[58-59]。基质金属蛋白酶(MMPs)可降解血管壁成分,其中MMP-9能够调节血管壁细胞表达和分泌,在内膜损伤和粥样病变形成过程中起关键作用。粥样斑块形成早期炎性细胞释放大量的细胞因子,刺激MMP-9的合成,同时导致斑块形成[60]。另外,CXCL8与MMPs两者相互作用,可增加彼此的生物活性[61-62],导致冠心病不断进展和恶化。c-Jun活化后可参与炎性细胞及内皮细胞内MMPs的蛋白合成和表达,从而导致粥样斑块的不稳定[63-65]。TNF-α也可促进c-Jun参与调节MMP-9的转录[66]。
分子对接结果显示,8-methoxy kaempferol与ALB具有良好的切合度。ALB是由肝脏产生的急性期蛋白,并参与急性和慢性炎症反应[67-68]。ALB能够抑制炎性因子,抑制血栓活性,是抑制血小板活化、聚集的主要抑制剂,从而发挥抗动脉粥样硬化的作用[69-70]。心血管内皮细胞发生损伤时,ALB的功能受炎性因子抑制,可能增加血液黏度并进一步影响内皮功能[71]。血清中的ALB具有强大的抗氧化特性,研究表明,在动脉粥样硬化发生发展中氧化应激发挥重要作用,能够抑制自由基的产生、脂质过氧化以及内皮细胞的凋亡[72-73]。因此,心血管疾病危险程度与ALB水平存在负相关,ALB 水平可以预测冠状动脉病变严重程度及疾病死亡风险[74]。各靶点密切联系,彼此促进,共同作用影响冠心病的发生发展进程。本研究通过GO、KEGG富集分析,获取葛兰心宁软胶囊与冠心病之间的潜在通路,最终获得与冠心病密切相关的通路主要是脂质和动脉粥样硬化通路。运用网络药理学对葛兰心宁软胶囊治疗冠心病的作用机制进行深入分析,有利于对传统中医药治疗冠心病知识的完善,促进中西医结合治疗冠心病的进一步发展和探索。
葛兰心宁软胶囊治疗冠心病的疗效显著,已得到临床研究证实。本研究通过网络药理学对葛兰心宁软胶囊治疗冠心病的有效成分、作用靶点和通路进行了预测和分析,为其治疗作用提供了理论基础。同时,还需要通过更多深入研究来验证这些理论,为葛兰心宁软胶囊治疗冠心病的疗效提供有力的科学依据。
参考文献:
[1] 胡凌云,雷娇,唐昕.血清GGT、ApoAⅠ、Visfatin与冠心病患者动脉粥样硬化程度的关系[J].中南医学科学杂志,2021,49(2):228-232.
[2] 段志豪,金璨,邓颖,等.基于网络药理学与实验验证探讨资木瓜治疗类风湿关节炎的作用机制[J].中国中药杂志,2023,48(18):4852-4863.
[3] 王阶,陈光.冠心病稳定型心绞痛中医诊疗专家共识[J].中医杂志,2018,59(5):447-450.
[4] NIESEN A D,JACOB A,LAW L,et al.Complication rate of ultrasound-guided paravertebral block for breast surgery[J].Regional Anesthesia & Pain Medicine,2020,45:813-817.
[5] 路广秀,包立道,张芳.葛根素对高脂血症患者靶器官功能的保护作用[J].中国临床研究,2017,30(2):165-167.
[6] 苏利霄,聂晓敏,周玉杰,等.葛兰心宁软胶囊对非ST段抬高型急性冠状动脉综合征患者介入术后内皮功能的影响[J].中国医药,2013,8(3):292-294.
[7] 梁姿国,夏丽华.葛兰心宁软胶囊治疗冠心病心绞痛的有效性和安全性[J].实用心脑肺血管病杂志,2014,22(11):50-51.
[8] 王阶,许军,李十红.葛兰心宁治疗冠心病心绞痛临床观察[J].中西医结合心脑血管病杂志,2006,4(3):203-206.
[9] 朱黎霞,王利胜,张英丰.丹参总酚酸、山楂总黄酮组分配伍对高脂血症大鼠血脂、超氧化物歧化酶及丙二醛的影响[J].中国医药导报,2014,11(20):9-12.
[10] 阎博,吴芳,刘海静,等.HPLC-ELSD法测定葛兰心宁软胶囊中绞股蓝皂苷XL IL的含量[J].安徽医药,2015,19(2):256-258.
[11] 雷婧,许韩婷,苏洁,等.不同含量绞股蓝皂苷对高脂血症大鼠血脂的影响[J].上海中医药大学学报,2014,28(2):60-64.
[12] 李东,刘承,姬晓兰.葛兰心宁软胶囊治疗冠心病合并2型糖尿病的临床疗效观察[J].中国医药,2013,8(4):464-466.
[13] 王阶,许军,温林军,等.葛兰心宁对冠心病心绞痛患者中医证候疗效及血管内皮功能的影响[J].中国医药学报,2004,19(10):595-597.
[14] 李锋,龙铟,姚锐,等.葛兰心宁软胶囊“心脑同治”疗效观察[J].现代中西医结合杂志,2013,22(34):3763-3765;3769.
[15] 周秀娟,程蕴琳,桂鸣,等.葛根素对冠心病心绞痛患者血浆内皮素及一氧化氮水平的影响[J].江苏医药,2000,26(7):524-525.
[16] YANAGISAWA M,KURIHARA H,KIMURA S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J].Nature,1988,332(6163):411-415.
[17] ISHIKAWA T,YANAGISAWA M,KIMURA S,et al.Positive inotropic action of novel vasoconstrictor peptide endothelin on guinea pig atria[J].Am J Physiol,1988,255(4 Pt 2):H970-973.
[18] 陈巍,刘亚平,刘逸非,等.冠心病病人氧化修饰低密度脂蛋白的测定及临床意义[J].江苏大学学报(医学版),2003,13(2):114-115.
[19] 管一平,刘志辉,钱薇.颈动脉、低密度脂蛋白预测冠状动脉粥样硬化性心脏病探讨[J].中国医药导报,2012,9(17):120-121;124.
[20] VGH E,KEREKES G,PUSZTAI A,et al.Effects of 1-year anti-TNF-α therapy on vascular function in rheumatoid arthritis and ankylosing spondylitis[J].Rheumatology International,2020,40(3):427-436.
[21] VAN DE VOORDE J,PAUWELS B,BOYDENS C,et al.Adipocytokines in relation to cardiovascular disease[J].Metabolism,2013,62(11):1513-1521.
[22] OHTA H,WADA H,NIWA T,et al.Disruption of tumor necrosis factor-alpha gene diminishes the development of atherosclerosis in ApoE-deficient mice[J].Atherosclerosis,2005,180(1):11-17.
[23] WEI Y Y,NAZARI-JAHANTIGH M,CHAN L,et al.The microRNA-342-5p fosters inflammatory macrophage activation through an Akt1-and microRNA-155-dependent pathway during atherosclerosis[J].Circulation,2013,127:1609-1619.
[24] BANERJEE S,CUI H C,XIE N,et al.miR-125a-5p regulates differential activation of macrophages and inflammation[J].The Journal of Biological Chemistry,2013,288(49):35428-35436.
[25] 洪永敦,黄衍寿,吴辉,等.冠心病中医证候与炎症因子关系的临床研究[J].广州中医药大学学报,2005,22(2):6.
[26] 王玉东,马广蕊,杨冬梅,等.糖、脂类、C反应蛋白与冠心病患者Gensini积分的相关性研究[J].标记免疫分析与临床,2016,23(12):1403-1405.
[27] 崔占前,俆延敏.白介素与急性冠脉综合征关系的研究进展[J].中国循证心血管医学杂志,2014,6(1):114-116.
[28] YUDKIN J S,KUMARI M,HUMPHRIES S E,et al.Inflammation,obesity,stress and coronary heart disease:is interleukin-6 the link?[J].Atherosclerosis,2000,148(2):209-214.
[29] HUANG H,ZENG Z,ZHANG L,et al.The association of interleukin-16 gene polymorphisms with susceptibility of coronary artery disease[J].Clinical Biochemistry,2013,46(3):241-244.
[30] SCHNUCH A,WESTPHAL G,MSSNER R,et al.Genetic factors in contact allergy-review and future goals[J].Contact Dermatitis,2011,64(1):2-23.
[31] 李俊涛,王高频.对动脉粥样硬化炎症机制认识的新进展[J].新医学,2009,40(11):762-764.
[32] DUBINSKI A,ZDROJEWICZ Z.The role of interleukin-6 in development and progression of atherosclerosis[J].Polski Merkuriusz Lekarski Organ Polskiego Towarzystwa Lekarskiego,2007,22(130):291-294.
[33] KOENIG W,KHUSEYINOVA N.Biomarkers of atherosclerotic plaque instability and rupture[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2007,27:15-26.
[34] WOODS A,BRULL D J,HUMPHRIES S E,et al.Genetics of inflammation and risk of coronary artery disease:the central role of interleukin-6[J].European Heart Journal,2000,21(19):1574-1583.
[35] IKEDA U,ITO T,SHIMADA K.Interleukin-6 and acute coronary syndrome[J].Clinical Cardiology,2001,24(11):701-704.
[36] GIGANTE B,STRAWBRIDGE R J,VELASQUEZ I M,et al.Analysis of the role of interleukin 6 receptor haplotypes in the regulation of circulating levels of inflammatory biomarkers and risk of coronary heart disease[J].PLoS One,2015,10(3):e0119980.
[37] AGUIRRE-GHISO J A,ESTRADA Y,LIU D,et al.ERK(MAPK) activity as a determinant of tumor growth and dormancy;regulation by p38(SAPK)[J].Cancer Research,2003,63(7):1684-1695.
[38] PASZEK M J,ZAHIR N,JOHNSON K R,et al.Tensional homeostasis and the malignant phenotype[J].Cancer Cell,2005,8(3):241-254.
[39] LI H,SONG F,DUAN L R,et al.Paeonol and danshensu combination attenuates apoptosis in myocardial infarcted rats by inhibiting oxidative stress:roles of Nrf2/HO-1 and PI3K/Akt pathway[J].Scientific Reports,2016,6:23693.
[40] CUENDA A,ROUSSEAU S.p38 MAP-Kinases pathway regulation,function and role in human diseases[J].Biochimica et Biophysica Acta(BBA)-Molecular Cell Research,2007,1773(8):1358-1375.
[41] VERGADI E,IERONYMAKI E,LYRONI K,et al.Akt signaling pathway in macrophage activation and M1/M2 polarization[J].The Journal of Immunology,2017,198:1006-1014.
[42] FANG C M,YU J A,LUO Y C,et al.Tsc1 is a critical regulator of macrophage survival and function[J].Cellular Physiology and Biochemistry,2015,36(4):1406-1418.
[43] MEHTA P K,GRIENDLING K K.Angiotensin Ⅱ cell signaling:physiological and pathological effects in the cardiovascular system[J].American Journal of Physiology Cell Physiology,2007,292(1):C82-C97.
[44] FUJITA Y,YOSHIZUMI M,IZAWA Y,et al.Transactivation of fetal liver kinase-1/kinase-insert domain-containing receptor by lysophosphatidylcholine induces vascular endothelial cell proliferation[J].Endocrinology,2006,147(3):1377-1385.
[45] MAEJIMA Y,UEBA H,KUROKI M,et al.Src family kinases and nitric oxide production are required for hepatocyte growth factor-stimulated endothelial cell growth[J].Atherosclerosis,2003,167(1):89-95.
[46] KUMAGAI T,MATSUKAWA N,KANEKO Y,et al.A lipid peroxidation-derived inflammatory mediator[J].Journal of Biological Chemistry,2004,279(46):48389-48396.
[47] CHITHRA P K,JAYALEKSHMY A,HELEN A.Petroleum ether extract of Njavara rice (Oryza sativa) bran upregulates the JAK2-STAT3-mediated anti-inflammatory profile in macrophages and aortic endothelial cells promoting regression of atherosclerosis[J].Biochemistry and Cell Biology,2017,95(6):652-662.
[48] WANG X,CHEN L H,LIU J,et al.In vivo treatment of rat arterial adventitia with interleukin 1β induces intimal proliferation via the JAK2/STAT3 signaling pathway[J].Molecular Medicine Reports,2016,13(4):3451-3458.
[49] 许爽,倪焕尔,陈航炜,等.STAT3与动脉粥样硬化的研究进展[J].医学新知,2020,30(5):383-388.
[50] WAINSTEIN M V,MOSSMANN M,ARAUJO G N,et al.Elevated serum interleukin-6 is predictive of coronary artery disease in intermediate risk overweight patients referred for coronary angiography[J].Diabetology & Metabolic Syndrome,2017,9:67.
[51] SATO K,WU T G,LAHAM R J,et al. Efficacy of intracoronary or intravenous VEGF165 in a pig model of chronic myocardial ischemia[J].Journal of the American College of Cardiology,2001,37(2):616-623.
[52] BANAI S,JAKLITSCH M T,SHOU M,et al.Angiogenic-induced enhancement of collateral blood flow to ischemic myocardium by vascular endothelial growth factor in dogs[J].Circulation,1994,89(5):2183-2189.
[53] FORSYTHE J A,JIANG B H,IYER N V,et al.Activation of vascular endothelial growth factor gene transcription by hypoxia-inducible factor 1[J].Molecular and Cellular Biology,1996,16(9):4604-4613.
[54] HASHIMOTO E,OGITA T,NAKAOKA T,et al.Rapid induction of vascular endothelial growth factor expression by transient ischemia in rat heart[J].American Journal of Physiology-Heart and Circulatory Physiology,1994,267(5):H1948-H1954.
[55] SEKO Y,IMAI Y,SUZUKI S,et al.Serum levels of vascular endothelial growth factor in patients with acute myocardial infarction undergoing reperfusion therapy[J].Clinical Science,1997,92(5):453-454.
[56] WIENER C M,BOOTH G,SEMENZA G L.In vivo expression of mRNAs encoding hypoxia-inducible factor 1[J].Biochemical and Biophysical Research Communications,1996,225(2):485-488.
[57] KHAZALI A S,CLARK A M,WELLS A.Inflammatory cytokine IL-8/CXCL8 promotes tumour escape from hepatocyte-induced dormancy[J].British Journal of Cancer,2018,118(4):566-576.
[58] ALDINUCCI A,BONECHI E,BIAGIOLI T,et al.CSF/serum matrix metallopeptidase-9 ratio discriminates neuro Behet from multiple sclerosis[J].Annals of Clinical and Translational Neurology,2018,5(4):493-498.
[59] FISHMAN D A,LIU Y,ELLERBROEK S M,et al.Lysophosphatidic acid promotes matrix metalloproteinase(MMP) activation and MMP-dependent invasion in ovarian cancer cells[J].Cancer Res,2001,61(7):3194-3199.
[60] POLANEN P J,KARHUNEN P J,MIKKELSSON J,et al.Coronary artery complicated lesion area is related to functional polymorphism of matrix metalloproteinase 9 gene[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2001,21(9):1446-1450.
[61] VIAFARA-GARCIA S M,GUALTERO D F,AVILA-CEBALLOS D,et al.Eikenella corrodens lipopolysaccharide stimulates the pro-atherosclerotic response in human coronary artery endothelial cells and monocyte adhesion[J].European Journal of Oral Sciences,2018,126(6):476-484.
[62] LIM R,BARKER G,LAPPAS M.Inhibition of PIM1 kinase attenuates inflammation-induced pro-labour mediators in human foetal membranes in vitro[J].Molecular Human Reproduction,2017,23(6):428-440.
[63] HUSSAIN S,ASSENDER J W,BOND M,et al.Activation of protein kinase Czeta is essential for cytokine-induced metalloproteinase-1,-3,and-9 secretion from rabbit smooth muscle cells and inhibits proliferation[J].Journal of Biological Chemistry,2002,277(30):27345-27352.
[64] CHANG L F,KARIN M.Mammalian MAP kinase signalling cascades[J].Nature,2001,410(6824):37-40.
[65] 林海燕,王红梅,祝诚.转化生长因子-β对基质金属蛋白酶及其组织抑制因子调控的研究进展[J].生物化学与生物物理进展,2003,30(1):7-12.
[66] CHO A,GRAVES J,REIDY M A.Mitogen-activated protein kinases mediate matrix metalloproteinase-9 expression in vascular smooth muscle cells[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2000,20(12):2527-2532.
[67] NICHOLSON J P,WOLMARANS M R,PARK G R.The role of albumin in critical illness[J].British Journal of Anaesthesia,2000,85(4):599-610.
[68] QUINLAN G J,MARTIN G S,EVANS T W.Albumin:biochemical properties and therapeutic potential[J].Hepatology,2005,41(6):1211-1219.
[69] MIKHAILIDIS D P,BARRADAS M A,MARIS A,et al.Fibrinogen mediated activation of platelet aggregation and thromboxane A2 release:pathological implications in vascular disease[J].Journal of Clinical Pathology,1985,38(10):1166-1171.
[70] MIKHAILIDIS D P,GANOTAKIS E S.Plasma albumin and platelet function:relevance to atherogenesis and thrombosis[J].Platelets,1996,7(3):125-137.
[71] KARAHAN O,ACET H,ERTA瘙塁 F,et al.The relationship between fibrinogen to albumin ratio and severity of coronary artery disease in patients with STEMI[J].Am J Emerg Med,2016,34(6):1037-1042.
[72] AKSOY S,CAM N,GURKAN U,et al.Oxidative stress and severity of coronary artery disease in young smokers with acute myocardial infarction[J].Cardiology Journal,2012,19(4):381-386.
[73] GOLDWASSER P,FELDMAN J.Association of serum albumin and mortality risk[J].Journal of Clinical Epidemiology,1997,50(6):693-703.
[74] EXNER M,MLEKUSCH W,AMIGHI J,et al.Serum albumin predicts cardiac adverse events in patients with advanced atherosclerosis-interrelation with traditional cardiovascular risk factors[J].Thrombosis and Haemostasis,2004,91(3):610-618.
(收稿日期:2023-06-26)
(本文编辑王丽)