电子束辐照对西藏荨麻主要活性成分及灭菌效果的影响△
2024-04-29张赫林谢和兵王弼聪尼玛次仁白玛旦增
张赫林,谢和兵,4*,王弼聪,尼玛次仁,白玛旦增
1.安徽中医药大学 药学院,安徽 合肥 230012;2.长三角药物高等研究院,江苏 南通 226133;3.江苏神猴医药研究有限公司,江苏 南通 226000;4.西藏神猴药业有限责任公司,西藏 日喀则 857000;5.北京神州数码有限公司 北京 100080
西藏荨麻Urtica tibeticaW.T.Wang 的藏族药(以下简称藏药)名为萨真、萨珠,多分布于西藏、青海海拔3400~4800 m 的山坡草地。西藏荨麻的药用价值在藏族医(以下简称藏医)古籍《晶珠本草》《藏药志》中均有记载[1-2],并被收载于《中华人民共和国卫生部药品标准·藏药:第一册》1995 年版[3],具有祛风定惊、温胃消食的作用,用于“龙”病引起的久热、消化不良。现代研究表明,西藏荨麻具有降尿酸、抑制前列腺炎、抗前列腺增生、降血糖等药理作用[4-6]。西藏荨麻还具有食用价值,含有丰富的蛋白质和维生素,其茎叶是天然绿色植物蛋白质来源,西藏当地百姓自古以来就有采集嫩茎叶作蔬菜食用的传统习俗,在藏族群众中被誉为“西藏人参”。因此,西藏荨麻作为一种高原特有的药食两用藏药,具有重要的应用价值。
西藏荨麻药材一般采用晒干、晾干的炮制工艺,其微生物水平无法得到有效控制,导致药材在储存过程中易发生霉变。辐照灭菌技术作为一种绿色、高效的冷杀菌技术[7],与传统灭菌方法相比,具有低温,高效,能最大限度保持药材性状、活性成分及药理活性等优点。钴-60辐照及高能电子加速器辐照是目前主要采用的辐照灭菌方式,与钴-60 辐照相比,电子束辐照技术具有投入成本更低、加工效率高、不产生核废物、无环境污染等优点[8-10]。因此,本研究以药材的性状、主要指标成分含量、指纹图谱相似度及微生物水平为综合评价指标,考察不同剂量的电子束辐照对药材的主要活性成分和灭菌效果的影响,旨在探究电子束辐照应用于西藏荨麻药材灭菌的适用性,为西藏荨麻药材及其制剂的辐照灭菌提供参考,也为含热不稳定性成分的藏药的辐照灭菌提供参考。
1 材料
1.1 样品
西藏荨麻药材来源于西藏神猴药业有限责任公司,经江苏神猴医药研究有限公司副主任藏药师尼玛次仁鉴定为荨麻科植物西藏荨麻Urtica tibeticaW.T.Wang。
1.2 试药
对照品芦丁(批号:100080-202012,纯度:92.2%)、绿原酸(批号:110753-202119,纯度:96.3%)、紫云英苷(批号:100081-201610,纯度:99.02%)、异牡荆苷(批号:112098-202201,纯度:97.4%)购自中国食品药品检定研究院;无水氯化铝(批号:20211020)、亚硝酸钠(批号:20210519)、氢氧化钠(批号:20210220)、无水乙醇(批号:20220321,分析纯)、磷酸(批号:20210906,分析纯)、三乙胺(批号:C13683716,分析纯)、甲醇(批号:20220608,色谱纯)、乙腈(批号:20220128,色谱纯)均购自国药集团化学试剂有限公司;超纯水(自制)。
1.3 仪器
UV-1900 型紫外-可见分光光度计、EssentiaLC-16 型高效液相色谱仪均购于岛津仪器有限公司;XSR205DU/AC 型十万分之一分析天平(美国梅特勒托利多科技有限公司);JA10003N 型千分之一电子天平、UC-250DE 型超声清洗仪均购于上海精其仪器有限公司;HH-6型数显恒温水浴锅(上海力辰邦仪器科技有限公司);20B 型高效万能粉碎机(常州市强迪干燥设备有限公司);DX-10/20 型电子加速器[中广核戈瑞(深圳)科技有限公司];CR9 型分光色差仪(配粉末测试盒,深圳市三恩时科技有限公司);Synergy UV 型纯水仪(默克密理博公司)。
2 方法与结果
2.1 辐照样品制备
取西藏荨麻药材适量,粉碎过六号筛,分装于PET 样品瓶中,每瓶12 g,共30 瓶,分成6 组,分别采用0、2、4、6、8、10 kGy 的剂量进行电子束辐照处理。
2.2 性状比较
招募无鼻炎、无感冒鼻塞症状的志愿者30 名,通过双盲鼻嗅打分的方式判断辐照前后气味的变化[11],设定新打粉制备的荨麻药材粉末为5分,每位志愿者对每组不同剂量辐照样本进行1~9 分打分,主要依据气味的浓淡和杂味打分,气味无变化打分5分,气味变淡打分1~4分,气味变浓及有杂味打分5~9 分。运用SPSS 26.0 分析软件进行数据计算处理,两组间比较采用成对样本t检验,P<0.05 为差异有统计学意义。然后采用分光色差仪,对仪器黑白板校正后进行测定,并记录样品粉末的亮度(L*)、红绿度(a*)、黄蓝度(b*)值为指标。根据公式(1)计算总色差(ΔE),比较辐照前后样品的色泽的变化,ΔE<0.5视为微小色差,无统计学意义。
式中,ΔL*、Δa*、Δb*分别为西藏荨麻粉末辐照前后的差值。
结果表明,双盲多人次鼻嗅2、4、6、8、10 kGy剂量辐照后西藏荨麻粉末与未辐照样品分值差异无统计学意义。辐照后样品粉末的ΔE分别为0.43±0.06、0.40±0.09、0.42±0.13、0.40±0.07、0.45±0.15,色泽未有显著变化,见图1。

图1 不同辐照剂量西藏荨麻粉末样品色泽
2.3 总黄酮的含量测定
2.3.1 溶液制备 对照品溶液的制备:精密称取芦丁对照品10.00 mg,加入30%乙醇定容至100 mL量瓶中,得到质量浓度为92.20 μg·mL-1的对照品储备液。精密吸取对照品储备液2 mL 至10 mL 棕色量瓶中,进行显色操作(加入5%亚硝酸钠溶液0.4 mL,摇匀,静置6 min,加入10%三氯化铝溶液0.4 mL,摇匀,静置6 min,再加入4%氢氧化钠溶液4 mL 并用30%乙醇定容至刻度,摇匀,静置15 min),即得对照品溶液。
供试品溶液的制备:称取西藏荨麻细粉约2 g,置于锥形瓶中,加入30%乙醇30 mL,超声(功率250 W,频率40 kHz)处理60 min,放冷,再称定质量,用30%乙醇补足减失的质量,放冷抽滤,滤液转移至50 mL 量瓶中,用30%乙醇定容至刻度,摇匀,即得供试品储备液。精密吸取供试品储备液3 mL 至10 mL 棕色量瓶中,显色操作同对照品溶液,即得供试品溶液。
空白溶液的制备:精密吸取30%的乙醇溶液3 mL 至10 mL 棕色量瓶中,显色操作同对照品溶液,即得空白溶液。
2.3.2 检测波长的选择 取2.3.1 项下对照品溶液、供试品溶液和阴性样品溶液,用紫外-可见分光光度计在400~800 nm进行全波长测定。结果显示对照品溶液和供试品溶液在510 nm处有最大的吸收,阴性样品溶液无吸收,因此,选择检测波长为510 nm。
2.3.3 线性关系考察 精密吸取2.3.1 项下的对照品储备液0.5、1.0、2.0、3.0、4.0、5.0 mL至10 mL棕色量瓶中,按2.3.1 项下的方法制备不同浓度的对照品溶液,在波长510 nm 处测定吸光度,以芦丁的质量浓度为横坐标(X)、吸光度为纵坐标(Y),绘制标准曲线并进行回归分析,线性回归方程为Y=0.013 1X+0.004(r=0.999 9),表明芦丁质量浓度为4.61~46.10 μg·mL-1时线性关系良好。
2.3.4 精密度试验 取2.3.1 项下的对照品溶液,在波长510 nm 处测定吸光度,连续测定6 次,测得吸光度的RSD为0.03%,表明仪器精密度良好。
2.3.5 稳定性试验 按2.3.1 项下方法各制备1 份对照品溶液和供试品溶液分别于0、20、40、80、100、120 min 时在波长510 nm 处测定吸光度,测得对照品溶液、供试品溶液吸光度RSD分别为0.33%、0.53%,表明对照品和供试品溶液120 min内稳定。
2.3.6 重复性试验 按2.3.1 项下方法制备6 份供试品溶液,在波长510 nm 处测定吸光度,测得6 份供试品溶液吸光度RSD 为0.77%,表明方法重复性良好。
2.3.7 加样回收率试验 精密吸取已知含量的供试品储备液1.5 mL 和2.3.1 项下的对照品储备溶液2 mL 于同一10 mL 棕色量瓶中,平行制备6 份,显色操作同2.3.1 项下的对照品溶液,在波长510 nm处测定吸光度,每份连续测定2 次,平均吸光度代入2.3.3 项下的线性方程,计算含量、平均加样回收率和RSD,结果见表1。
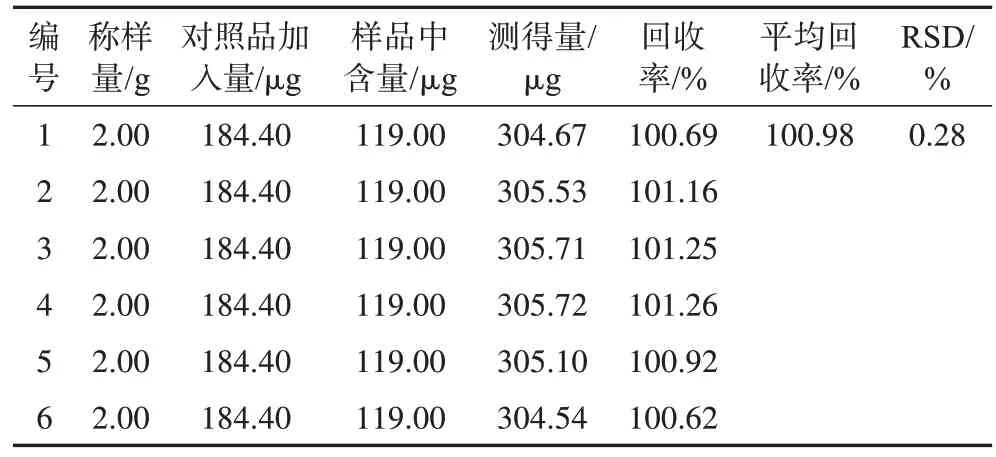
表1 西藏荨麻样品的总黄酮加样回收试验结果
2.3.8 辐照样品含量测定 取不同剂量辐照后的西藏荨麻细粉约2 g,每个样品平行称取3 份,按2.3.1 项下方法制备供试品溶液,测定吸光度,代入2.3.3 项下的线性方程,计算总黄酮的含量。运用SPSS 26.0 分析软件进行数据计算处理。两组间比较采用成对样本t检验,P<0.05 为差异有统计学意义。结果显示,不同剂量辐照后西藏荨麻粉末中总黄酮含量与辐照前差异无统计学意义(表2)。
表2 不同辐照剂量西藏荨麻样品总黄酮质量分数(,n=3)
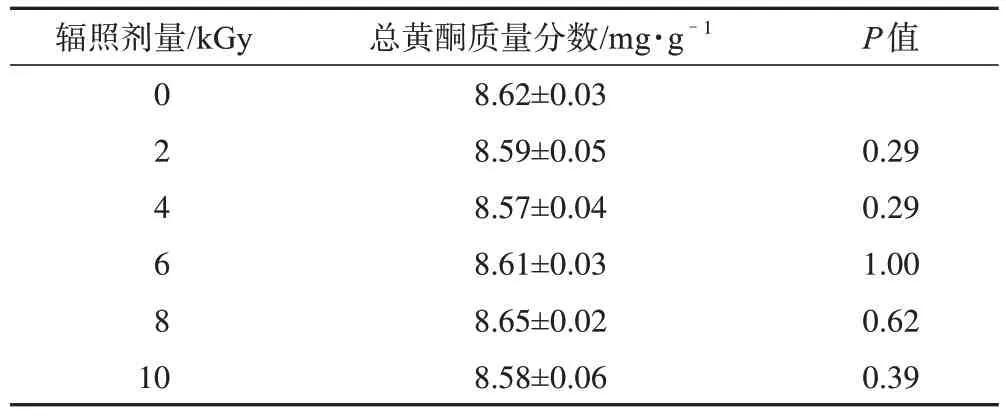
表2 不同辐照剂量西藏荨麻样品总黄酮质量分数(,n=3)
2.4 绿原酸、异牡荆苷、紫云英苷的含量测定
2.4.1 溶液制备 对照品溶液的制备:分别精密称取绿原酸20.18 mg 置10 mL 量瓶中,异牡荆苷9.30 mg、紫云英苷9.81 mg 置50 mL 量瓶中,分别加入30%乙醇充分溶解定容,得各对照品储备液。分别精密吸取绿原酸对照品储备液8 mL、异牡荆苷对照品储备液10 mL、紫云英苷对照品储备液10 mL,置同一50 mL 量瓶中,加30%乙醇定容至刻度,得混合对照品储备液。
供试品溶液的制备:称取西藏荨麻样品细粉约2 g,置于锥形瓶中,加入30%乙醇30 mL,称定质量,超声(功率250 W,频率40 kHz)处理60 min,放冷,再称定质量,用30%乙醇溶液补足减失的质量,摇匀,抽滤,滤液置蒸发皿中60 ℃水浴蒸干,加入30%乙醇5 mL 溶解转移至10 mL 量瓶中,用30%乙醇定容,摇匀,0.45 μm 微孔滤膜过滤,即得供试品溶液[12]。
阴性样品溶液的制备:不加西藏荨麻细粉,其余操作同供试品溶液的制备方法制得阴性样品溶液。
2.4.2 色谱条件 采用ULtimate XB-C18液相色谱柱(250 mm×4.6 mm,5 μm);流动相为0.2%磷酸-0.2%三乙胺水溶液(A)-乙腈(B),梯度洗脱(0~5 min,12%~13%B;5~22 min,13%~15%B;22~40 min,15%~35%B;40~50 min,35%~55%B);检测波长:360 nm;柱温:30 ℃;流速:1.0 mL·min-1;进样量:20 μL。
2.4.3 系统适用性试验 分别吸取2.4.1项下混合对照品储备液、供试品溶液、阴性样品溶液各20 μL,按2.4.2 项下色谱条件进样测定,记录色谱图,结果见图2。供试品和对照品溶液的保留时间一致,且绿原酸、异牡荆苷、紫云英苷的色谱的分离度>1.5,拖尾因子为0.95~1.05,理论板数>3000,阴性样品溶液在目标峰处无干扰,表明该方法的专属性良好。

图2 供试品、混合对照品、阴性样品的HPLC图
2.4.4 线性关系考察 取2.4.1 项下混合对照品储备 液0.5、1.0、2.0、4.0、6.0、8.0、10.0 mL,分别置于10 mL 量瓶中,30%乙醇定容,配制成绿原酸、异牡荆苷和紫云英苷质量浓度分别为15.55~311.00、1.85~37.00、1.94~38.80 μg·mL-1的混合对照品溶液,按2.4.2 项下色谱条件进样测定,以3个指标成分的质量浓度(X)为横坐标、峰面积(Y)为纵坐标,绘制标准曲线并进行回归分析,得到绿原酸的回归方程为Y=16 540X+2 158.4(r=0.999 9),异牡荆苷的回归方程为Y=65 044X-5 412.1(r=0.999 9),紫云英苷的回归方程为Y=65 150X+4 113.2(r=0.999 9),表明线性良好。
2.4.5 精密度试验 取2.4.1 项下供试品溶液,按2.4.2 项下色谱条件连续进样6 次,绿原酸、异牡荆苷和紫云英苷峰面积的RSD 分别为0.20%、0.69%、0.71%,表明仪器精密度良好。
2.4.6 稳定性试验 重新按照2.4.1 项下方法制备供试品溶液,室温下分别于0、2、4、8、12、16、20、24 h 按2.4.2 项下色谱条件进样测定,绿原酸、异牡荆苷和紫云英苷峰面积的RSD 分别为1.33%、1.50%、1.40%,表明供试品溶液24 h内稳定。
2.4.7 重复性试验 重新按2.4.1 项下方法平行制备供试品溶液6 份,按2.4.2 项下色谱条件进样测定,绿原酸、异牡荆苷和紫云英苷含量的RSD 分别为1.64%、3.09%、2.23%,表明方法重复性良好。
2.4.8 加样回收率试验 称取已知含量的西藏荨麻粉末约2 g,平行称取6 份,分别加入绿原酸对照品储备液0.3 mL、异牡荆苷对照品储备液0.1 mL、紫云英苷对照品储备液0.1 mL,按2.4.1 项下方法制备供试品溶液,2.4.2 项下色谱条件测定,每份连续测定2 次,计算绿原酸、异牡荆苷和紫云英苷的平均加样回收率和RSD,结果见表3。
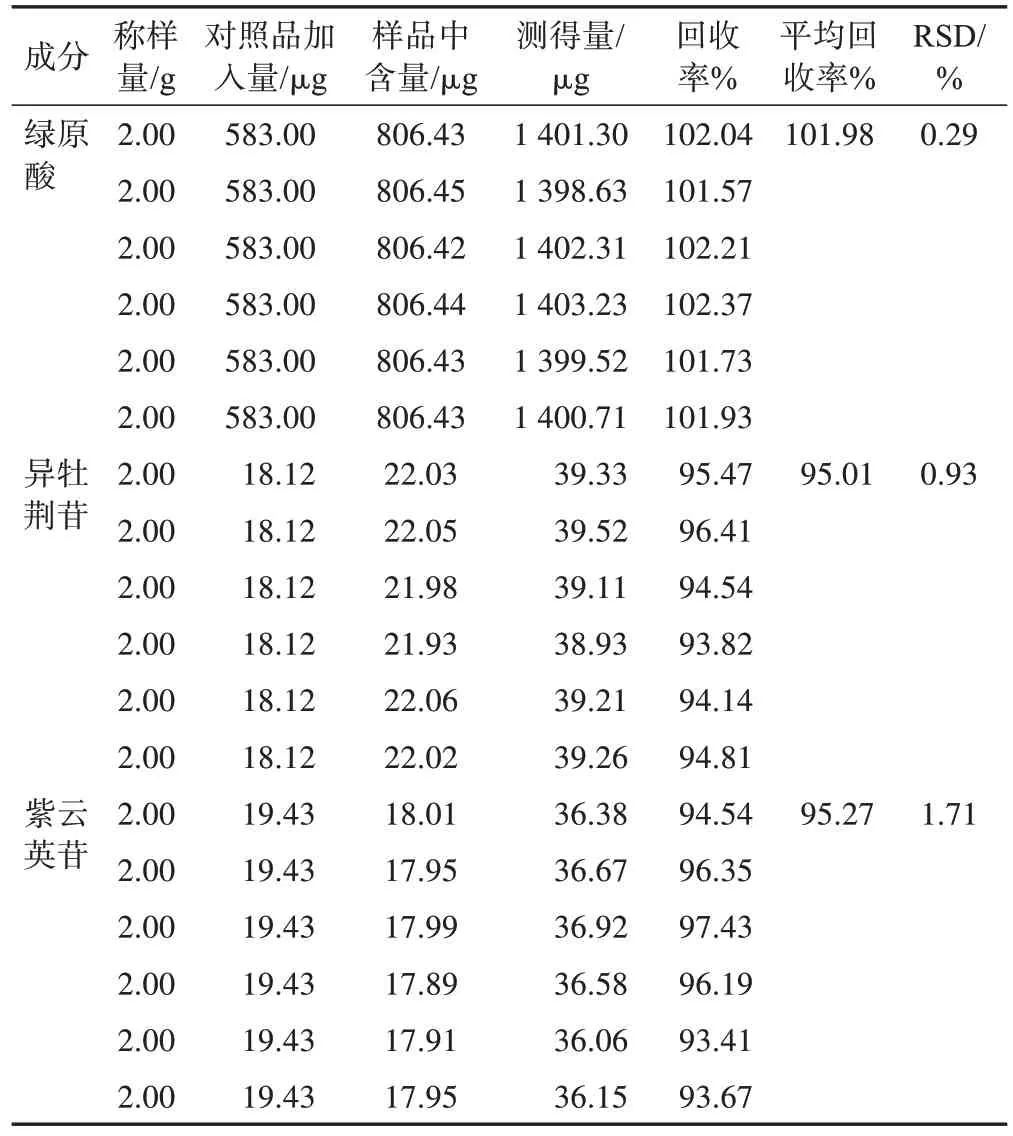
表3 绿原酸、异牡荆苷和紫云英苷加样回收率实验结果
2.4.9 辐照样品含量测定 分别称取不同辐照剂量的西藏荨麻粉末约2 g,每个样品平行称取3 份,按2.4.1 项下方法处理样品,按2.4.2 项下色谱条件测定,计算绿原酸、异牡荆苷、紫云英苷的含量。
采用SPSS 26.0 分析软件进行数据计算处理。以辐照前的样品(辐照剂量为0 kGy)为对照,两组间比较采用成对样本t检验,P<0.05 为差异有统计学意义。结果显示,2~10 kGy 不同剂量辐照后西藏荨麻粉末中绿原酸、异牡荆苷、紫云英苷含量与辐照前差异无统计学意义,结果见表4。
表4 不同辐照剂量西藏荨麻样品中指标成分质量分数测定实验结果(,n=3)
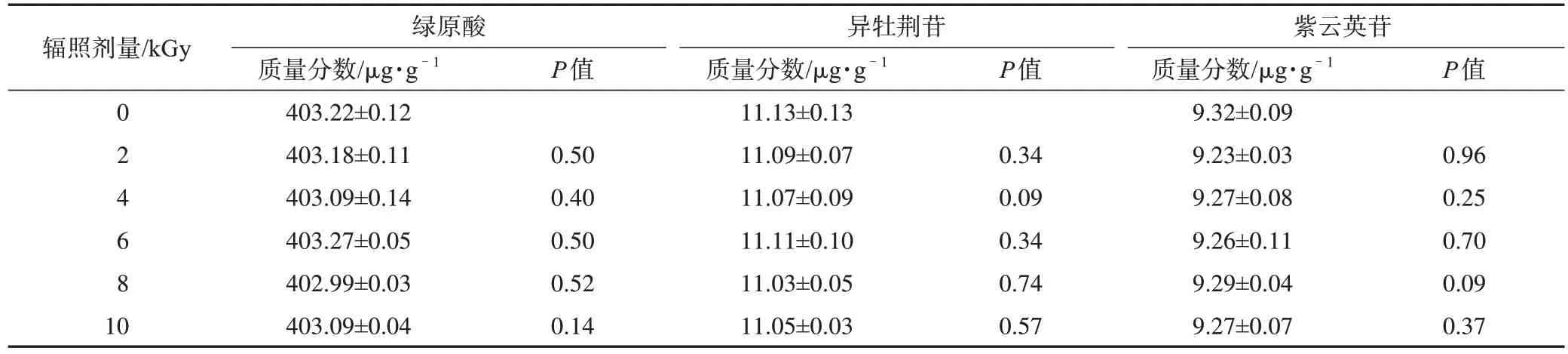
表4 不同辐照剂量西藏荨麻样品中指标成分质量分数测定实验结果(,n=3)
2.5 指纹图谱相似度评价
采用“中药色谱指纹图谱相似度评价系统”(2012版)处理色谱图,以0 kGy样品色谱图为参照,经过多点校正、全谱峰匹配,生成对照图谱,并计算相似度[13-14]。结果所有样品间相似度均不低于0.997,共有峰保留时间的RSD均小于2.0%(图3、表5)。
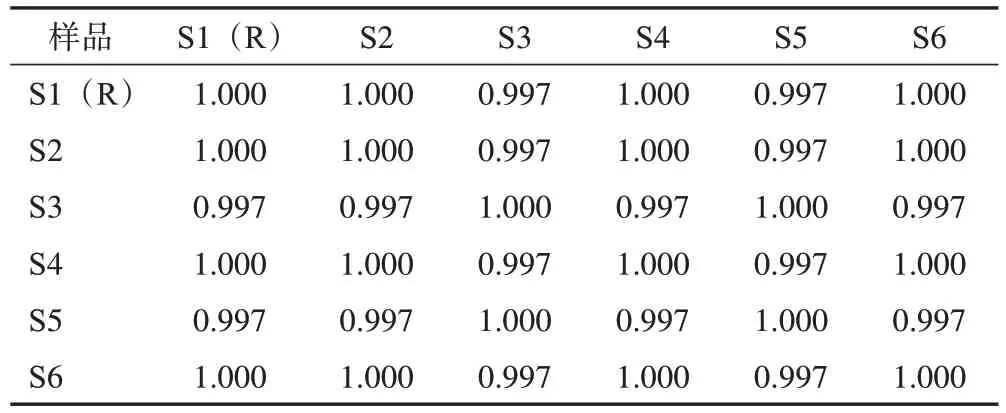
表5 不同辐照剂量西藏荨麻样品HPLC相似度评价

图3 不同辐照剂量西藏荨麻样品HPLC叠加图谱
2.6 微生物检查
按《中华人民共和国药典》(以下简称《中国药典》)2020年版(四部)通则[通则1105(微生物计数法)、通则1106(控制菌检查法)及通则1107(非无菌药品微生物限度标准)][15]检查电子加速辐照前后西藏荨麻粉末细菌菌落总数、霉菌酵母菌菌落总数、大肠埃希菌的变化,每个样品平行检测3次[16]。运用SPSS 26.0 分析软件进行数据计算处理。两组间比较采用成对样本t检验,P<0.05 为差异有统计学意义。结果显示,辐照后西藏荨麻粉末样品细菌菌落总数、霉菌酵母菌落总数均较辐照前显著下降(P<0.01)。当辐照剂量达到6 kGy时,微生物水平符合《中国药典》2020 年版规定,当辐照剂量为8 kGy 时,霉菌及酵母菌均已无法检出,当辐照剂量为10 kGy 时,霉菌、酵母菌及细菌菌落总数均未检出(表6)。
表6 西藏荨麻粉末微生物限度检查结果(,n=3)

表6 西藏荨麻粉末微生物限度检查结果(,n=3)
注:与0 kGy辐照剂量比较,**P<0.01;ND表示未检出。
3 讨论
3.1 指标成分的选择
国内外对荨麻属植物化学成分进行了大量的研究,结果表明该植物含有黄酮类、有机酸、甾类、香豆素、木脂素[17-21]等成分,其中黄酮类、有机酸类成分为荨麻的主要药效成分,具有抗炎、抗菌、抗氧化、抗前列腺增生、免疫调节、促进肠道平滑肌收缩[22-27]等药理活性。已有文献报道了荨麻属麻叶荨麻中含有异牡荆苷、异槲皮苷、紫云英苷、槲皮苷、阿福豆苷等黄酮苷[28],其中异牡荆苷、紫云英苷均是天然植物黄酮碳苷类化合物,目前较多的研究表明其具有抗炎、抗氧化、抗肿瘤等多种药理作用[29-30],这2 个成分在抗消化系统炎症疾病、抗肿瘤方面具有显著的疗效[31-33],与西藏荨麻在藏医古籍中记载的用途及藏医临床用药实践经验相吻合。因此,本研究选用总黄酮,黄酮单体异牡荆苷、紫云英苷和绿原酸作为代表性指标成分。
3.2 灭菌方式的选择
本研究尝试了通过湿热、干热的灭菌方式控制药材的微生物水平,结果发现热灭菌处理后西藏荨麻的色泽、气味、总黄酮含量发生明显的变化,这与西藏荨麻中富含的有机酸、黄酮类化合物的热不稳定性有关。黄酮类化合物在植物体中通常与糖结合成苷类,小部分以游离态(苷元)的形式存在。在加热条件下,一方面,黄酮苷会脱去苷类配基变成黄酮或黄酮醇[34];另一方面,西藏荨麻黄酮类化合物的分子结构中存在酮式羰基、酚羟基,具有强还原性,而西藏荨麻中富含的有机酸具有强氧化性,在加热条件下,发生氧化还原反应,导致黄酮A 环与B 环脱离,降低黄酮含量[35-36]。此外,西藏荨麻中的绿原酸等有机酸,具有抗炎、抗氧化等作用,但热稳定性较差,因此,西藏荨麻药材不适用于热灭菌处理。相较于传统的热灭菌技术,辐照灭菌最大的优势在于其是一种冷灭菌技术,在食品、农产品中使用广泛,近年来逐步推广到中药灭菌[37-41],尤其适用于含挥发性、热不稳定性成分的灭菌。因此,本研究选择了电子束辐照灭菌。
3.3 指标成分含量测定及指纹图谱的研究
本研究不但通过高效液相色谱法(HPLC)同时测定绿原酸、异牡荆苷、紫云英苷的含量,还对绿原酸、异牡荆苷、紫云英苷的色谱峰的前后峰进行了定性鉴别,结果发现,绿原酸色谱峰的前后分布了新绿原酸、隐绿原酸、咖啡酸等色谱峰,异牡荆苷、紫云英苷色谱峰周边可能分布了山柰酚-7-O-鼠李糖苷、异槲皮苷、槲皮苷、阿福豆苷等色谱峰,为建立西藏荨麻药材的指纹图谱提供参考,但相关色谱峰确证、定量测定等研究工作需进一步开展。
4 结论
2~10 kGy 吸收剂量的电子束辐照对西藏荨麻药材性状,总黄酮、绿原酸、异牡荆苷、紫云英苷含量,以及指纹图谱均无显著影响,且当辐照剂量达到6 kGy 时,微生物水平符合《中国药典》2020 年版规定,为西藏荨麻药材及其制剂的辐照灭菌提供了参考。本研究建立了紫外法测定西藏荨麻中总黄酮含量,以及HPLC 同时测定绿原酸、异牡荆苷、紫云英苷的含量测定方法,为西藏荨麻药材的质量标准提升提供了参考。
[利益冲突]本文不存在任何利益冲突。
