血液肿瘤相关性噬血细胞综合征的病因分布及预后
2024-04-29孙红启黄闪史利欢刘炜
孙红启,黄闪,史利欢,刘炜
(郑州大学附属儿童医院,河南省儿童医院 1.郑州市儿童感染与免疫重点实验室;2.血液肿瘤科,郑州 450018)
噬血细胞综合征(hemophagocytic syndrome,HPS)是由于细胞毒性T细胞和自然杀伤(natural killer,NK)细胞过度活化,产生细胞因子风暴,引发多脏器损害的危重疾病。HPS进展快、病情凶险,多表现为高热、血小板减少、凝血异常、肝脾肿大等。原发性HPS存在常染色体隐性或性染色体连锁遗传,继发性HPS是指由于感染、恶性肿瘤、自身免疫性疾病或药物等因素诱导的HPS[1]。血液系统恶性肿瘤特别是淋巴瘤为继发性HPS常见诱因之一,但因其病因隐匿,常出现漏诊。为提高对该疾病的认识,本文对2015年1月至2019年7月临床诊断的13例血液肿瘤相关性HPS的临床资料进行回顾性分析。
1 材料与方法
1.1 研究对象
回顾分析郑州大学附属儿童医院2015年1月至2019年7月收治的13例血液肿瘤相关HPS患儿的临床资料。入选标准:(1)均确诊血液系统恶性肿瘤性疾病;(2)均符合国际组织细胞协会制定的“噬血细胞综合征2004指南”标准(简称HLH-2004)[2]。排除标准:(1)无血液系统恶性肿瘤性疾病;(2)伴自身风湿免疫性疾病。本研究获得医院伦理委员会审核批准。
1.2 方法
1.2.1 临床资料:收集患儿发病时基本资料、治疗经过及预后情况。发病时症状包括体温、皮疹、淋巴结及肝脾肿大情况、水肿、神经系统症状等;实验室检查包括血常规、肝肾功能、电解质、心肌酶、免疫球蛋白、淋巴细胞亚群、凝血四项、血脂、血清铁蛋白、NK细胞活性、可溶性CD25、血清病毒学、脑脊液、骨髓细胞学、EB病毒DNA、巨细胞病毒DNA等;淋巴瘤患儿行骨髓活检、组织学病理检查;影像学检查包括颈部+腹部彩超、CT、颅脑MRI、PET/CT等。
1.2.2 治疗:淋巴瘤诱导的HPS明确病因前参考国际组织细胞学会制定的HLH-2004方案,包括糖皮质激素、依托泊苷,明确相关淋巴瘤诊断后给予淋巴瘤标准化疗。化疗期合并的HPS给予糖皮质激素冲击治疗,证实存在病毒感染或细菌感染者,给予抗病毒或抗感染治疗。对症治疗包括输注丙种球蛋白、输血、保肝、止血、退热及注射集落刺激因子等。
1.2.3 随访:每月通过电话或门诊随访,随访时间自化疗结束开始,末次随访时间截止到2020年6月,或任何原因所致死亡时间。
1.3 统计学分析
采用SPSS 26.0统计软件进行统计分析,正态分布计量资料以±s表示,组间比较采用t检验;非正态分布计量资料以M(P25~P75)表示,组间比较采用非参数检验;计数资料以率(%)表示。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料及原发病因分类
13例患儿中,男8例(61.54%),女5例(38.46%),男女比例为1.6∶1,年龄2~13岁,中位年龄为3.00岁。原发病分类:EB+T细胞淋巴瘤6例(46.15%),6例均存在EB病毒感染,其中1例合并巨细胞病毒感染,1例合并重症肺炎;间变大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)4例(30.77%),2例合并肺炎支原体感染;急性髓系白血病(acute myeloid leukemia,AML)1例(7.69%),合并曲霉菌肺炎;急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)1例(7.69%),合并大肠杆菌败血症;皮下脂膜炎样T细胞淋巴瘤(subcutaneous panniculitis-like T-cell lymphoma,SPTCL)1例(7.69%),合并单纯疱疹病毒感染。EB+T细胞淋巴瘤和ALCL相关HPS为淋巴瘤诱导的HPS,AML、ALL和SPTCL相关的HPS为化疗后免疫抑制由真菌、细菌和病毒诱导下出现的化疗期合并的HPS。
2.2 临床表现及实验室检查结果
2.2.1 临床表现:持续高热(体温>38.5℃)患儿13例(100%),颈部淋巴结肿大12例(92.31%),肝脏肿大12例(92.31%),脾脏肿大11例(84.62%),皮下出血点及瘀斑4例(30.77%),皮疹3例(23.08%),咳嗽3例(23.08%),黄疸1例(7.69%)。
2.2.2 实验室检查结果:中性粒细胞减少10例(76.92%),贫血12例(92.31%),血小板减少13例(100%),纤维蛋白原降低11例(84.62%)、甘油三酯升高12例(92.31%),铁蛋白≥500 μg/L 13例(100%),谷丙转氨酶>80 U/L 12例(92.31%),可溶性CD25≥2400U/mL 12例(92.31%),NK细胞活性降低13例(100%),骨髓可见吞噬现象12例(92.31%)。见表1。
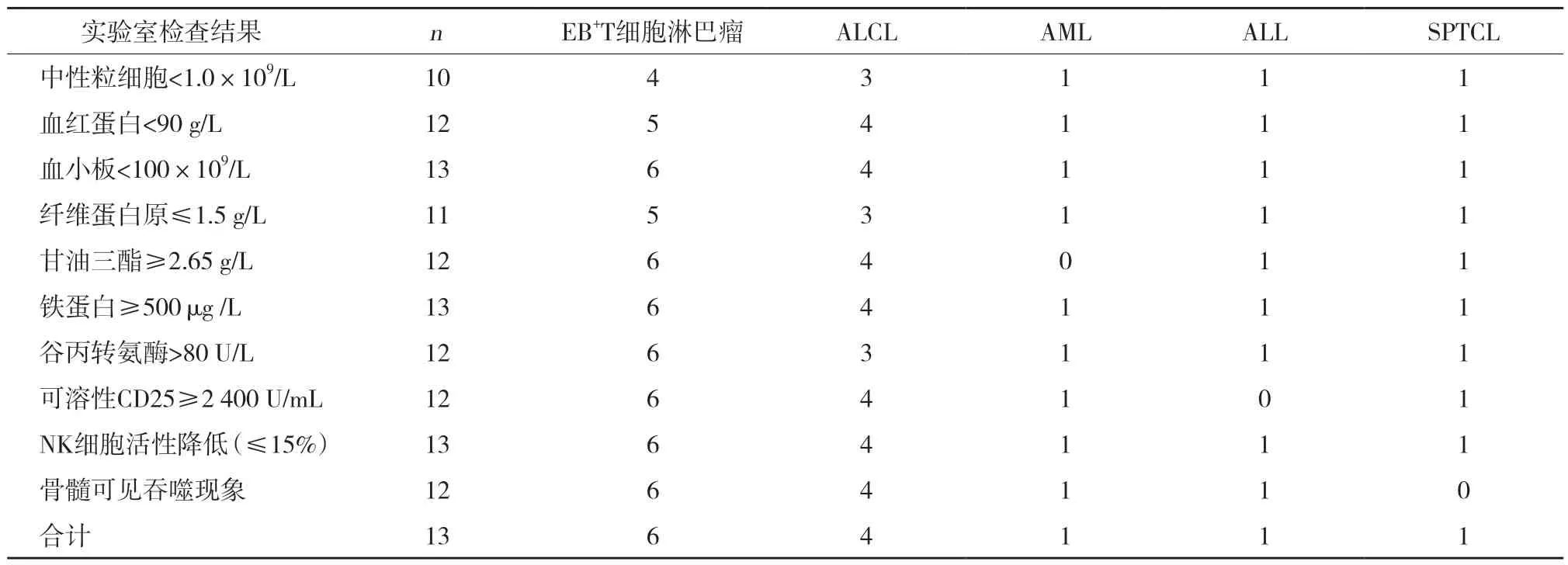
表1 血液肿瘤相关的HPS患儿实验室检查结果
2.3 治疗方案及预后
2.3.1 HPS治疗方案:淋巴瘤诱导的HPS均采用糖皮质激素[甲强龙10 mg/(kg·d)、地塞米松10 mg/(m2·d)]+依托泊苷100 mg/(m2·次)+丙种球蛋白400 mg/(kg·d)治疗;化疗期合并的HPS均采用糖皮质激素[甲强龙10 mg/(kg·d)、地塞米松10 mg/(m2·d)]+丙种球蛋白400 mg/(kg·d)治疗。
2.3.2 病因治疗及对症治疗:EB+T细胞淋巴瘤及SPTCL采用SMILE(甲氨蝶呤+地塞米松+依托泊苷+门冬酰胺酶+异环磷酰胺)方案化疗;ALCL采用CourseAV1(地塞米松+甲氨蝶呤+异环磷酰胺+阿糖胞苷+依托泊苷+长春花碱)方案化疗;ALL采用VDLP(长春新碱+柔红霉素+泼尼松+培门冬酶)方案化疗;AML采用DAH(阿糖胞苷+柔红霉素+高三尖杉酯碱)方案化疗。粒细胞<0.5×109/L给予重组人粒细胞集落刺激因子,血红蛋白<65 g/L输注同型红细胞悬液,血小板<20×109/L输注同型单采血小板,活化部分凝血活酶时间明显延长者输注同型病毒灭活血浆,纤维蛋白原<0.6 g/L输注同型冷沉淀。见表2。
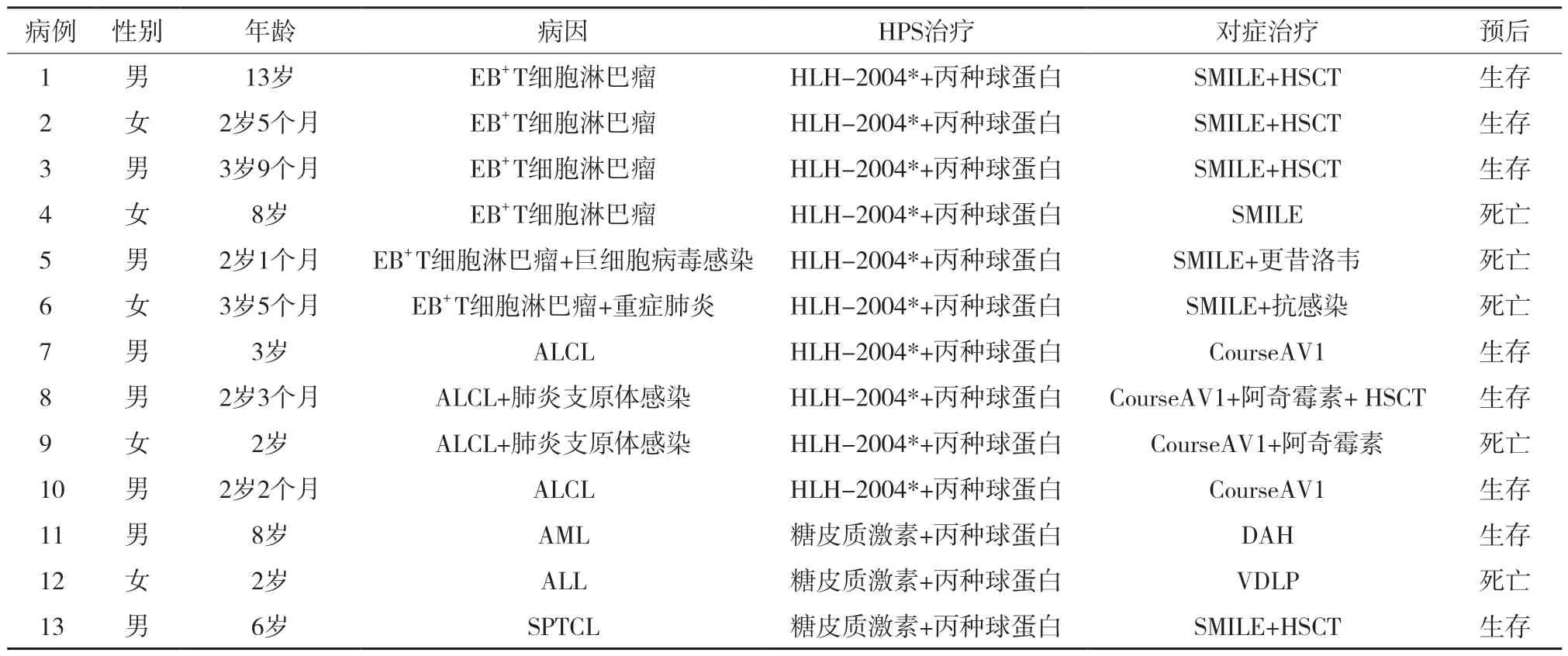
表2 血液肿瘤相关HPS患儿的治疗方案及预后
2.4 预后及随访
6例EB+T细胞淋巴瘤患儿,随访结束时存活3例,其中2例化疗缓解后行异基因造血干细胞移植,1例化疗后随访6个月病情稳定;死亡3例,1例给予地塞米松+依托泊苷化疗1周,出现凝血功能异常、肺出血在医院死亡,2例确诊后给予SMILE方案化疗2疗程后复发,放弃治疗,出院后15 d内死亡。4例ALCL患儿随访结束时存活3例,1例完全缓解,1例维持治疗期间复发,长春花碱维持治疗中,1例化疗缓解后行异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT),1例化疗期间合并曲霉菌肺炎、消化道出血死亡。ALL合并HPS患儿给予甲强龙及丙种球蛋白治疗无效发生脑出血在医院死亡。AML合并HPS患儿随访结束时存活。SPTCL患儿化疗4个月后行异基因造血干细胞移植,随访结束时存活。实验室检查结果显示,生存组与死亡组患儿铁蛋白、甘油三酯、纤维蛋白原、可溶性CD25、NK细胞活性差异均有统计学意义(P<0.05),见表3。
表3 生存组与死亡组患儿实验室检查结果比较(±s)
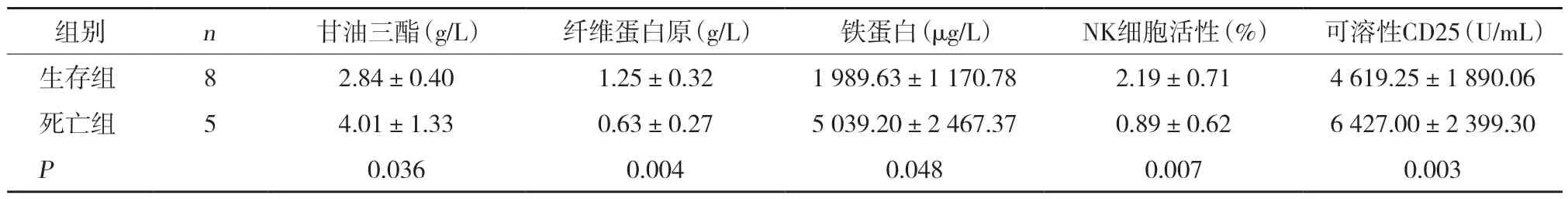
表3 生存组与死亡组患儿实验室检查结果比较(±s)
组别n甘油三酯(g/L)纤维蛋白原(g/L)铁蛋白(μg/L)NK细胞活性(%)可溶性CD25(U/mL)生存组82.84±0.401.25±0.321 989.63±1 170.782.19±0.714 619.25±1 890.06死亡组54.01±1.330.63±0.275 039.20±2 467.370.89±0.626 427.00±2 399.30 P 0.0360.0040.0480.0070.003
3 讨论
根据触发因素不同,HPS可分为原发性和继发性。162例患儿研究[3]显示非霍奇金淋巴瘤在继发性HPS中占56%,90例非霍奇金淋巴瘤合并HPS研究[4]发现EB病毒感染是影响HPS预后的独立危险因素。本研究包含11例T细胞淋巴瘤,占84.62%,EB+T细胞淋巴瘤发病初期均有高拷贝EB病毒DNA。存在高拷贝EB病毒的HPS需完善CT或PET/CT,必要时行肿大淋巴结或肝脾活检,排除淋巴瘤可能,建议行相关免疫缺陷基因及噬血相关基因检测。
研究[5]报道血清铁蛋白>10000μg/L患儿中80%可能为HPS,随着血清铁蛋白浓度的升高,发热患者中确诊HPS的比例增加[6]。血清铁蛋白>11000μg/L的死亡率是小于此标准的5.6倍[7]。可溶性CD25在疾病恶化之前即迅速升高,病情缓解早期迅速下降,作为恶性肿瘤相关HPS的重要评价指标,反映疾病的转归情况[8-9]。本研究中患儿血清铁蛋白均>500 μg/L,12例患儿可溶性CD25>2400U/mL,死亡患儿中4例铁蛋白>3000μg/L,4例可溶性CD25>7500U/mL。
在成人中恶性肿瘤相关HPS死亡率明显高于感染或自身免疫性疾病相关HPS[10]。成人肿瘤相关HPS生存时间仅为1.5~2.5个月,明显低于非肿瘤相关HPS[11]。NK/T淋巴瘤相关HPS诊断至死亡的时间为4~701 d[12]。HPS症状控制后,应尽早给予标准的淋巴瘤化疗。对于化疗期合并的HPS,应暂停相关化疗,积极查找HPS的诱发因素,针对相关病原对症治疗。本研究中EB+T细胞淋巴瘤和ALCL合并的HPS均为淋巴瘤诱导的HPS,在淋巴瘤诊断明确前均给予糖皮质激素+依托泊苷+丙种球蛋白治疗1周,体温均降至正常,淋巴结较前缩小,淋巴瘤诊断明确后,给予相关的标准淋巴瘤化疗。ALL为化疗期间合并大肠杆菌败血症出现HPS,立即停止化疗,给予甲强龙+丙种球蛋白+有效抗感染治疗,但因存在多重耐药,最终治疗无效死亡。AML和SPTCL为化疗后骨髓抑制期分别合并曲霉菌肺炎和单纯疱疹病毒感染出现HPS,给予甲强龙+丙种球蛋白+抗真菌治疗后好转。本研究发现化疗期合并HPS较淋巴瘤诱导HPS治疗效果好,见效快。可能与淋巴瘤诱导HPS为肿瘤细胞分泌细胞因子致高炎症反应有关,而化疗期合并HPS为化疗后免疫抑制,多种感染诱发临床症状,控制原发感染后,HPS在短时间内缓解。
allo-HSCT是治疗HPS的重要手段,也是原发性HPS及复发/难治性继发性HPS的唯一治愈方法。HLH-1994方案多中心研究[13]显示患儿5年生存率为54%±6%,接受造血干细胞移植的患儿5年生存率为66%±8%。HLH-2004方案多中心研究[14]显示5年生存率为56%~67%。本研究中患儿总体生存率为61.54%(8/13),与多中心研究结果一致。血液肿瘤相关的HPS临床表现缺乏特异性,以非霍奇金淋巴瘤相关HPS多见,特别是T细胞淋巴瘤,死亡率高,allo-HSCT可有效降低HPS死亡率,延长其生存期。
