氮添加和水分改变对亚热带人工林红壤微生物多样性及群落组成的影响
2024-04-28孙浩钊刘桂珍朱玉璘林雪萍郭豪钱笑杰方熊
孙浩钊, 刘桂珍, 朱玉璘, 林雪萍, 郭豪, 钱笑杰, 方熊
氮添加和水分改变对亚热带人工林红壤微生物多样性及群落组成的影响
孙浩钊1, 刘桂珍1, 朱玉璘1, 林雪萍1, 郭豪2, 钱笑杰1, 方熊3,*
1. 福建农林大学资源与环境学院, 土壤环境健康与调控福建省重点实验室, 福州 350000 2. 福建农林大学机电工程学院, 福州 350000 3. 江西农业大学国土资源与环境学院,南昌 330045
氮沉降加剧与全球降雨格局改变是全球变化的重要特征, 外源氮素的输入及土壤水分条件的变化势必会影响土壤微生物的多样性和群落组成, 进而影响地球化学过程。运用Illumina Miseq高通量测序技术, 研究氮添加、水分改变及二者交互作用对亚热带人工林红壤细菌、真菌多样性、群落组成的影响及其与土壤理化因子间的关系。结果表明: 土壤细菌多样性随水分含量的降低而减少, 且氮添加增强了这一抑制作用。施氮后中水分处理土壤真菌Shannon指数显著高于低水分处理。氮添加显著降低Acidobacteria的相对丰度, 增加Actinobacteria、Bacteroidetes的相对丰度。土壤Acidobacteria、Bacteroidetes的相对丰度随土壤含水量的升高而增加, Actinobacteria、Firmicutes则相反。干旱加剧了氮添加对Acidobacteria相对丰度的抑制作用, 氮水交互处理显著影响Cyanobacteria的相对丰度。而氮添加、土壤水分及二者交互作用对土壤真菌群落组成均无显著影响。冗余分析表明土壤细菌群落组成的变化与土壤含水量、pH、NO3–-N含量、TN含量显著相关, 分别解释了土壤细菌群落组成变化的65.6%、26.1%、21.5%、20.7%。研究表明氮添加会改变干旱对土壤细菌多样性和群落组成的影响的强度和方向。
氮沉降; 土壤含水量; 微生物多样性; 微生物群落组成
0 前言
氮沉降加剧及降水格局变化是全球变化的两个重要特征, 当前我国华南地区的氮沉降量已经达到32—49 kg·N·ha–1·a[2]。与此同时, 全球降水格局也在发生着变化, 气候变化预测模型进一步表明, 未来全球范围内将经历更极端、异常的干旱—降雨事件[3], 我国华南地区也将面临季节性干旱的威胁[4]。
土壤微生物是土壤生态系统的重要组成部分, 在土壤生物地球化学循环等过程中发挥着重要作用。氮沉降通过改变氮素有效性、pH值、土壤C/N, 改变植物与土壤微生物之间的养分分配等方式, 直接或间接地影响微生物多样性及群落组成[5]。如Barbara等长期施氮肥的实验发现土壤细菌多样性随施氮量的增加而降低[6]。但Xu等的研究结果表明土壤细菌多样性随施氮量(0、50、150、250 kg·N·ha–1·a–1)的增加而增加[7]。通过Meta分析的方法研究氮添加对土壤微生物多样性影响, Wang等的研究结果发现低水平的施氮量对土壤细菌和真菌的Shannon指数均有负面影响, 且氮添加对细菌Shannon指数的抑制作用随施氮量增加而增强; 真菌则不然, 当施氮量大于10 kg·N·ha–1·a–1时, 氮添加反而增加了真菌Shannon指数[8]。由于不同的土壤微生物类群可能在土壤氮循环过程(如固氮、硝化、反硝化等)中发挥的功能不同, 因而不同的微生物类群对外源氮素输入的响应各异[9]。Moorhead等认为: 施氮会增加土壤无机氮含量, 提高土壤碳的有效性, 进而有助于增加富营养型菌种的相对丰度, 减少贫营养型菌种的相对丰度, 因为随着氮素限制的减弱, 微生物转向分解不稳定碳源, 从而降低了这类偏向分解难降解碳源的贫营养型菌群相对丰度[10]。例如Acidobacteria是一种贫营养型土壤细菌, 其相对丰度通常在氮添加后降低[11], 而Proteobacteria是一种富营养型土壤细菌, 其相对丰度通常在氮添加后增加[12]。施氮可能通过改变氮有效性直接影响微生物相对丰度, 同时也可以通过降低土壤pH间接影响土壤微生物的相对丰度[13–14]。
土壤水分在土壤微生物生命活动中同样起着重要作用。土壤水分可以通过直接影响微生物细胞内渗透压, 影响微生物的活性[15]; 或通过影响营养物质在土壤界面的迁移, 间接影响微生物获取养分[16]; 此外土壤水分的变化还会影响植物生理活动, 从而通过植物根系分泌物间接影响土壤微生物[17]。如Preece等利用温室盆栽实验研究土壤水分下降对土壤微生物的影响, 结果表明, 细菌Shannon指数随干旱程度的加剧而降低[18]。同时Nicholas等在研究干旱对热带雨林土壤微生物的影响时也有类似的发现, 干旱组的细菌多样性显著低于对照组[19]。但Acosta—Martínez等在干旱和热浪对土壤微生物影响的研究中发现, 干旱处理中土壤细菌、真菌Shannon指数均有显著提升[20]。岳丹丹等通过盆栽控水研究干旱对棉花根系土壤真菌多样性的影响, 发现与正常浇水处理相比, 干旱处理增加了真菌的Shannon指数和Simpson指数[21]。土壤微生物群落中, 具有不同生理和生态策略的微生物类群对土壤水分有效性变化的响应不同, 有研究表明Proteobacteria与土壤含水量显著正相关, 土壤含水量的增加会增加其相对丰度, 而Acidobacteria相对丰度会随着土壤干旱程度的加剧持续减少, Gemmatimonadetes则与Acidobacteria相反[22–23]。
我国的亚热带地区, 氮沉降量高, 降水季节性变化大, 生态系统服务功能强[24]。在氮沉降增加和干旱加剧背景下, 氮素和土壤水分的交互作用将如何影响土壤微生物多样性和群落组成, 氮素与土壤水分对土壤微生物多样性和群落组成的影响是否存在协同或拮抗作用还不清楚[25]。基于此, 本实验以亚热带人工林红壤为研究对象, 模拟研究氮添加、土壤水分及二者交互作用对土壤细菌和真菌多样性及群落组成的影响。本研究结果有助于加深区域氮、水格局变化对森林土壤微生物群落影响的理解。
1 材料与方法
1.1 研究方法
实验地点位于福州市福建农林大学实验温室(26°08′N, 119°24′E), 于2017年10月在温室内建设18个生长池(1.4 m×1.4 m×0.6 m)。同年11月将从城郊人工林运来的红壤混匀并填入池中, 填土深度为0.5 m。静置稳定1个月后将马尾松()、杉木()、海南红豆()和木荷()1年生幼苗各一株移入池中, 其中杉木和马尾松为针叶植物, 木荷和红豆为阔叶植物, 此外海南红豆还具有固氮作用。缓苗4个月, 于2018年4月进行氮水交互处理, 根据实验地区氮沉降水平, 设置两组氮处理, 分别为不施氮(CK, 0 kg·N·ha–1·a–1)和施氮(AN, 80kg·N·ha–1·a–1); 每个氮处理下设置3个水分梯度, 分别为低水分(LW, 约40%田间最大持水量)、中水分(MW, 约60%田间最大持水量)和高水分(HW, 约80%田间最大持水量)处理, 在实际实验处理中分别相当于约15%、22%、28%土壤体积含水率。实验共设计6个处理, 各处理设置3个重复, 各处理和重复随机分布。以硝酸铵为氮源, 每月定期将1.905 g硝酸铵溶于5 L水中喷于施氮处理中, 未施氮组喷水5 L。定期测定土壤含水率并补水分至实验控制水平。处理8个月后, 每个样方随机采集0—10 cm土壤样品4份并充分混匀,过2 mm筛后, 一份用于土壤理化性质的分析, 一份保存于–80 ℃冰箱用于分析土壤微生物。
1.2 样品分析
1.2.1 土壤基本理化性质分析
土壤pH使用电位法, 水土比为2.5︰1。使用元素分析仪(Vario CUBE, 艾力蒙塔, 德国)分析土壤总碳(TC)、总氮(TN)含量。土壤铵态氮(NH4+-N)、硝态氮(NO3–-N)含量用氯化钾溶液浸提后使用间断性流动分析仪(Smart Chem200, MS-Allianc, 意大利)测得。土壤总磷(TP)使用硫酸—高氯酸消煮—钼锑抗比色法测得, 使用盐酸—硫酸浸提法测定土壤有效磷含量(AP)。速效钾(AK)使用乙酸铵浸提—火焰光度法测定, 具体实验步骤参考《土壤理化分析与剖面描述》[26]。
1.2.2 土壤微生物群落分析(PCR-AGE)
本研究采用土壤DNA提取试剂盒E.Z.N.A.® Soil DNA Kit(OMEGA, D5625-01)提取土壤微生物DNA。PCR采用15 μL 2×Phanta Master Mix、引物各1 μL、10—20 ng Genomic DNA、30 μL ddH2O。细菌采用引物为341F(5’—CCTACGGGNGGCWGC AG—3’)和806R(5’—GGACTACHVGGGTWTCTA AT—3’), 真菌采用引物为ITS1F(5’—CTTGGTCA TTTAGAGGAAGTAA—3’)和ITS1R(5’—GCTGCG TTCTTCATCGATGC—3’)。PCR反应程序为: 95 ℃预变性(5 min), 95 ℃变性(30 s), 55 ℃退火(30 s), 72 ℃延伸(45 s)(以上其中细菌循环27次、真菌循环29次); 72 ℃终延伸(10 min)。PCR结束后电泳验证并引入Illumina桥式PCR兼容引物进行第二轮扩增, 以16S rRNA基因产物为细菌第二轮扩增模板, 以ITS rRNA基因产物为真菌第二轮扩增模板, 选择细菌特异性较高的V3—V4区, 真菌特异性较高的ITS1区作为扩增片段, 引物为F(AATGATACGG CGACCACCGAGATCTACACTATAGCCTACACTC TTTCCCTACACGACGCTCTTCCGATCT)和R(CAA GCAGAAGACGGCATACGAGATCGAGTAATGTG ACTGGAGTTCAGACGTGTGCTCTTCCGATCT), 反应过程为95 ℃预变性(30 s), 95 ℃变性(15 s), 55℃退火(15 s), 72 ℃延伸(30 s), 5个循环; 72 ℃终延伸(5 min)。PCR结束后, PCR产物进行琼脂糖电泳检测, 琼脂糖浓度: 2%, 电压80 V, 电泳时间40 min。选择EqualbitTM dsDNA HSAssayK-it (Vazyme, EQ111-01)试剂盒切胶回收PCR产物, 由生物工程公司进行测序。
1.2.3 数据处理
使用USEARCH在0.97相似度下进行聚类, 对聚类后的序列进行嵌合体过滤后, 得到用于物种分类的OUT序列, 通过比对silva rRNA数据库, 得到每个OTU对应的物种分类信息。采用香农指数(Shannon index)和辛普森指数(Simpson index)计算土壤细菌、真菌群落的均匀性及丰富度, 表征土壤微生物群落多样性, 计算方法参考郭萍萍等[27]。使用R语言的vegan包基于Weigted Unifrac距离矩阵对所有OUT进行NMDS分析。使用SPSS26.0双因素方差分析法检验氮添加、土壤水分及二者交互作用对土壤理化性质、微生物多样性、微生物门水平优势种群相对丰度的影响。采用单因素方差分析检验相同氮水平不同水分处理之间或相同水分水平不同氮处理之间的土壤理化性质、微生物多样性、微生物优势种群相对丰度的显著性, 用LSD法进行多重比较。采用双变量相关性分析对土壤相对丰度占比超过1%的优势菌群与土壤环境因子之间的相关性进行分析, 显著性水平设置为0.05。使用Canoco 4.5对相对丰度占比大于1%的微生物做DCA (Detrended corresp-ondence analysis)分析, 前四轴最大值小于3, 选择RDA(Redundancy analysis)分析其与环境因子之间关系。使用Origin软件绘制柱状图。
2 结果与分析
2.1 土壤理化性质
总体上看, 氮添加显著增加土壤TN、NH4+-N、NO3–-N的含量(表1)。不同水分条件下, 氮添加对土壤TN含量无显著影响, 均显著增加土壤NO3–-N含量, 但仅显著增加了低水分处理组土壤NH4+-N的含量。水分处理显著影响土壤TN和NH4+-N含量, 同时对土壤pH(=0.051)和NO3–-N含量(=0.067)的影响也几乎达到显著水平。土壤TN含量表现为低水分处理组高于(<0.05)中水分处理组。随着土壤水分降低, 土壤pH有降低趋势。氮添加与土壤水分交互作用显著影响土壤NH4+-N、NO3–-N的含量(<0.01)。在不加氮组, 土壤NO3–-N含量随土壤含水量的降低而降低; 但是加氮后NH4+-N、NO3–-N含量随土壤含水量的降低而增加。在不加氮组, 水分处理对土壤pH无显著影响; 但在加氮组, 低水分处理显著降低土壤pH。
2.2 土壤微生物多样性
如图1所示: 整体上看, 氮添加对土壤细菌多样性无显著影响, 而水分处理显著影响细菌的多样性, 表现为低水分处理细菌多样性显著低于中、高水分处理(<0.01)。在不加氮组, 水分对土壤细菌多样的无显著影响; 但是加氮后, 低水分处理显著降低土壤细菌多样性(<0.05)。氮、水及二者的交互处理对土壤真菌多样性无显著影响, 但中水分处理土壤真菌Shannon指数显著大于低水分处理。
2.3 土壤微生物群落组成
基于Weighted Unifrac distance的微生物群落组成非度量多维尺度分析(NMDS)分析氮添加、土壤水分及二者交互作用对土壤微生物群落组成的影响(图2), 结果显示, 施氮使低水分与中水分处理的细菌群落分开, 但真菌存在明显的重叠。不同水分处理的土壤细菌群落在第一轴上分开(图2a), 低水分处理和高水分处理的土壤真菌群落在第二轴上分开(图2b); 总体而言, 土壤微生物群落对土壤含水量的响应大于施氮, 而氮添加对细菌群落组成的影响主要体现在低水分处理。

表1 不同处理的土壤理化性质
注: 表中土壤理化性质数值为平均值±标准差,=3。不同小写字母表示相同施氮处理不同土壤水分间差异显著(<0.05), 不同大写字母表示相同土壤水分不同施氮处理间差异显著(<0.05)。N, W, N*W的值为双因素方差分析的值, 分别表示施氮、土壤水分及二者交互作用对土壤理化性质的影响, **表示差异极显著(<0.01)。
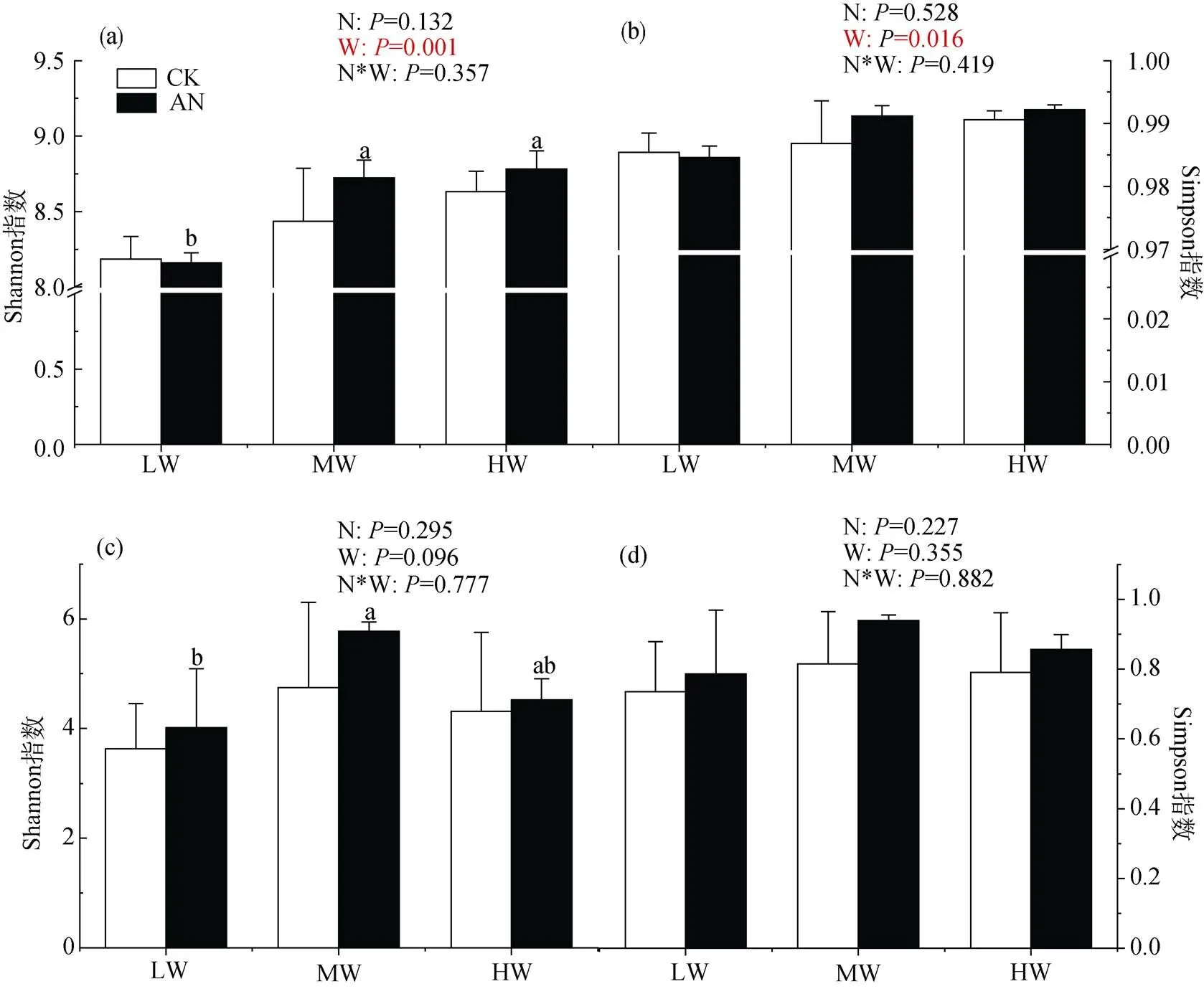
注: 平均值±标准差, n=3, 不同小写字母表示相同施氮处理不同土壤水分间差异显著(P<0.05); 图中CK表示未施氮处理, AN表示氮添加处理, LW、MW、HW分别表示低、中、高水分处理。N、W、N*W分别表示施氮、土壤水分及二者交互作用对细菌, 真菌群落shannon指数、Simpson指数的影响, P<0.05时影响显著, 下同。
Figure 1 Shannon index (lift) and Simpson index (right) of soil bacteria (a, b) and fungi (c, d) under different treatments
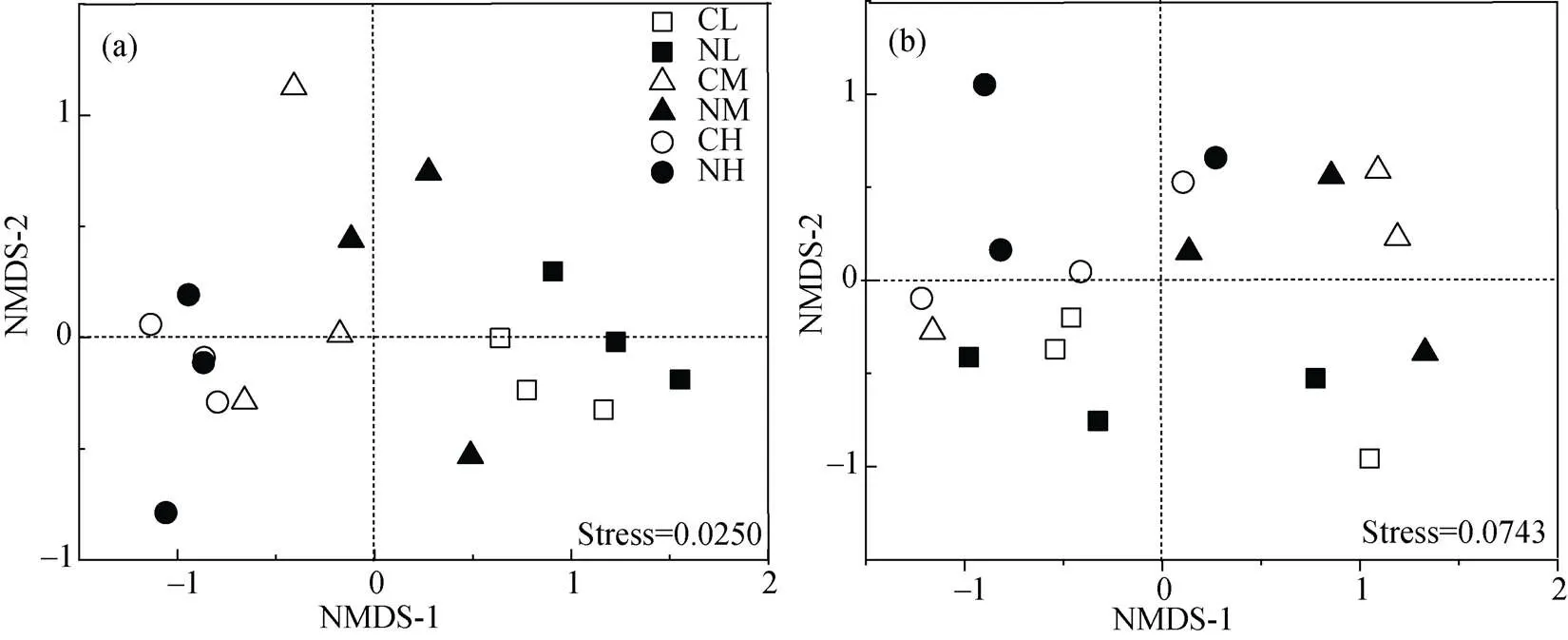
注: CL表示不施氮低水分处理, NL表示施氮低水分处理, CM表示不施氮中水分处理, NM表示施氮中水分处理, CH表示不施氮高水分处理, NH表示施氮高水分处理, 下同。
Figure 2 Non-metric multidimensional scaling (NMDS) of bacterial (a) and fungal (b) community structure based on Weighted Unifrac distance
选择相对丰度在1%以上的门水平优势微生物种群分析其相对丰度的变化, 细菌分别为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、蓝藻菌门(Cyanobacteria)和拟杆菌门(Acidobacteria), 其中变形菌门相对丰度最高(29.54%—37.90%), 其次是酸杆菌(14.90%—21.69%)、放线菌(5.60%— 19.15%) (图3)。真菌分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、球囊菌门(Mortierellomycota)和罗兹菌门(Rozellomycota)。其中子囊菌门相对丰度最高(59.74%—82.76%), 其次是担子菌门(10.12%— 29.07%)、球囊菌门(1.25%—8.80%)(图4)。如图3所示: 氮添加显著增加Actinobacteria、Bacteroidetes的相对丰度(<0.05), 降低Acidobacteria的相对丰度(<0.05)。土壤水分条件的改变显著影响除Chloroflexi、Cyanobacteria外其余6种优势细菌相对丰度, 具体表现为: Acidobacteria、Bacteroidetes的相对丰度随土壤含水量的升高而升高(<0.05); 但Actinobacteria (<0.01)、Firmicutes (<0.05)、Gemmatimonadetes (<0.05)的相对丰度随土壤含水量的降低而降低。氮添加使低水分处理组Cyanobacteria的相对丰度显著下降(<0.05), 但随着土壤水分的增加, Cyanobacteria的相对丰度对氮添加的响应由降低变为升高。除此之外, 不施氮处理组, 中、高水分处理下Proteobacteria、Bacteroidetes的相对丰度显著高于低水分处理(<0.05), 但其显著性在氮添加后消失。土壤水分的增加对Firmicutes相对丰度的抑制作用也在氮添加后达到了显著水平。施氮、土壤水分及二者的交互作用对土壤门水平优势真菌的影响均未表现出显著性(图4), 但干旱有增加Ascomycota和降低Basidiomycota相对丰度的趋势。
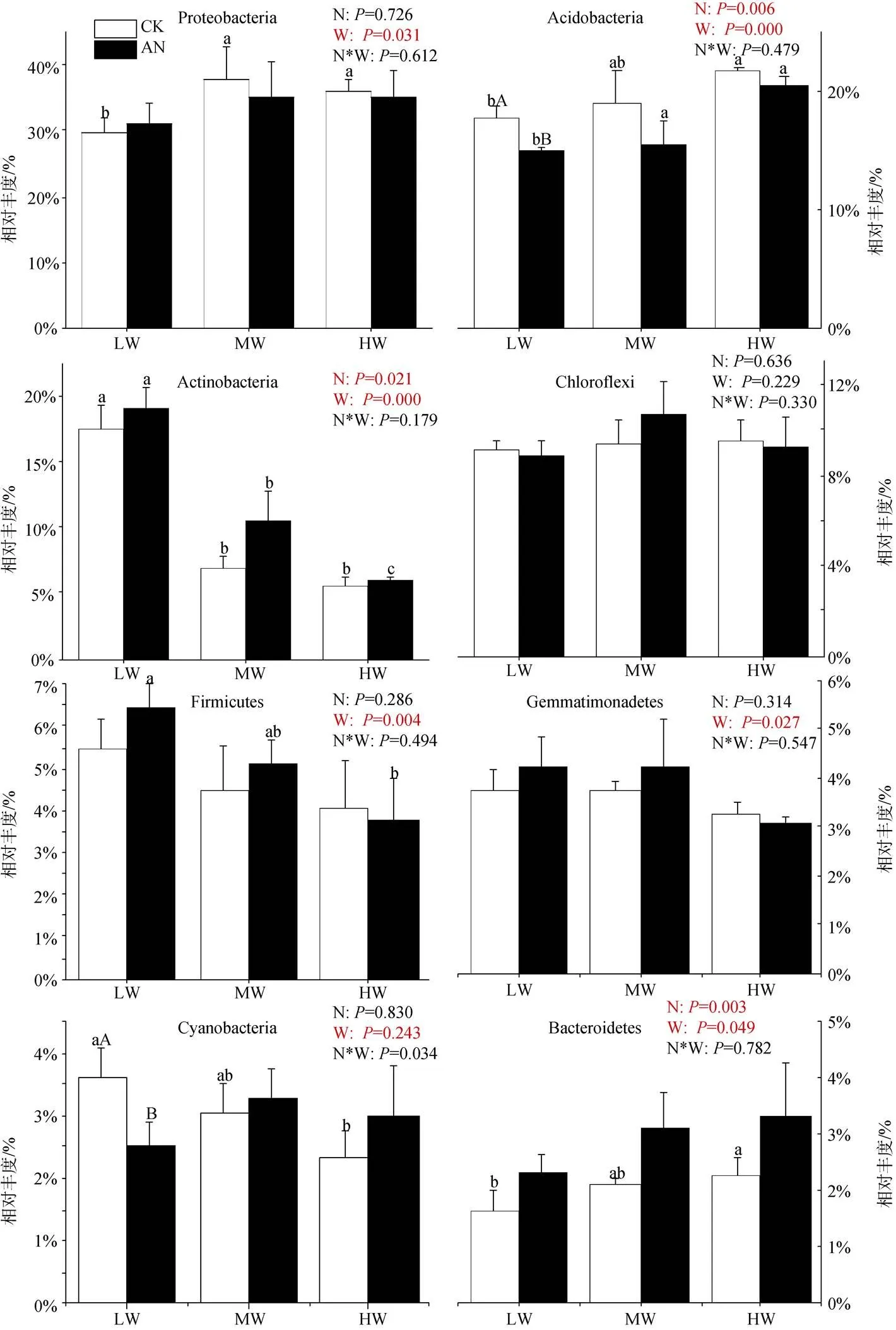
注: 不同大写字母表示相同土壤水分不同施氮处理间差异显著(P<0.05)。
Figure 3 Relative abundance of dominant soil bacteria in phylum level under different treatments
2.4 土壤微生物群落与环境因子的相关性分析
土壤细菌RDA前两个排序轴分别解释73.0%、10.1%的土壤细菌优势种群与环境因子之间的关系(图5a), 土壤含水量(=0.002)、pH(=0.004)、NO3–-N (=0.032)和TN(=0.022)与细菌群落组成显著相关, 分别解释了土壤细菌群落组成变化的65.6%、26.1%、21.5%和20.7%(图5a)。土壤真菌冗余分析前两个排序轴分别解释38.2%、2.2%的土壤真菌优势种群与环境因子之间的关系(图5b), 土壤理化性质对真菌优势菌群的影响不显著。
3 讨论
3.1 氮添加和水分改变对土壤细菌、真菌多样性的影响
整体上看, 氮添加及氮水交互作用对土壤细菌的多样性无显著影响, 仅土壤含水量对土壤细菌多样性有显著影响。已有许多研究发现施氮对土壤细菌多样性有明显的降低作用[8], 但也有研究表明: 在氮限制环境下, 短期施氮会增加细菌活性, 少量的氮能够促进某些土壤细菌的生长[28]。在本研究中, 施氮有增加细菌多样性的趋势, 但是没有达到显著水平(图1)。Christian等人认为在微酸性土壤中, 土壤细菌多样性与土壤pH值之间存在很强的相关关系[29]。因此在本研究中可能是由于氮添加量及实验处理时间的原因, 施氮并没有对土壤pH产生显著影响(表1), 因此也未显著影响细菌多样性。土壤水分在土壤细菌生命活动中起重要作用, 一般来说, 土壤水分降低会影响细菌体内渗透压及土壤养分有效性因而对土壤细菌的多样性有负面影响[16, 30]。这与本实验的研究结果低水分处理土壤细菌的Shannon指数显著低于中、高水分处理一致。本研究还发现, 增加土壤含水量后, 氮添加对土壤细菌多样性的影响由降低变为升高, 且施氮只显著降低了低水分处理土壤pH值。Zhang等的实验也发现了类似的结果, 增加土壤含水量增加了低施氮水平处理的细菌多样性[31]。一方面这可能与土壤pH对细菌多样性的影响有关, 土壤水分含量增加后, 增强了土壤硝态氮的淋失, 此外土壤含水量的增加也会增强土壤反硝化作用, 从而导致酸性土壤pH升高[32];另一方面, 还可能是因为土壤水分的增加对细菌多样性的促进作用。土壤水分增加可能会增强短期内土壤氮素对土壤细菌多样性的促进作用。
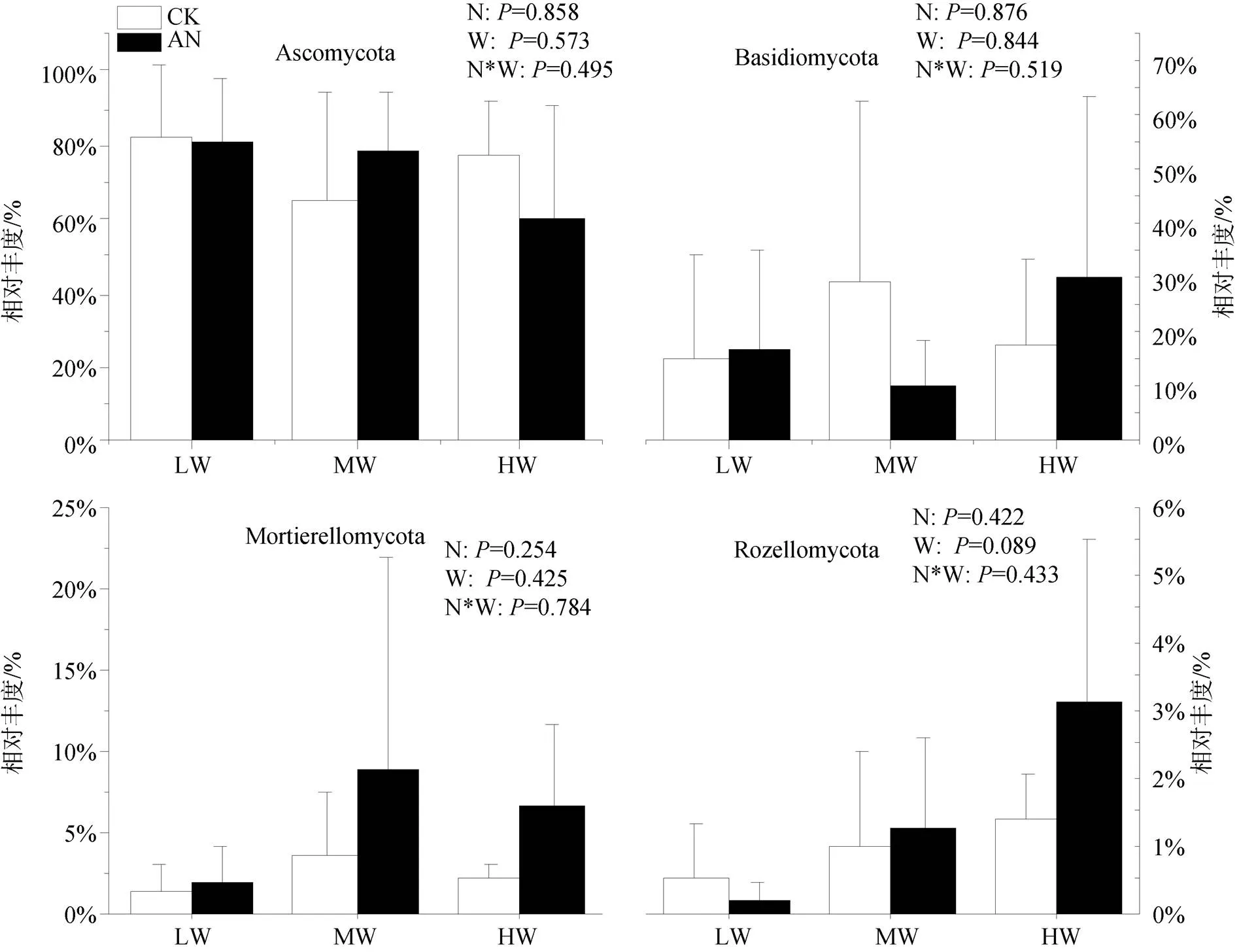
图4 不同处理土壤真菌门水平优势种群的相对丰度
Figure 4 Relative abundance of dominant soil fungi in phylum level under different treatments

注: 各种图形含义同上, 理化性质实线表示影响显著, 虚线表示不显著。
Figure 5 Redundancy analysis results for bacterial community and soil environmental parameters (Bacteria a, Fungi b)
本研究发现土壤真菌多样性对土壤氮水条件变化的耐受性强于细菌, 施氮、土壤水分及二者的交互作用对土壤真菌多样性均无显著作用。施氮增加了真菌Shannon指数与Simpson指数, 但未达到显著水平。Zhou等在中国东北黑土上连续施用了34年氮肥, 研究其对土壤真菌的影响, 结果发现真菌多样性显著降低[33]。这与本实验研究结果不符, 可能与实验处理时间长短与实验地区土壤类型有关[8, 34–35]。Zhang等人在研究施氮与降雨增加对内蒙古草原土壤真菌影响的实验中发现: 正常降水条件真菌多样性在施氮量为100 kg·N·ha–1·a–1时显著升高, 但增加降水后其显著性消失, 并推测施氮与增雨相结合有利于维持土壤真菌的多样性[36]。这与本研究的结果相似, 本实验发现: 施氮后, 中水分处理的真菌Shannon指数显著高于低水分处理, 但高水分处理与低水分处理之间并无显著性。这可能是由于中土壤水分条件下更适宜土壤真菌的生命活动, 也可能由于细菌与真菌之间对有机碳的竞争所导致[37], 本结果也进一步说明气候变化对土壤真菌多样性的影响可能要从多因素交互作用预测。
3.2 氮添加和水分改变对土壤细菌、真菌群落组成的影响
氮素是影响土壤细菌群落组成的重要因素, 不同类群土壤微生物对施氮的响应不同[38]。毕捷等研究了半干旱草原土壤微生物群落组成对氮水条件变化的响应, 发现其群落组成受到氮添加的显著影响[39]。本研究也发现类似的结果, 这可能是因为外源氮素的输入改变了土壤微生物的底物供应, 本研究中氮添加使土壤NH4+-N、NO3–-N含量显著增加, 降低低水分处理组土壤pH(表1), 且RDA的结果表明土壤pH、NO3–-N和TN含量与细菌群落组成显著相关(图5a)。另一方面, 本实验结果表明氮添加显著降低Acidobacteria的相对丰度, 显著增加Actinobacteria的相对丰度。这与Zeng等的研究结果一致, 他们的结果表明, Acidobacteria的相对丰度随施氮量的升高而下降、Actinobacteria随施氮量的升高而升高, 这可能是因为氮添加提高了土壤的养分有效性, 直接影响微生物的生理活动, 也可能由于氮添加降低了土壤pH或通过植物根系等作用间接影响其相对丰度[40]。此外, 本研究还发现土壤水分的变化改变了Cyanobacteria、Actinobacteria的相对丰度对氮添加的响应, 低水分处理中, 施氮显著降低了Cyanobacteria的相对丰度, 增加土壤含水量后, 施氮反而增加了Cyanobacteria的相对丰度, 有研究表明: 水分是影响土壤微藻分布的重要限制因素, 在一些水分充足的土壤环境中, 蓝藻的丰富度最高, 并且大多数蓝藻都具有固氮功能, 能将无机氮转化为有机氮[41], 氮源丰富的环境可能会促进其生长。张海芳等的研究结果表明, 增加土壤水分导致Actinobacteria相对丰度在施氮后由显著升高变为显著降低[42], 这与本实验结果相似, 本研究中Actinobacteria的相对丰度与土壤含水量极显著负相关, 与土壤硝态氮的含量显著正相关(图5a), 高土壤水分抑制了施氮对Actinobacteria生长的促进作用, 这可能与Actinobacteria在不同水分条件下的形态特征有关, 在不同的水分条件下, Actinobacteria对氮添加的响应存在差异。
四种土壤优势真菌的相对丰度对施氮、土壤水分及二者的交互作用的响应均不显著, 可能是因为真菌具有细胞壁结构这一生理结构的优势, 在短期内使其更容易抵抗外界环境因素的胁迫[43–44]。Zhou等的研究结果表明, 在300 kg·N·ha–1·a–1时Ascomycota的相对丰度显著降低, Basidiomycota的相对丰度显著升高[33]。这与本实验研究结果不一致, 本研究发现, Ascomycota与土壤NH4+-N、NO3–-N含量呈正相关,则相反(图5b), 说明实验的施氮量及实验处理时间的长短也可能是本实验土壤真菌相对丰度无显著变化的原因之一。综上所述, 土壤微生物多样性和群落组成与土壤氮水条件变化之间的关系较为复杂, 研究需综合考虑土壤类型、地上部植物、实验条件对土壤氮水交互效应的影响。
4 结论
(1)氮添加对土壤细菌和真菌多样性无显著影响, 土壤水分的变化显著影响土壤细菌多样性, 表现为高水分处理>中水分处理>低水分处理, 且氮添加增强了低水分对细菌多样性的抑制作用。氮、水及二者的交互处理对土壤真菌多样性无显著影响
(2)不同类群细菌对氮添加、土壤水分变化及二者交互作用响应不同, 氮添加显著降低Acidobacteria的相对丰度, 增加Actinobacteria和Bacteroidetes的相对丰度; Acidobacteria、Bacteroidetes的相对丰度随土壤含水量的增加增加, Actinobacteria、Firmicutes和Gemmatimonadetes则相反; 干旱使氮添加对Acidobacteria相对丰度的抑制作用达到显著水平; 土壤水分的增加改变了Cyanobacteria的相对丰度对氮添加的响应。
(3)氮水单独或交互作用对土壤优势真菌相对丰度均无显著影响。但干旱有增加Ascomycota和降低Basidiomycota相对丰度的趋势。
[1] ZHAO Y H, ZHANG L, CHEN Y F, et al. Atmospheric nitrogen deposition to China: A model analysis on nitrogen budget and critical load exceedance[J]. Atmospheric Environment, 2017, 153: 32–40.
[2] 遆超普, 颜晓元. 基于氮排放数据的中国大陆大气氮素湿沉降量估算[J]. 农业环境科学学报, 2010, 29(8): 1606–1611.
[3] 朱义族, 李雅颖, 韩继刚, 等. 水分条件变化对土壤微生物的影响及其响应机制研究进展[J]. 应用生态学报, 2019, 30(12): 4323–4332.
[4] 吴华清, 陈小梅, 林媚珍, 等. 降水处理对南亚热带季风林土壤微生物群落结构的影响[J]. 生态环境学报, 2016, 25(4): 583–590.
[5] 刘红梅, 张爱林, 皇甫超河, 等. 氮沉降增加对贝加尔针茅草原土壤微生物群落结构的影响[J]. 生态环境学报, 2017, 26(7): 1100–1106.
[6] CAMPBELL B J, POLSON S W, HANSON T E, et al. The effect of nutrient deposition on bacterial communities in Arctic tundra soil[J]. Environmental Microbiology, 2010, 12(7): 1842–1854.
[7] XU Y G, YU W T, MA Q, et al. Responses of bacterial and archaeal ammonia oxidisers of an acidic luvisols soil to different nitrogen fertilization rates after 9 years[J]. Biology and Fertility of Soils, 2012, 48(7): 827–837.
[8] WANG C, LIU D, BAI E. Decreasing soil microbial diversity is associated with decreasing microbial biomass under nitrogen addition[J]. Soil Biology and Biochemistry, 2018, 120: 126–133.
[9] 郑勇, 贺纪正. 森林土壤微生物对干旱和氮沉降的响应[J]. 应用生态学报, 2020, 31(7): 2464–2472.
[10] MOORHEAD D L, SINSABAUGH R L. A theoretical model of litter decay and microbial interaction[J]. Ecological Monographs, 2006, 76(2): 151–174.
[11] 王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14–20.
[12] 郝亚群, 谢麟, 陈岳民, 等. 中亚热带地区氮沉降对杉木幼林土壤细菌群落多样性及组成的影响[J]. 应用生态学报, 2018, 29(1): 53–58.
[13] RAMIREZ K S, CRAINE J M, FIERER N. Nitrogen fertilization inhibits soil microbial respiration regardless of the form of nitrogen applied[J]. Soil Biology & Biochemistry, 2010, 42(12): 2336–2338.
[14] WESSEN E, HALLIN S, PHILIPPOT L. Differential responses of bacterial and archaeal groups at high taxonomical ranks to soil management[J]. Soil Biology & Biochemistry, 2010, 42(10): 1759–1765.
[15] ALSTER C J, GERMAN D P, LU Y, et al. Microbial enzymatic responses to drought and to nitrogen addition in a southern California grassland[J]. Soil Biology and Biochemistry, 2013, 64: 68–79.
[16] DAN N, DEVIN C D. Drought Stress and Root-Associated Bacterial Communities[J]. Frontiers in plant science, 2017, 8.
[17] HAICHAR F Z, MAROL C, BERGE O, et al. Plant host habitat and root exudates shape soil bacterial community structure[J]. The ISME Journal: Multidisciplinary Journal of Microbial Ecology, 2008, 2(12): 1221–1230.
[18] PREECE C, VERBRUGGEN E, LIU L, et al. Effects of past and current drought on the composition and diversity of soil microbial communities[J]. Soil Biology and Biochemistry, 2019, 131: 28–39.
[19] NICHOLAS B J, LIM H C, BORGLIN S, et al. Pre-exposure to drought increases the resistance of tropical forest soil bacterial communities to extended drought[J]. The ISME Journal: Multidisciplinary Journal of Microbial Ecology, 2013, 7(2): 384–394.
[20] ACOSTA-MARTINEZ V, COTTON J, GARDNER T, et al. Predominant bacterial and fungal assemblages in agricultural soils during a record drought/heat wave and linkages to enzyme activities of biogeochemical cycling[J]. Applied Soil Ecology, 2014, 84: 69–82.
[21] 岳丹丹, 韩贝, ULLAH A, 等. 干旱条件下棉花根际真菌多样性分析[J]. 作物学报2021, 47(9): 1806–1815.
[22] CHODAK M, GOLEBIEWSKI M, MORAWSKA- PLOSKONKA J, et al. Soil chemical properties affect the reaction of forest soil bacteria to drought and rewetting stress[J]. Annals of microbiology, 2015, 65(3): 1627–1637.
[23] ZHAO Q, JIAN S G, NUNAN N, et al. Altered precipitation seasonality impacts the dominant fungal but rare bacterial taxa in subtropical forest soils[J]. Biology and Fertility of Soils, 2017, 53(2): 231–245.
x
[24] 谢高地, 张彩霞, 张昌顺, 等. 中国生态系统服务的价值[J]. 资源科学, 2015, 37(9): 1740–1746.
[25] DIJKSTRA F A, AUGUSTINE D J, BREWER P, et al. Nitrogen cycling and water pulses in semiarid grasslands: are microbial and plant processes temporally asynchronous?[J]. Oecologia, 2012, 170(3): 799–808.
[26] 刘光崧. 土壤理化分析与剖面描述[M]. 北京: 中国标准出版社, 1996.
[27] 郭萍萍, 黄幸然, 吴旺旺, 等. 不同施氮方式和施氮量对马尾松和木荷幼苗根系土壤细菌群落的影响[J]. 生态学报, 2021, 41(1): 149–161.
[28] SCHAEFFER S M, EVANS R D. Pulse additions of soil carbon and nitrogen affect soil nitrogen dynamics in an arid Colorado Plateau shrubland[J]. Oecologia, 2005, 145(3): 425–433.
[29] CHRISTIAN L, MICAH H, ROB K, et al. Pyrosequencing- based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale. [J]. Applied and environmental microbiology, 2009, 75(15): 5111–5120.
[30] HUESO S, GARCIA C, HERNANDEZ T. Severe drought conditions modify the microbial community structure, size and activity in amended and unamended soils[J]. Soil Biology and Biochemistry, 2012, 50: 167–173.
[31] ZHANG H, LIU H, ZHAO J, et al. Elevated precipitation modifies the relationship between plant diversity and soil bacterial diversity under nitrogen deposition in Stipa baicalensis steppe[J]. Applied Soil Ecology, 2017, 119: 345–353.
[32] ZHANG X, LIU W, SCHLOTER M, et al. Response of the Abundance of Key Soil Microbial Nitrogen-Cycling Genes to Multi-Factorial Global Changes[J]. Plos One, 2013, 8(10).
[33] ZHOU J, JIANG X, ZHOU B, et al. Thirty four years of nitrogen fertilization decreases fungal diversity and alters fungal community composition in black soil in northeast China[J]. Soil Biology and Biochemistry, 2016, 95: 135–143.
[34] FERY S D, KNORR M, PARRENT J L, et al. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests[J]. Forest Ecology and Management, 2004, 196(1): 159–171.
[35] ZHOU Z H, WANG C K, LUO Y Q. Meta-analysis of the impacts of global change factors on soil microbial diversity and functionality[J]. Nature Communications, 2020, 11(1): 3027.
[36] ZHANG H, WANG L, LIU H, et al. Nitrogen deposition combined with elevated precipitation is conducive to maintaining the stability of the soil fungal diversity on the Stipa baicalensis steppe[J]. Soil Biology and Biochemistry, 2018, 117: 135–138.
[37] BAHRAM M, HILDEBRAND F, FORSLUND S K, et al. Structure and function of the global topsoil microbiome[J]. Nature, 2018, 560: 233–237.
[38] CEDERLUND H, WESSEN E, ENWALL K, et al. Soil carbon quality and nitrogen fertilization structure bacterial communities with predictable responses of major bacterial phyla[J]. Applied Soil Ecology, 2014, 84: 62–68.
[39] 毕捷, 张乃莉, 梁宇, 等. 氮水添加对半干旱地区草原土壤微生物群落结构的交互影响[J]. 广东农业科学, 2012, 39(19): 166–170.
[40] ZENG J, LIU X J, SONG L, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology and Biochemistry, 2016, 92: 41–49.
[41] 杜琼, 孔维宝, 韩锐, 等. 土壤微藻的种类及其功能研究进展[J]. 生物学通报, 2015, 50(1): 1–5.
[42] 张海芳, 刘红梅, 赵建宁, 等. 模拟氮沉降和降雨变化对贝加尔针茅草原土壤细菌群落结构的影响[J]. 生态学报, 2018, 38(1): 244–253.
[43] ROMAIN B L, CATHERINE O A, MARY F K. Changing precipitation pattern alters soil microbial community response to wet-up under a Mediterranean-type climate[J]. The ISME journal, 2015, 9(4): 946–957.
[44] FRANCISKA T V, ROB I G, MARK B, et al. Soil bacterial networks are less stable under drought than fungal networks[J]. Nature communications, 2018, 9(3303).
Effects of nitrogen addition and moisture change on microbial diversity and community composition in subtropical plantation red soil
SUN Haozhao1, LIU Guizhen1, ZHU Yulin1, LIN Xueping1, GUO Hao2, QIAN Xiaojie1, FANG Xiong3,*
1. Fujian Provincial Key Laboratory of Soil Environmental Health and Regulation, College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350000, China 2. College of Mechanical and Electrical Engineering, Fujian Agriculture and Forestry University, Fuzhou 350000, China 3. College of Land Resources and Environment, Jiangxi Agricultural University, Nanchang 330045, China
The intensification of nitrogen deposition and the change of global rainfall pattern are important features of global change. The input of exogenous nitrogen and the change of soil water conditions will inevitably affect soil microbial diversity and community composition. Illumina Miseq high-throughput sequencing technology was used to study the effects of nitrogen addition, water change and their interaction on bacterial and fungal diversity and community composition of red soil in a modeling subtropical plantation, as well as their relationships with soil properties. The results showed that: soil bacterial diversity decreased with the decrease of water content, and the inhibition effect was enhanced by the addition of nitrogen. The Shannon index of soil fungi under medium water treatment was significantly higher than that under low water treatment. Nitrogen addition significantly decreased the relative abundance of Acidobacteria, while increased the relative abundance of Actinobacteriaand Bacteroidetes. In the soil, the relative abundance of Acidobacteria and Bacteroidetes increased with the increase of soil water content, while Actinobacteria and Firmicutes were on the contrary. Drought intensified the inhibition effect of nitrogen addition on the relative abundance of Acidobacteria. Nitrogen addition and soil water interaction significantly affected the relative abundance of Cyanobacteria. But nitrogen addition, soil moisture and their interactions had no significant effects on soil fungal community composition. The results of redundancy analysis showed that the changes of soil bacterial community composition were significantly related to soil water content, pH, NO3–-N content and TN, which accounted for 65.6%, 26.1%, 21.5% and 20.7% of the changes of soil bacterial community composition, respectively. These results suggest that nitrogen addition may alter the intensity and direction of the effects of drought on soil bacterial diversity and community composition.
nitrogen deposition; soil water content; microbial diversity; microbial community composition
10.14108/j.cnki.1008-8873.2024.01.012
S714.3
A
1008-8873(2024)01-094-11
2021-08-18;
2021-11-09
国家自然科学基金项目(42267034); 江西省“千人计划”创新领军人才长期青年项目(jxsq2023101103); 福建省松林改造提升行动重点科技攻关项目(2021FKJ01)
孙浩钊(1997—), 男, 河南许昌人, 硕士, 研究方向为土壤生态学, E-mail: 18238670521@163.com
通信作者:方熊, 博士, 副教授, 主要从事土壤生态学研究, E-mail: fangxiong_1103@126.com
孙浩钊, 刘桂珍, 朱玉璘, 等. 氮添加和水分改变对亚热带人工林红壤微生物多样性及群落组成的影响[J]. 生态科学, 2024, 43(1): 94–104.
SUN Haozhao, LIU Guizhen, ZHU Yulin, et al. Effects of nitrogen addition and moisture change on microbial diversity and community composition in subtropical plantation red soil[J]. Ecological Science, 2024, 43(1): 94–104.
