两种丛枝菌根真菌和黄瓜花叶病毒复合作用对烟草生长和光合特性的影响
2024-04-28裴佳梁瑾金夏焕夏丽娜贺晓斌王艳红
裴佳, 梁瑾, 金夏焕, 夏丽娜, 贺晓斌, 王艳红
两种丛枝菌根真菌和黄瓜花叶病毒复合作用对烟草生长和光合特性的影响
裴佳, 梁瑾, 金夏焕, 夏丽娜, 贺晓斌, 王艳红*
浙江农林大学省部共建亚热带森林培育国家重点实验室, 杭州 311300
为研究丛枝菌根真菌(AM真菌)和黄瓜花叶病毒(virus, CMV)的复合作用对烟草生长的影响, 在大棚控制试验中, 通过设置4个AM真菌处理水平(接种灭菌混合AM真菌、、和两者混合菌种)和2个CMV处理水平(不接种和接种), 从生理生态学角度来研究其调控作用。结果表明: 接种CMV显著降低了未接种AM真菌烟草植株的总干重、净光合速率()和瞬时水分利用效率(); 接种AM真菌显著提高烟草植株的菌根侵染率、菌丝酶活性、总干重、n和。无论接种CMV与否, AM真菌的菌根效应均为正值且存在菌种间的差异, 以的菌根效应最为显著。可见, 接种AM真菌对烟草抗CMV能力具有一定的促进作用, 增加烟草植株的光合能力可能是AM真菌增强烟草植株抗CMV能力的主要作用机理。
AM真菌; 黄瓜花叶病毒; 烟草; 光合能力; 生物量积累
0 前言
烟草(L.)是当今世界上重要的经济作物, 我国现已成为世界烟草生产第一大国[1]。黄瓜花叶病是烟草最主要的病害之一, 在我国各省烟区均有发生, 严重影响烟叶的产量和品质, 导致了巨大的经济损失[2–3]。黄瓜花叶病是由黄瓜花叶病毒(, CMV)侵染寄主植物引起, CMV寄主范围极广, 能侵染1000多种单、双子叶植物, 在自然界主要通过寄主植物种子或繁殖材料、汁液摩擦及昆虫传播, 是目前已知的世界性分布范围最广、最具经济危害的植物病毒[4–6]。以往的研究表明, CMV侵染导致绝大多数寄主植物表现出各种典型症状, 例如, 叶片斑驳畸形、某些代谢平衡和酶活性受到抑制, 同时光合作用受到抑制, 导致植物生长迟缓, 使植物减产甚至死亡[5,7–10]。目前CMV的防治措施主要有化学防治、物理防治、生物制剂防治以及利用基因工程技术等培育抗病新品种, 这些方法虽然在一定程度上可以限制或减少CMV在田间的传播, 但往往会造成二次污染或成本较高, 寻求安全、高效、稳定的病毒防控技术势在必行[5,11–13]。其中, 利用有益微生物, 例如接种丛枝菌根真菌(Arbuscular mycorrhizal fungi, 简称AM真菌)来提高宿主植物对病毒的抗性, 越来越引起广泛关注[14–16]。
AM真菌是土壤中分布最为广泛的微生物类群, 与农林业生产最为密切, 能与陆地上80%以上的植物根系建立共生关系, 形成菌根结构, 促进宿主植物的生长和发育, 并提高植物对生物或非生物胁迫的抗逆性[16–19]。光合作用是植物最重要的代谢活动, 植物感染病毒后其光合性状一般都会受到影响[8, 20], 然而, 接种AM真菌能否调控CMV对烟草光合生理生长的抑制作用则相对较为缺乏。为此, 本实验通过大棚控制实验, 研究AM真菌对CMV感染的烟草光合生理生长的调控机理, 以期为烟草的大面积栽培和产业化管理提供理论和实践依据。
1 材料与方法
1.1 供试材料与培养基质
本实验所用烟草种子购买自海洪种业(潍坊, 山东), 1% NaClO溶液灭菌消毒处理后, 播种至塑料花盆(18 cm×16.5 cm×12 cm)中, 每盆播种4粒种子, 待种子萌发后间苗至每盆1株。培养基质为当地红黄壤与泥炭土按3: 1体积比混合, 过2 mm土壤筛, 后经25 KGy辐照灭菌处理[21], 每个花盆中装入混合基质2 kg。培养基质的基本性质为: 有机质23.14 mg·g–1, 全氮0.82 mg·g–1, 全磷0.28 mg·g–1, pH 5.85 (水︰土= 5︰1)。供试菌种为摩西斗管囊霉((T. H. Nicolson & Gerd.) C. Walker & A. Schüßler) (BGC HUN03B) (简写为Fm)和地表球囊霉((P. Karst.) Oehl, G. A. Silva and Sieverd) (BGC GD01C) (简写为Dv), 这两种菌种均由北京市农林科学研究院植物营养与资源研究所“丛枝菌根真菌种质资源库(BGC)”提供。CMV由浙江农林大学微生物实验室提供。
1.2 实验处理
本试验是二因素完全随机试验设计, 因素1为AM真菌接种处理, 因素2为CMV接种处理。其中, AM真菌接种处理设置4个AM真菌处理水平(接种灭菌混合AM真菌, NM; 接种摩西斗管囊霉, Fm; 接种地表球囊霉, Dv; 接种混合AM真菌, Fm+Dv); CMV处理设置2个处理水平(不接种, CK; 接种, CMV), 共计8个处理组合, 每个处理组合重复10次。AM真菌接种处理与烟草种子播种同时进行, 接种时将各菌种在土壤基质表层1—2 cm深处平铺一层, 然后覆上1—2 cm的灭菌基质。每盆加入AM菌种的量为20 g(含有217±50个真菌孢子/10 g土), 其中灭菌菌种和混合菌种中Fm菌种和Dv菌种的量按1: 1质量比。本实验接种菌剂为经高粱扩繁后获得含菌丝、孢子和侵染根段的接种物[22]。接种灭菌混合AM真菌为经121 ℃、0.11 MPa高压蒸汽灭菌2 h, 连续2次, 中间间隔24 h, 放置1周后使用的混合菌剂, 同时在接种后浇入20 mL菌剂滤液, 以保持微生物区系的一致性[23]。CMV的接种方法为伤口接种法: 幼苗长至3—4片叶时顶上两片叶用金钢砂纸将叶面擦伤, 然后在擦伤处涂上含病毒的磷酸缓冲液(pH 6.5), 健康对照以接种不含病毒的缓冲液处理[8]。为避免由昆虫传播导致的交叉感染, 接种CMV和作为对照的烟草植株分别放置在人工搭置的纱网内进行隔离。实验期间, 适时浇水, 常规管理。实验处理时间为2019年4月至2019年9月, 其中, 2019年4月25日开始烟草种子播种和AM真菌接种, 为减少CMV对菌丝生长的抑制作用, 2019年5月20日开始CMV接种处理, 2019年9月25日开始实验收获。实验期间, 塑料大棚内平均温度为29.2 ℃, 平均湿度为60% (Thermo Datalogger, Cambell Inc, USA)。
1.3 指标测定
收获前, 每个处理组合随机选取4株植株利用Li-6400便携式光合仪(LI-COR, Lincoln, USA), 选择晴朗天气的8: 00—11: 00进行光合生理指标的测定[24]: 测定时将叶面温度控制为27 ºC、叶室相对湿度控制为70%、气体流速控制为500 umol·s–1、CO2浓度控制为400 μmol·mol–1、光照强度控制为1200 μmol·m–2·s–1; 测定的光合作用参数为净光合速率(n)、气孔导度(s)、胞间CO2(i)和蒸腾速率(r), 利用n/r计算得出瞬时水分利用效率()。
实验结束时, 小心将整株植物从基质中分离出来, 用水多次冲洗地上部分和根系后, 用吸水纸吸干根系或植株表面多余水分, 记录根系总鲜重。随机挑取一部分细根分为三部分, 记录其鲜重后, 分别用于菌根侵染率和菌丝酶活性的测定。其中, 菌根侵染率的测定方法采用改进的台盼蓝染色法[25]染色30 min, 然后用网格交叉法[26]镜检测定侵染率。另外, 菌丝琥铂酸脱氢酶(SDH)和碱性磷酸酶(ALP)活性的测定是参照Zhao等[27]的方法。烟草地上部分和剩余根系于70 ℃, 72 h烘干至恒重并称重。
1.4 数据处理
本实验中用菌根依赖性(Mycorrhizal dependence; 简称MD)来衡量不同植物对菌根真菌依赖性的大小[28]:
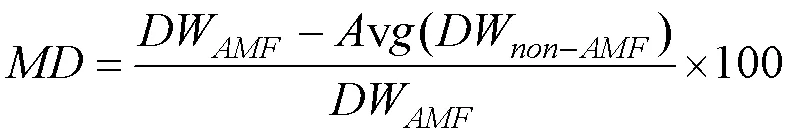
其中,DW是AM真菌接种处理的植物干重,(DW)是未接种AM真菌的植物平均干重。
对所测指标用二元方差分析方法(General Linear Model; GLM过程, SPSS 22.0)研究AM真菌和CMV对烟草生长、光合参数和AM真菌功能特性等的影响。数据分析前, 所有数据已经过正态性和齐性检验。在交互作用显著情况下, 用LSD多重比较法分析不同处理组合间植物生理生长指标的差异显著性。
2 结果与分析
2.1 AM真菌和CMV复合作用对烟草根系侵染率、菌丝酶活性及生物量生产的影响
如图1所示, 与对照相比, 除Dv接种植株外, CMV接种对菌根侵染率、SDH活性和ALP活性均没有显著影响; 不论是在对照或CMV接种下, 与未接种AM真菌(简称NM植株; 下同)的植株相比, 接种AM真菌植株(简称AM植株; 下同)的菌根侵染率、SDH活性和ALP活性均显著提高。AMF和CMV的交互作用仅对菌根侵染率有显著影响(表1)。
与对照相比, 接种CMV显著降低了烟草的总生物量积累; 不论是在对照或接种CMV条件下, AM植株的总干重均显著高于NM植株, 同时, 接种Dv菌种的植株其总生物量显著高于其他菌种, 说明不同菌种对烟草植株生物量的促进作用存在差异; 另外, 在CMV接种条件下, 接种Fm菌种、Dv菌种和混合菌种的植株其总干重与对照条件下的相应的AM植株相比分别下降了约63.13%、56.37%和61.65%(图2A), 说明AM真菌对烟草生物量积累的促进效应受到CMV的抑制。此外, 与对照相比, 接种CMV显著提高了烟草的根冠比, 但接种AM真菌与否对烟草的根冠比没有显著影响(图2B)。AMF和CMV的交互作用仅对总干重有显著影响(表1)。
2.2 AM真菌和CMV复合作用对烟草叶片光合参数的影响
如图3A和3B所示, 与对照相比, 接种CMV均显著降低了烟草叶片的SPAD值和n; 不论接种CMV与否, AMF均显著提高了SPAD值和n, 但各菌种之间的效应差异不显著。除混合接种植株外, CMV接种显著提高了叶片的s, 但AM真菌对s的效应随CMV的接种与否及菌种类型而发生改变(图3C)。如图3D所示, 与对照相比, CMV接种显著增加了NM植株的r, 但降低了AM植株的r; AM真菌接种显著降低了r, 尤其是在CMV接种条件下。如图3E所示, 与对照相比, CMV接种显著降低了i; 不论CMV接种与否, AM真菌接种均显著提高了i, 但各菌种之间的效应差异不显著。此外, 与对照相比, CMV接种显著降低了NM植株的; 不论CMV接种与否, AM真菌接种均显著提高了(图3F)。由此可见, AM真菌接种可一定程度上削弱CMV对烟草叶片光合特性的抑制效应, 但各菌种间效应差异不显著。除SPAD外, AMF和CMV的交互作用对以上光合参数均具有显著影响(表1)。

表1 烟草的相应参数对黄瓜花叶病毒(CMV)、AM真菌(AMF)及其两者交互效应二元方差分析的F值及其自由度
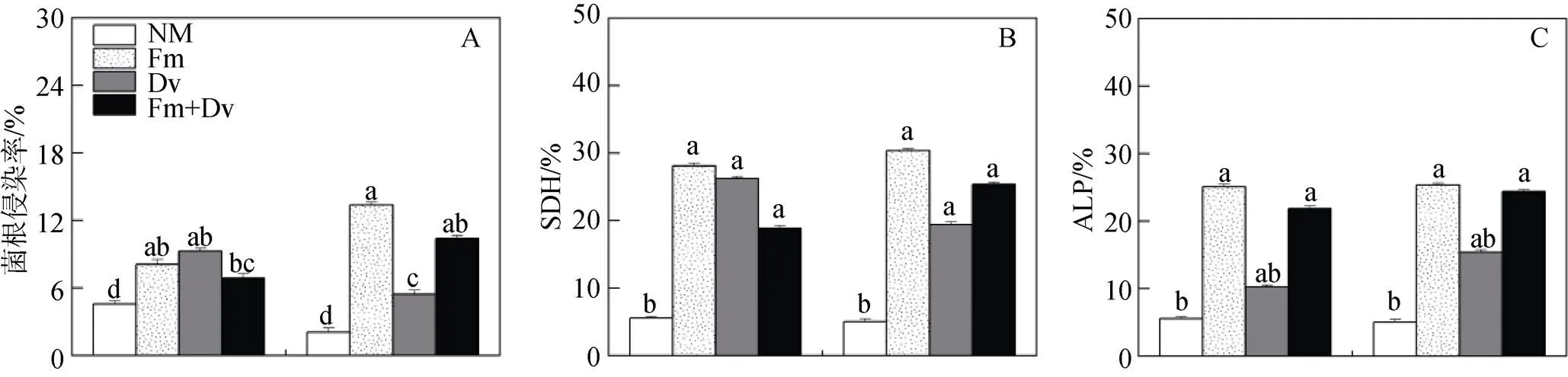
注: CK为对照, CMV为接种黄瓜花叶病毒; NM是接种灭菌混合AM真菌, Fm是接种摩西斗管囊霉(Funneliformis mosseae), Dv是接种地表球囊霉(Diversispora versiformis), Fm+Dv是接种两菌种的混合菌种。每个数据代表三个重复的平均值(±标准误)。标有相同字母的柱子表示差异不显著(P > 0.05)。下同。
Figure 1 Interactive effects of arbuscular mycorrhizal fungi (AMF) and(CMV) on root colonization (A), succinate dehydrogenase (B) and alkaline phosphatase (C)of tobacco plants
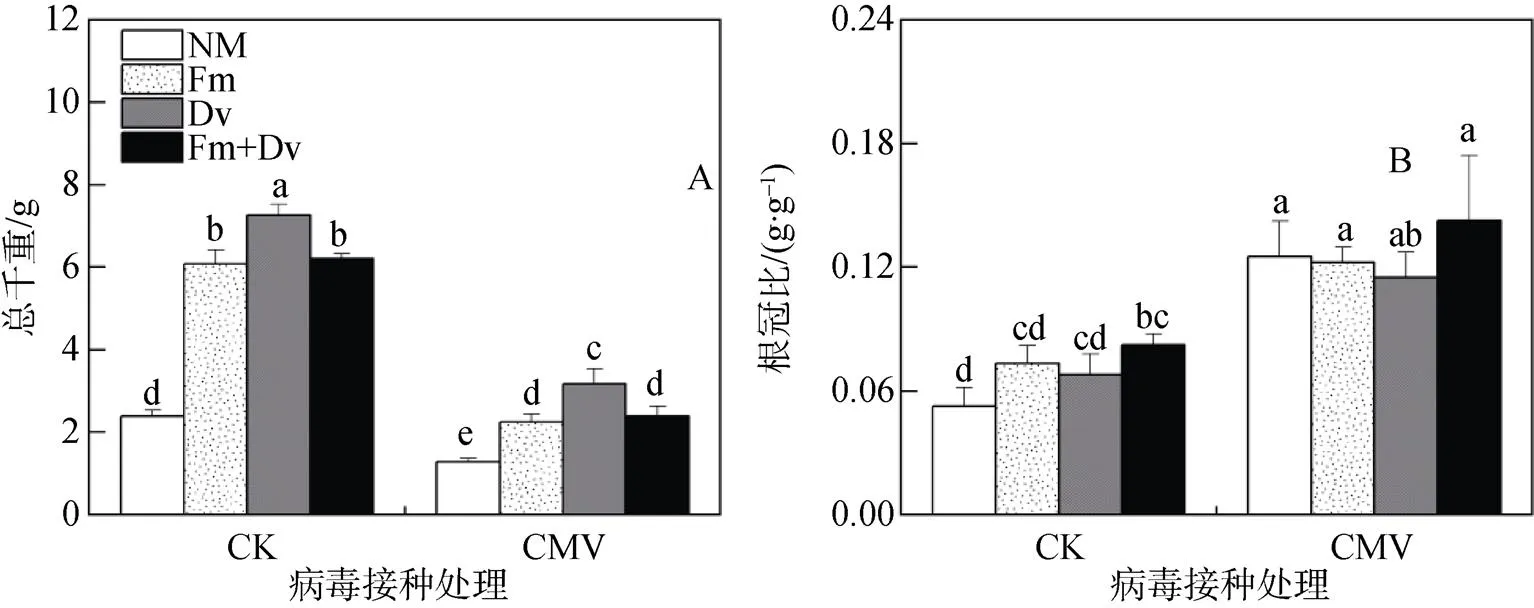
注: 每个数据代表十个重复的平均值(±标准误)。标有相同字母的柱子表示差异不显著(P > 0.05)。
Figure 2 Interactive effects of arbuscular mycorrhizal fungi (AMF) and(CMV) on total dry weight (A) and root: shoot ratio (B) of tobacco plants
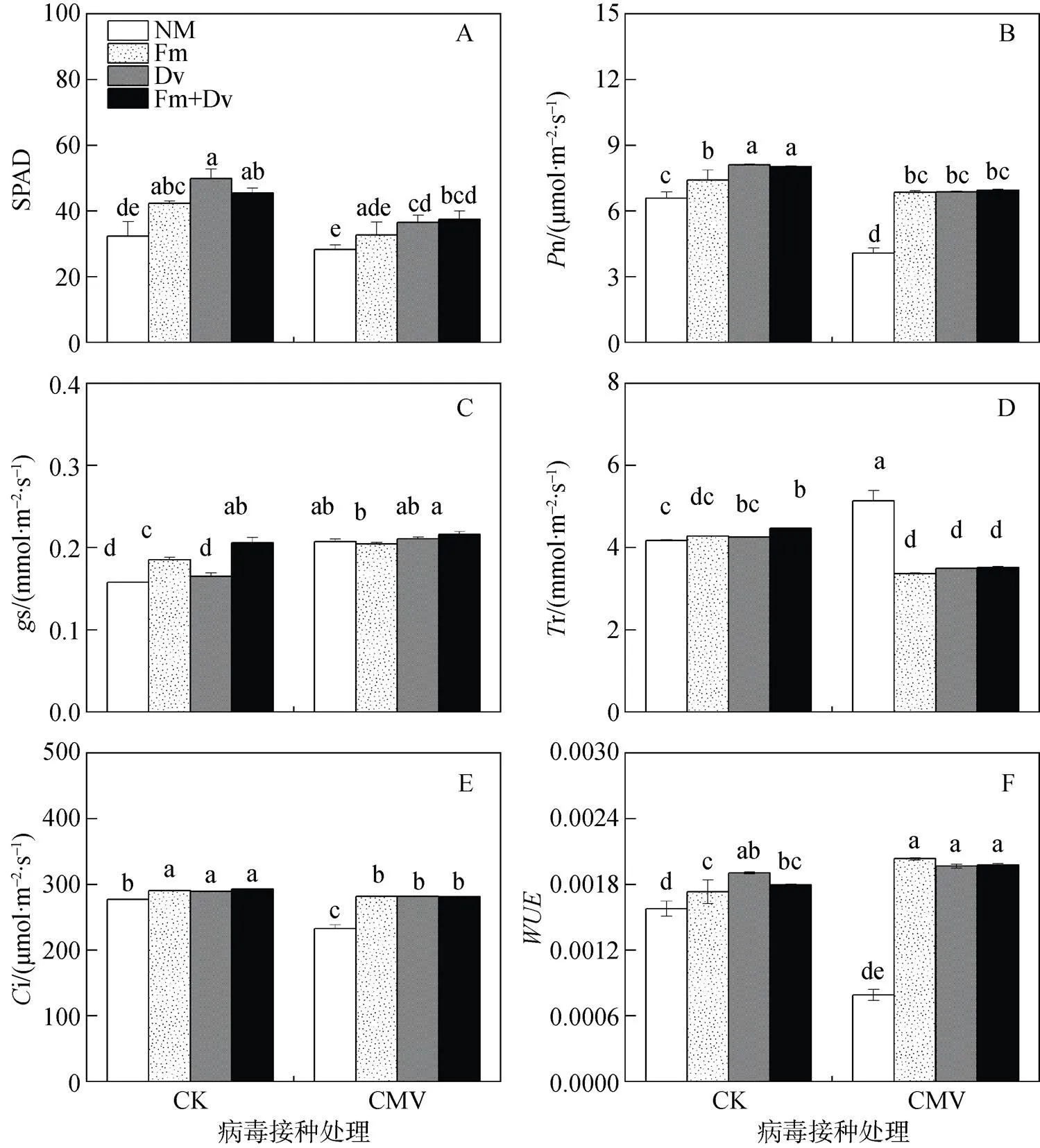
注: 每个数据代表四个重复的平均值(±标准误)。标有相同字母的柱子表示差异不显著(P > 0.05)。
Figure 3 Interactive effects of arbuscular mycorrhizal fungi (AMF) and(CMV) on relative chlorophyll contents (A), net photosynthetic rate (B), stomatal conductance (C), transpiration rate (D), intercellular CO2concentration (E) and instantaneous water use efficiency (F) of tobacco plants
2.3 AM真菌和CMV复合作用对菌根效应的影响
如图4所示, 除Dv接种植株外, CMV接种显著降低了菌根依赖性, 说明CMV对菌根的生长具有一定的抑制作用。同时, 在CMV接种条件下, 不同AM真菌的菌根依赖性间均存在显著差异, 最大值为Dv接种的植株, 说明Dv菌种对CMV感染植株的调控效应最为显著。
3 讨论
3.1 CMV和AM真菌的复合作用对烟草生长的影响
本实验中接种CMV显著降低了烟草的总生物量积累和光合参数(图2和图3), 说明CMV对烟草的生长和光合性能具有抑制作用; 然而接种AM真菌显著提高了烟草的生物量生产和光合性能, 同时不论接种CMV与否, 烟草的菌根依赖性(MD)均为正值, 说明接种AM真菌可以一定程度上减缓CMV的负效应, 从而增强宿主植物对CMV的抗性。本实验中接种AM真菌增强宿主植物对叶际病毒CMV的抗性与番茄接种后增强对(TYLCSV)的抗性[29]以及番茄接种后增强对(TSWV)的抗性是一致的, 但Elsharkawy等[10]对感染CMV的黄瓜接种后发现, 其生物量与未接种AM真菌的黄瓜没有显著差异, 接种AM真菌病没有提高宿主植物对CMV的抗性。另外, Shaul等[30]对感染(TMV)的烟草植株接种菌种后发现, 菌根植株的叶片比非菌根植物表现出更为严重的病毒感染症状, 这种接种AM真菌后宿主植物对病毒抗性降低的现象在对番茄[31]的研究中也有发现。这说明, AM真菌的效用及其对宿主植物的生物防护功能不仅依赖于AM真菌的种类、宿主植物、病原菌的种类, 而且依赖于三者之间的相互作用及其与环境的兼容性[14]。以往的研究表明, AM真菌提高植物抗病毒能力主要表现为以下四个方面: ①AM真菌提高宿主植物光合生理、营养和水分状况等, 从而增强植物对病原菌等的抵抗能力[14, 32]; ②AM真菌与病原菌对宿主植物根系侵染位点、空间及其碳水化合物利用等存在竞争作用[33–35]; ③AM真菌共生体会诱导宿主植物根系分泌物发生改变, 并形成独特的微生物区系保护层, 成为防御病原菌入侵的重要防御体系[36–37]; ④AM真菌能诱导宿主植物启动防御机制, 促进可溶性蛋白、SOD和POD等含量的增加, 从而增强宿主植物的抗病毒能力[38–39]。本实验中烟草光合性能的增强很可能是AM真菌提高宿主植物抗CMV侵染的主要调控机制。另外, 与未接种CMV的植株相比, 接种CMV后烟草植株的菌丝酶活性没有显著降低(图1), 说明CMV和AM真菌侵染位点间不存在竞争作用。然而, 由于所测指标有限, 在后续的研究中有必要从多个层面深入探讨其内在调控机理。
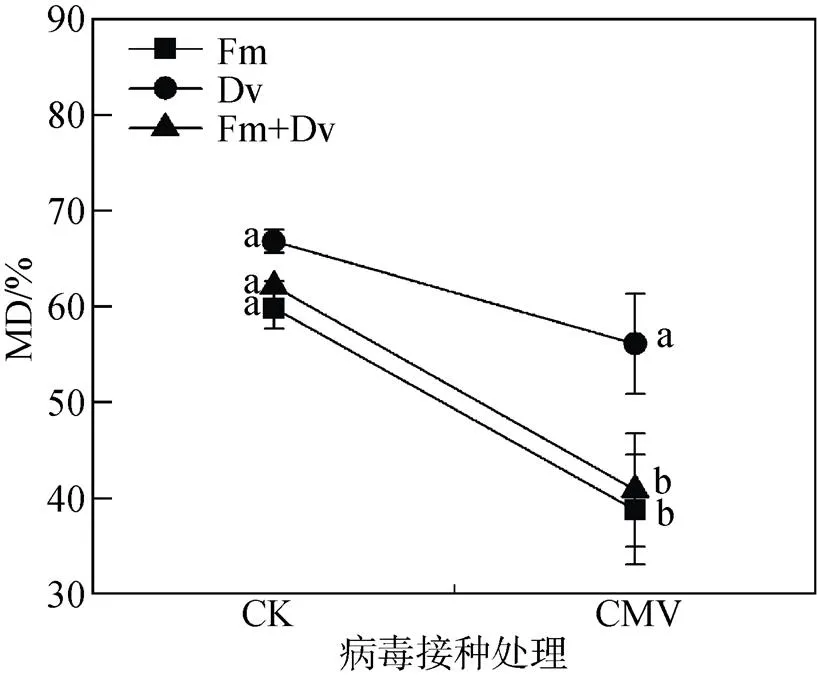
注: 每个数据代表十个重复的平均值(±标准误)。标有相同字母的柱子表示差异不显著(P > 0.05)。
Figure 4 Interactive effects of arbuscular mycorrhizal fungi (AMF) and(CMV) on mycorrhizal dependence of tobacco plants
3.2 不同AM真菌的菌根效应差异
本实验中的菌根效应在不同AM真菌间表现出显著差异,单独接种的菌根效应要高于和混合接种的效应, 尤其是在CMV接种条件下(图4)。目前, 关于AM真菌与病原菌的复合作用研究大多采用单一AM真菌接种, Berruti等[40]通过整合分析发现胁迫条件下单一AM真菌对植物生长的促进作用相比于多种AM真菌混合将更为有效。Gosling等[41]进一步通过实验验证发现, 对处于磷胁迫下的洋葱接种1—7种不同多样性组合的AM真菌后, AM真菌多样性的提高并没有显著提高菌根效应, 说明对农田生态系统来说不同AM真菌间存在功能冗余。然而, Klironomos[42]的研究则发现AM真菌的多样性越高越有利于高植物生产力的维持。Jansa等[43]的研究也指出, 接种混合AM真菌比接种单一菌种对植物养分吸收和生长的促进作用更为明显。这可能是由于混合菌种可实现不同AM真菌功能上的互补, 更有利于促进宿主植物生产力的提高[35, 44]。有研究者指出, 造成这种AM真菌菌根效应差异的原因在于所采用的实验处理[41]: 大多实验研究中, 宿主植物对AM真菌多样性的响应格局仅关注一种胁迫因子或病原菌; 实际上, 在自然条件下植物往往受到多种胁迫因子的共同作用, 且这些胁迫因子往往随季节或随机事件影响, 在这种情况下, 宿主植物和多种AM真菌共生无疑是有利的, 这就是所谓的“保底策略”(bet-hedging strategy); 而在宿主植物遭受一种胁迫时, 一种或少数几种功能相适应的AM真菌就可以减缓胁迫并为宿主植物提供最大收益, 因此, AM真菌多样性的增加反而导致功能冗余。本实验中, 以菌种的抗CMV效果最为显著, 而Veresoglou和Rillig[45]的整合分析发现在以往的大多数研究中的抗病原菌效果最好。因此, 在接下来的研究中结合野外实验验证并选择更为有效的AM真菌株系是非常有必要的。
4 结论
综上所述, 本实验中CMV显著抑制了烟草的生长和光合性能, 虽然CMV对AM真菌的效应具有一定的抑制作用, 接种AM真菌显著提高了烟草的生物量积累和光合性能, 说明接种AM真菌可以一定程度上减缓CMV对烟草生长的抑制作用, 从而增强宿主植物对CMV的抗性, 其中, 光合能力的提高有可能是感染CMV情况下菌根化烟草抗性提高的主要作用机理, 但还需要进一步的深入研究以揭示AM真菌对CMV的调控机理。相对于其他AM真菌,菌种的抗CMV效果最为显著, 但还需要结合野外实验, 进一步验证和筛选有效的烟草抗CMV菌种。
[1] 田友清, 丁平, 张云庆. 烟草药用研究概述[J]中国药业, 2015, 24(9): 126–128.
[2] 沈升法, 娄小平, 阮关海, 等. 浙江省烟草黄瓜花叶病毒病灾变因子调查与分析[J]. 浙江农业科学, 1999(6): 280–283.
[3] 程立锐, 陈小翠, 代帅帅, 等. 烟草黄瓜花叶病毒抗性位点发掘[J]. 中国烟草科学, 2018, 39(4): 1–6.
[4] 刘勇, 李凡, 李月月, 等. 侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J]中国农业科学, 2019, 52(2): 239–261.
[5] 王达新, 郭刚, 殷晓敏, 等. 黄瓜花叶病毒研究进展[J]现代农业科技, 2013(3): 121–123.
[6] GALLITELLI D. The ecology ofand sustainable agriculture[J]Virus Research, 2000, 71(1/2): 9–12.
[7] 黄学跃, 赵立红, 刘勇, 等. 黄瓜花叶病毒诱导烟草抗病性的生化研究[J]云南大学学报(自然科学版), 1999, 21(3): 236–238.
[8] 王春梅, 施定基, 朱水芳, 等. 黄瓜花叶病毒对烟草叶片和叶绿体光合活性的影响[J]植物学报, 2000, 42(4): 388–392.
[9] 王纬, 张晓彬. 烟草感染黄瓜花叶病毒病的生理特征及多效肥对其防治效果的研究[J]中国烟草学报, 1995, 2(4): 80–82.
[10] ELSHARKAWY M M, SHIMIZU M, TAKAHASHI H, et al. The plant growth-promoting fungusand the arbuscular mycorrhizal fungusinduce systemic resistance againstin cucumber plants[J]Plant and Soil, 2012, 361(1/2): 397–409.
[11] 李爱民, 薛林宝, 张永泰, 等. 黄瓜花叶病毒病防治策略研究进展[J]长江蔬菜, 2004(3): 38–42.
[12] 陈集双, 柴立红, 李全胜, 等. 黄瓜花叶病毒猖獗与气候变暖关系及其对策[J]生态农业研究, 2000, 8(4): 23–26.
[13] 沈小英, 宋双, 罗晶, 等. 抗烟草黄瓜花叶病毒多糖筛选及其对烟草防御酶活性的影响[J]微生物学报, 2013, 53(8): 882–888.
[14] HAO Zhipeng, XIE Wei, CHEN Baodong. Arbuscular mycorrhizal symbiosis affects plant immunity to viral infection and accumulation[J]Viruses, 2019, 11(6): 534.
[15] JUNG S C, MARTINEZ-MEDINA A, LOPEZ-RAEZ J A, et al. Mycorrhiza-induced resistance and priming of plant defenses[J]Journal of Chemical Ecology, 2012, 38(6): 651–164.
[16] FRENCH K E. Engineering mycorrhizal symbioses to alter plant metabolism and improve crop health[J]Frontiers in Microbiology, 2017, 8: 1403.
[17] KADAM S B, PABLE A A, BARVKAR V T. Mycorrhiza induced resistance (MIR): a defence developed through synergistic engagement of phytohormones, metabolites and rhizosphere[J]Functional Plant Biology, 2020, 47(10): 880–890.
[18] GENRE A, LANFRANCO L, PEROTTO S, et al. Unique and common traits in mycorrhizal symbioses[J]Nature Reviews Microbiology, 2020, 18(11): 1–12.
[19] PANDEY D, KEHRI H K, ZOOMI I, et al. Mycorrhizal fungi: Biodiversity, ecological significance, and industrial applications[M] // Yadav A N, Mishra S, Singh S, et al. Recent Advancement In White Biotechnology Through Fungi: Volume 1: Diversity and Enzymes Perspectives. Switzerland: Springer, 2019: 181–199.
[20] CULVER J N, LINDBECK A G C, DAWSON W O. Virus-host interactions: induction of chlorotic and necrotic responses in plants by Tobamoviruses[J]Annual Review of Phytopathology, 1991, 29(1): 193–217.
[21] MCNAMARA N P, BLACK H I J, BERESFORD N A, et al. Effects of acute gamma irradiation on chemical, physical and biological properties of soils[J]Applied Soil Ecology, 2003, 24(2): 117–132.
[22] QIU Yajing, ZHANG Naili, ZHANG Lili, et al. Mediation of arbuscular mycorrhizal fungi on growth and biochemical parameters ofin response to salinity[J]Physiological and Molecular Plant Pathology, 2020, 112: 101522.
[23] XIA Lina, SHAO Changliang, ZHANG Naili, et al. Improved tolerance of mycorrhizalseedlings to sulfuric acid rain related to phosphorus and zinc contents in shoots[J]Journal of Fungi, 2021, 7(4): 296.
[24] LEÓN-SÁNCHEZ L, NICOLÁS E, NORTES P A, et al. Photosynthesis and growth reduction with warming are driven by nonstomatal limitations in a Mediterranean semi-arid shrub[J]Ecology and Evolution, 2016, 6(9): 2725–2738.
[25] PHILLIPS J, HAYMAN D. Improved procedures for clearing roots and staining parasitic and vesicular- arbuscular mycorrhizal fungi for rapid assessment of infection[J]Transactions of the British mycological Society, 1970, 55(1): 158–161.
[26] GIOVANNETTI M, MOSSE B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots[J]New Phytologist, 1980, 84(3): 489–500.
[27] ZHAO B, TROUVELOT A, GIANIAZZI S, et al. Influence of two legume species on hyphal production and activity of two arbuscular mycorrhizal fungi[J]Mycorrhiza, 1997, 7(4): 179–185.
[28] PORRAS-SORIANO A, SORIANO-MARTÍN M L, PORRAS-PIEDRA A, et al. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions[J]. Journal of Chemical Ecology, 2009, 166(13): 1350–1359.
[29] MAFFEI G, MIOZZI L, FIORILLI V, et al. The arbuscular mycorrhizal symbiosis attenuates symptom severity and reduces virus concentration in tomato infected by(TYLCSV)[J]Mycorrhiza, 2014, 24(3): 179–186.
[30] SHAUL O, GALILI S, VOLPIN H, et al. Mycorrhiza-induced changes in disease severity and PR protein expression in tobacco leaves[J]Molecular Plant- Microbe Interactions, 1999, 12(11): 1000–1007.
[31] MIOZZI L, CATONI M, FIORILLI V, et al. Arbuscular mycorrhizal symbiosis limits foliar transcriptional responses to viral infection and favors long-term virus accumulation[J]Molecular Plant-Microbe Interactions, 2011, 24(12): 1562–1572.
[32] 吴强盛. 丛枝菌根真菌提高植物抗病机理研究进展[J]长江大学学报(自然科学版-农学卷), 2010, 1(2): 72–75.
[33] 刘金凤, 袁玉清, 郭邵霞, 等. 菌根真菌诱导植物抗病性特点与作用机制[J]青岛农业大学学报(自然科学版), 2015, 32(2): 83–91.
[34] 刘润进, 沈崇尧, 裘维蓍. 关于AM真菌与黄萎病菌存在侵染中的竞争作用[J]土壤学报, 1994, 31(增刊): 224–229.
[35] WEHNER J, ANTUNES P M, POWELL J R, et al. Plant pathogen protection by arbuscular mycorrhizas: A role for fungal diversity?[J]. Pedobiologia, 2010, 53(3): 197–201.
[36] POZO M J, AZCON-AGUILAR C. Unraveling mycorrhiza- induced resistance[J]Current Opinion in Plant Biology, 2007, 10(4): 393–398.
[37] 高萍, 李芳, 郭艳娥, 等. 丛枝菌根真菌和根瘤菌防控植物真菌病害的研究进展[J]草地学报, 2017, 25(2): 236–242.
[38] 张玉, 杨爱国, 冯全福, 等. 植物病程相关蛋白及其在烟草中的研究进展[J]生物技术通报, 2012(5): 20–24.
[39] ZAMIOUDIS C, PIETERSE C M J. Modulaiton of host immunity by beneficial microbes[J]Molecular Plant- Microbe Interactions, 2012, 25(2): 139–150.
[40] BERRUTI A, LUMINI E, BALESTRINI R M, et al. Arbuscular Mycorrhizal Fungi as Natural Biofertilizers: Let's benefit from past successes[J]Frontiers in Microbiology, 2016, 6(426): 1559.
[41] GOSLING P, JONES J, BENDING G D. Evidence for functional redundancy in arbuscular mycorrhizal fungi and implications for agroecosystem management[J]Mycorrhiza, 2016, 26(1): 77–83.
[42] KLIRONOMOS J N. Variation in plant response to native and exotic arbuscular mycorrhizal fungi[J]Ecology, 2003, 84(9): 2292–2301.
[43] JANSA J, SMITH F A, SMITH S E. Are there benefits of simultaneous root colonization by different arbuscular mycorrhizal fungi?[J]. New Phytologist, 2008, 177(3): 779–789.
[44] VAN DER HEIJDEN M G A, KLIRONOMOS J N, URSIC M, et al. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity[J]Nature, 1998, 396(6706): 69–72.
[45] VERESOGLOU S D, RILLIG M C. Suppression of fungal and nematode plant pathogens through arbuscular mycorrhizal fungi[J]Biology Letters, 2012, 8(2): 214–217.
Interactive effects of two arbuscular mycorrhizal fungi andon the growth and photosynthetic capabilities of tobacco
Pei jia, LIANG Jin, JIN Xiahuan, XIA Lina, HE Xiaobin, WANG Yanhong*
State Key Laboratory of Subtropical Silviculture, Zhejiang A & F University, Hangzhou 311300, China
In order to elucidate the interactive effects of arbuscular mycorrhizal fungi (AMF) andvirus (CMV) on the growth and photosynthetic capabilities of tobacco, a greenhouse experiment was conducted. During the experiment, inoculated (inoculation with,, either alone or their combination) and non-inoculated (inoculation with sterilized AM fungi) tobacco seedlings were randomly subjected to two CMV regimes (inoculated with or without CMV). The results showed that CMV significantly decreased the total dry weight, net photosynthetic rate () and instantaneous water use efficiency (), whereas Mycorrhizal inoculation significantly improved root colonization rate, fungal activities of succinate dehydrogenase and alkaline phosphatase, total dry weight,andof tobacco plants. Furthermore, whether inoculation with CMV or not, mycorrhizal inoculation conferred positive effects on the growth of tobacco plants especially with the inoculation of, and there were differences in mycorrhizal benefits between AM fungi species. In conclusion, mycorrhizal inoculation promoted the resistance of tobacco to CMV, and the enhancement in photosynthetic capabilities might be the underlying mechanism for mycorrhizal efficiency.
arbuscular mycorrhizal fungi;; tobacco; photosynthetic capability; biomass accumulation
10.14108/j.cnki.1008-8873.2024.01.007
R282.4
A
1008-8873(2024)01-055-08
2021-07-28;
2021-09-28基金项目:国家自然科学基金项目(No. 31400366; 32071644); 中国科学院战略性先导项目(XDB 31030000); 浙江省“尖兵”“翎雁”研发攻关计划项目(2022C02019)
裴佳(1995—), 女, 江苏人, 硕士研究生, 主要研究方向为菌根生态学和植物生态学, E–mail: 2019602042032@stu.zafu.edu.cn
通信作者:王艳红, 女, 博士, 副教授, 主要研究方向为恢复生态学和菌根生态学, E–mail: wangyanhong@zafu.edu.cn
裴佳, 梁瑾, 金夏焕, 等. 两种丛枝菌根真菌和黄瓜花叶病毒复合作用对烟草生长和光合特性的影响[J]. 生态科学, 2024, 43(1): 55–62.
PEIJia, LIANG Jin, JIN Xiahuan, et al. Interactive effects of two arbuscular mycorrhizal fungi andon the growth and photosynthetic capabilities of tobacco[J]. Ecological Science, 2024, 43(1): 55–62.
