BM-MSCs延缓CD8+初始T细胞衰老
2024-04-26高竞溪赵晓妍朱星雨赵春华
高竞溪,赵晓妍,朱星雨,孙 昭,韩 钦*,赵春华*
1.中国医学科学院基础医学研究所 北京协和医学院基础学院 中国医学科学院组织工程研究中心,北京 100005;2.中国医学科学院 北京协和医学院 北京协和医院 肿瘤内科,北京 100730
随着年龄的增长,外部与内部压力的累积导致人体的生理完整性(physiological integrity)逐渐受损,同时组织从压力中恢复的能力日渐衰弱,致使机体功能受损和死亡风险的增加。临床数据表明,老年人自身免疫疾病、感染、肿瘤等发病率的上升与免疫系统老化具有密切联系[1-2]。免疫系统功能减弱导致衰老细胞无法即时被清除,便会利用衰老相关分泌表型(senescence-associated secretory phenotype, SASP)帮助衰老细胞对抗免疫系统的清除,导致衰老细胞积累,加速机体衰老[3-4]。免疫早衰模型小鼠的各器官呈现衰老相关损伤并伴随机体早衰及寿命缩短,而补充年轻的免疫细胞可以减缓衰老进程[5-6],证明免疫细胞的衰老及功能减退在机体衰老过程中扮演重要的角色。
T细胞老化可能是“免疫衰老”的主要表现之一,即免疫系统活力的时间依赖性丧失,损害了有害元素(如微生物或恶性细胞)的清除[7],同时增加了导致炎症和自身免疫疾病等不必要的过度反应。探究免疫细胞,特别是T细胞的衰老过程及其机制,是缓解与衰老相关的免疫失衡和应激信号反应能力丧失的重要途径。T 淋巴细胞的年龄依赖性变化,主要包括初始细胞的免疫多样性下降和衰老T细胞数量的增加等[8]。
前期研究表明,移植年轻来源的骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSCs)可以下调衰老小鼠的衰老标志物表达和SASP的分泌,缓解胸腺、脾脏、卵巢等组织的衰老,延长小鼠[9]和大鼠[10]的健康寿命。但是,关于MSCs延缓细胞、组织衰老的探索较为宏观,其中关键细胞类型变化的研究尚存在较多空缺。因此,本文拟验证BM-MSCs缓解免疫衰老的作用,并探究其主要改善的免疫细胞群体。
1 材料与方法
1.1 材料
1.1.1 主要试剂:抗CD28抗体、抗CD3抗体和IL-2(北京科昕生物科技有限公司);RPMI-1640(北京协和细胞资源中心);胎牛血清(Gibco公司);LIVE/DEADTM可固定近红外死细胞染色剂试剂盒、eBioscienceTM流式胞内固定破膜缓冲液(Thermo Fisher Scientific公司);CD3-PerCP/Cyanine5.5、CD45-PE、CD62L-PE/Cyanine7、CD44-Brilliant Violet 510(BioLegend公司);CD8α-APC、CD4-APC(Cell Signaling Technology公司); p16INK4a抗体、p21Cip1抗体(Abcam公司);山羊抗兔荧光二抗(金普来生物科技有限公司);40 μm细胞过滤器(BD Falcon公司)。
1.1.2 小鼠:6周龄,SPF级,野生型C57BL/6(H-2b)小鼠(北京维通利华实验动物科技有限公司)。所有动物均饲养在特定无病原体设施的隔离笼中。所有程序和方案均经动物研究所实验动物使用与管理委员会批准。
1.2 方法
1.2.1 细胞分离与培养:从6周龄C57小鼠的后腿分离BM-MSCs,具体提取与培养方法参见文献[11]。
1.2.2 构建体外复制性衰老模型:从6周龄C57小鼠的脾脏分离脾淋巴细胞,以2×106个细胞每孔接种于24孔板中,以anti-CD28(2.5 μg/mL)、anti-CD3(1 μg/mL)、IL-2(100 U/mL)刺激增殖7 d。
1.2.3 小鼠脾脏细胞与BM-MSCs共培养:丝裂霉素(10 mg/mL)2小时预处理BM-MSCs抑制其增殖,以2×105个细胞每孔接种于24孔板中,过夜贴壁,脾淋巴细胞以2×106个每孔接种于BM-MSCs预铺孔中。
1.2.4 流式细胞测量术检测细胞衰老表型:以1 mL PBS重悬细胞,PBS洗涤2次;用LIVE/DEAD-APC-Cy7染色,4 ℃孵育30 min,洗涤2次;用CD45-PE、CD3-PC5.5、CD8-APC、CD44-Bv510、CD62L-PE-Cy7抗体混合染色,4 ℃孵育30 min,洗涤2次;分别用固定缓冲液和渗透缓冲液4 ℃孵育10 min,加入p16/p21抗体,4 ℃孵育40 min,洗涤3次;加入荧光二抗,4 ℃孵育40 min,洗涤3次。样品通过40 μm细胞过滤器,使用Cytoflex流式细胞仪分析,FlowJo软件分析数据。
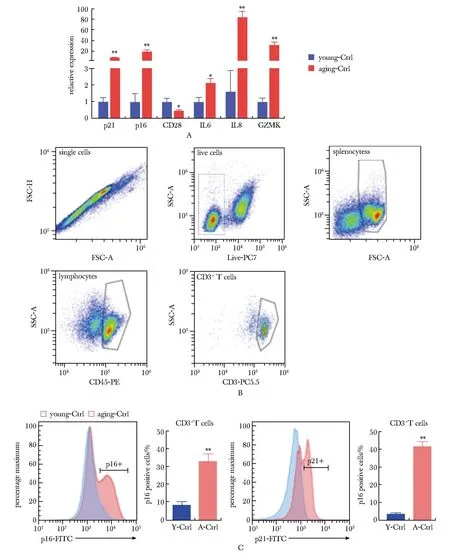
A.senescence marker expression in young splenic lymphocytes and replicative senescence model constructed after 7 days of stimulated proliferation in vitro; B.gating strategy for mouse splenic T cells; C.flow cytometry analysis of splenic T cells (CD45+CD3+) in young-Ctrl and aging-Ctrl;*P<0.05, **P<0.001 compared with young-Ctrl.
1.3 统计学分析
2 结果
2.1 体外复制性衰老细胞模型的构建
分离原代小鼠脾脏细胞,体外用CD3抗体刺激T细胞增殖,持续刺激7d,构建复制性衰老细胞模型。持续刺激7 d进行qPCR定量分析,结果显示相比于年轻对照,衰老模型的典型衰老标记(p16、p21)、衰老相关分泌表型(senescence-associated secretory phenotype, SASP)(IL6、IL8)和炎性衰老标记(Granzyme K,GZMK)上调,T细胞功能相关的CD28下调,指示T细胞呈现衰老表型且功能受损。进一步流式细胞测量术揭示, CD45+CD3+T淋巴细胞(图1A)p16、p21高表达的衰老细胞分别占33.22%±3.9%和41.78%±2.3%,显著高于年轻对照组的8.37%±1.7%和3.04%±0.4%(图1B,C)。因此后续实验以刺激1d的细胞为年轻对照(young-Ctrl),持续刺激7 d的细胞为衰老对照(aging-Ctrl)。
2.2 CD8+T细胞衰老更显著
进一步探究T细胞不同群体的复制性衰老表型,在T细胞的基础上采用流式细胞测量术划分CD4+T细胞(CD3+CD4+)和CD8+T细胞(CD3+CD8+)(图2A),分别检测p16、p21的表达情况。结果显示,对于体外复制性衰老模型来说,CD8+T细胞p16、p21高表达的衰老群体比例分别为64.14%±10.3%和71.85%±3.0%,显著高于 CD4+T细胞的17.65%±0.8%和36.23%±1.6%(图2B)。
2.3 BM-MSCs共培养对CD8+T细胞抗衰效果更为明显
为探究BM-MSCs对脾脏T淋巴细胞的作用,将BM-MSCs与复制性T细胞衰老模型共培养(aging-Msc),观察其对衰老T细胞的影响。发现与BM-MSCs共培养后,脾来源T淋巴细胞的p16阳性比例从34.22%±4.4%下调至24.15%±1.4%(图3A)、p21阳性比例从41.14%±2.2%下调至27.05%±4.3%(图3B),均具有显著差异,其中CD8+T细胞的p16、p21阳性细胞比例下调的均值分别为19.75%和27.91%高于CD4+T细胞的4.55%和7.92%(图3A, 3B)。这部分结果提示复制性衰老模型中,CD8+T细胞是衰老最显著的,也是BM-MSCs延缓衰老表型最显著的细胞群体。
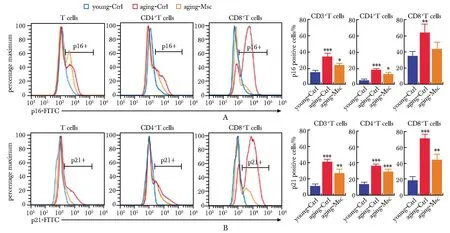
A,B.flow cytometry analysis of splentic T cells, CD8+T cells and CD4+T cells, stained with p16(A) or p21(B); The corresponding statistics were shown on the right;*P<0.05, **P<0.01, ***P<0.001 compared with young-Ctrl.
2.4 BM-MSCs通过维持CD8+初始T细胞的比例和状态延缓衰老
深入分析发现CD8+T细胞的衰老并不同步,而是存在较易衰老的细胞群体(图4A)。为探究CD8+T细胞主要衰老和共培养后延缓衰老的亚群,本文划分了初始(CD62L+CD44-)、效应(CD62L-CD44+)和记忆细胞(CD62L+CD44+)(图4B)。分析各细胞亚群占比发现,年轻对照组初始细胞占86.53%、效应细胞占13.44%和记忆细胞占0.03%,衰老对照组分别占62.55%、37.34%和0.11%,BM-MSCs共培养后分别占88.62%、10.74%和0.64%。体外持续刺激的复制性衰老导致效应 T细胞比例上调,对应的初始T细胞比例下调,共培养后初始T细胞亚群的比例得到恢复(图4C)。由于记忆细胞绝对细胞数量太少,后续衰老标志比例分析只对效应细胞和初始细胞进行比较分析。

A.representative flow plots of CD8+ T cells from primary splenocytes (young-Ctrl), replicative senescence model (aging-Ctrl) and senescence model cells cocultured with BM-MSCs (aging-Msc),arrowheads indicate p16/p21-positive cells; B.gating strategy for naive(CD62L+CD44-), effector(CD62L-CD44+)and memory(CD62L+CD44+)CD8+T cells; C.histogram of naive, effector and memory cells proportion in CD8+T cells from young-Ctrl, aging-Ctrl and aging-Msc; D.representative flow cytometry analysis of naive and effector CD8+T cells;E.statistical histogram of the proportion of p21 positive cells in aging-Ctrl and aging-Msc; *P<0.05, **P<0.001 compared with aging-Ctrl.
CD8+T细胞各亚群的p21表达都随增殖时间的延长而上调,效应细胞p21阳性细胞比例从年轻组的3.36%±2.5%上调至83.65%±11.4%,初始细胞从0.01%±0.02%上调至2.63%±0.4%(图4D)。BM-MSCs共培养后效应细胞p21阳性比例无明显变化,而初始细胞的p21阳性细胞比例在共培养后从2.63%±0.4%下调至1.59%±0.2%,(图4E)。结合前述细胞亚群比例的变化(图4C),得出效应细胞衰老占比升高是CD8+T细胞p21上调的主要原因;共培养后初始细胞p21表达的下调及其比例的保持是CD8+T细胞p21表达回落的主要原因。
3 讨论
如何防治衰老相关疾病从而实现健康长寿是衰老研究中长期存在的问题。作为驱动机体衰老的重要因素,免疫系统的功能减退导致了机体感染率增加、癌症易感性增加以及疫苗效力的降低[7]。有充分的证据表明,T 淋巴细胞经历了主要的年龄依赖性变化,其质与量的变化是导致衰老时体液免疫和细胞免疫应答异常的主要原因[6]。此前,本课题组发现MSCs对T细胞的免疫功能起支持作用[12]。那么MSCs是否可以起到延缓T细胞衰老的作用?如果可以,其主要作用于哪些靶细胞群体? 基于此,本文构建了体外复制性衰老模型,借助流式细胞术划分不同细胞群体,并以p16和p21的高表达指示细胞衰老。
与刺激增殖1 d的对照组相比,持续增殖7 d的T细胞出现了p16、p21高表达的衰老细胞群体。进行亚群间比较发现,CD8+T细胞的衰老表型更为显著。已经有研究表明,与CD4+T细胞相比,CD8+T细胞在衰老过程中可能对表型和功能的变化更敏感,更快地表现出衰老状态[13],这与本实验结果一致,也反应了复制性衰老模型可一定程度上模拟T细胞自然衰老的在体状态。BM-MSCs共培养可以延缓衰老T细胞p16、p21的上调,对CD8+T细胞效果最佳,这可能与CD8+T细胞本身比CD4+T细胞衰老更为显著有关。继续对CD8+T细胞进行亚群细分,三个亚群中,效应细胞的衰老最为显著。但BM-MSCs共培养对衰老的效应细胞没有明显的影响,反而显著抑制初始细胞的衰老。结合已经报道的T淋巴细胞的衰老主要表现为初始细胞的免疫多样性下降[14],提示BM-MSCs移植可能通过抑制初始T细胞衰老,达到缓解免疫衰老的目的。
本研究目前还存在很多问题有待进一步研究。比如目前的数据仅以体外复制性衰老模型模拟小鼠的免疫衰老,缺少体内证据,需要进一步完成体内验证,才能对BM-MSCs的抗免疫衰老得出可靠的结论。此外本研究仅探究了MSCs发挥抗衰作用的主要靶细胞,具体分子机制还有待阐述。免疫衰老是多种细胞和微环境共同作用的结果,为还原在体状态,本研究与BM-MSCs共培养时并未分选出CD8+T细胞,因此可能存在中间细胞参与BM-MSCs对CD8+T细胞的抗衰作用。
综上所述,本实验构建了T细胞体外复制性衰老细胞模型,证明了其中CD8+T细胞衰老表现最显著。BM-MSCs共培养可以缓解T细胞衰老,对于CD8+T细胞的抗衰作用更显著,主要作用于抑制了CD8+初始T细胞的衰老。本文为T细胞衰老的机制研究提供了体外模型,为理解T细胞的衰老过程和MSCs对其的延缓作用提供更细化的视角。
