循环CD4+CD45RA+CD62L+ T细胞与接受EGFR-TKI治疗的转移性非小细胞肺癌预后相关
2024-04-26操辰新耿瑞璇郭伏平白春梅王颖轶李太生
操辰新,唐 辉,耿瑞璇,郭伏平,白春梅,王颖轶*,李太生*
中国医学科学院 北京协和医学院 北京协和医院 1.肿瘤内科;2.国际医疗部;3.感染科,北京 100730
肺癌(lung cancer)是世界上第二大常见的肿瘤,病死率很高。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的80%至85%。超过50%的患者在诊断时已经是局部晚期或发生远处转移[1]。非小细胞肺癌治疗前的分子检测已经在广泛开展。表皮生长因子受体(epidermal growth factor receptor,EGFR)基因的突变是NSCLC最常见的突变。与使用传统化疗相比,使用奥西替尼等靶向药物可以明显延长伴有EGFR突变的NSCLC患者的寿命[2]。目前还缺乏预测EGFR酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitor,EGFR-TKI)治疗效果的可靠生物标志物。由于整个肿瘤的潜在遗传异质性,肿瘤组织活检被认为是确定靶向治疗期间肿瘤进展的金标准[3]。由于常常难以获得足够的肿瘤组织,有必要开展无创的液体活检去评估肿瘤靶向治疗的疗效。循环淋巴细胞和肿瘤免疫治疗已被充分研究以确定其预后价值[4-5]。同时,循环淋巴细胞亚群与EGTR-TKI治疗反应之间呈正相关,既往研究结果证实了参与EGFR-TKI治疗的循环淋巴细胞亚群的预后价值[6]。本研究是一项回顾性研究,进一步探讨了循环淋巴细胞谱与接受EGFR-TKI治疗的转移性非小细胞肺腺癌患者预后之间的相关性。
1 材料与方法
1.1 对象
2019年1月1日至2021年9月30日在北京协和医院肿瘤内科诊断为NSCLC的患者在本研究期间进行了筛查。入选标准如下:1)组织病理学证实的转移性NSCLC,根据AJCC第八版分期为IVA或IVB期(伴有远处转移);2)至少有一个有明确记录的EGFR突变;3)接受第一代或第三代EGFR-TKI治疗;4)在EGFR-TKI治疗期间进行淋巴细胞亚群的动态监测。排除标准如下:1)治疗1个月内死亡或无随访, 生存结果无法评估;2)任何已知的第二原发肿瘤;3)通过电话随访患者的生存结局。本研究经北京协和医院医学伦理委员会(S-K2098)批准,遵循《赫尔辛基人体实验宣言》进行。
1.2 方法
研究过程中会给予患者EGFR-TKI治疗直至肿瘤疗效评估为进展。最后一次随访时间是2022年10月30日。每2~3个月需对接受治疗的患者进行影像学检查,包括断层扫描和磁共振成像,以评估肿瘤治疗治疗效果。研究中使用实体肿瘤疗效评价标准(response evaluation criteria in solid tumors version 1.1,RECIST 1.1)评估肿瘤应答。达到完全缓解或部分缓解的患者被定义为对EGFR-TKI治疗有应答者,而其他患者被认为是对EGFR-TKI治疗无应答者。PFS定义为从EGFR-TKI治疗开始日期到肿瘤发生进展或死亡的时间。OS定义为从开始EGFR-TKI治疗到因任何原因死亡的时间。使用2 mL EDTA管收集外周血样本,并使用一组针对T淋巴细胞亚群和同型对照的单克隆抗体进行检测(Immunotech公司)。外周血淋巴细胞免疫表型采用三色流式细胞测量术(Epics XL)来监测[7],所有外周血样本TB淋巴细胞亚群11项均在中国医学科学院北京协和医院检验科完成检测。
1.3 统计学分析
对连续变量采用Mann-WhitneyU检验,对分类变量采用Pearson卡方检验和Fisher精确检验。CD4+CD45RA+CD62L+T细胞计数预测EGFR-TKI治疗应答的临界值采用受试者工作特征曲线(receiver-operating characteristic,ROC)曲线确定。进行单因素和多因素Cox分析,确定与生存结局相关的变量,其中,只选择单因素分析中有统计学意义的因素进行多因素分析。为了分析EGFR-TKI治疗后CD4+CD45RA+CD62L+T细胞计数的动态监测结果,建立EGFR-TKI治疗1个月后CD4+CD45RA+CD62L+T细胞计数与基线水平的比值。利用R软件包Survminer计算预测PFS的最佳比值临界值。CD4+CD45RA+CD62L+T细胞计数的增加或稳定定义为大于或等于最佳临界值(0.75),并使用Kaplan-Meier方法和log-rank检验进一步估计生存结果。采用倾向分数匹配(propensity-score matching,PSM)减少混杂因素的影响。倾向分数是根据药物、年龄和治疗路线计算的。所有统计分析均使用R软件(版本为3.6.1,https://www.r-project.org/)进行。所有P值均为双尾,P<0.05设为有统计学意义。
2 结果
2.1 临床资料
共有40例患者参与了这项研究,中位年龄为63岁(41~85岁)。中位随访时间为29.5个月(表1)。19例(47.5%)患者的日常活动能力评分(performance status,PS)为0。所有患者均为Ⅳ期疾病,分子检测结果显示,22例(55%)、13例(32.5%)和5例(12.5%)患者分别存在19个外显子缺失、L858R突变和T790M突变。大多数患者接受EGFR-TKI作为一线治疗(line 1 of therapy)(72.5%)。一线治疗定义为在此之前未接受其他针对NSCLC初次选择的治疗方法。
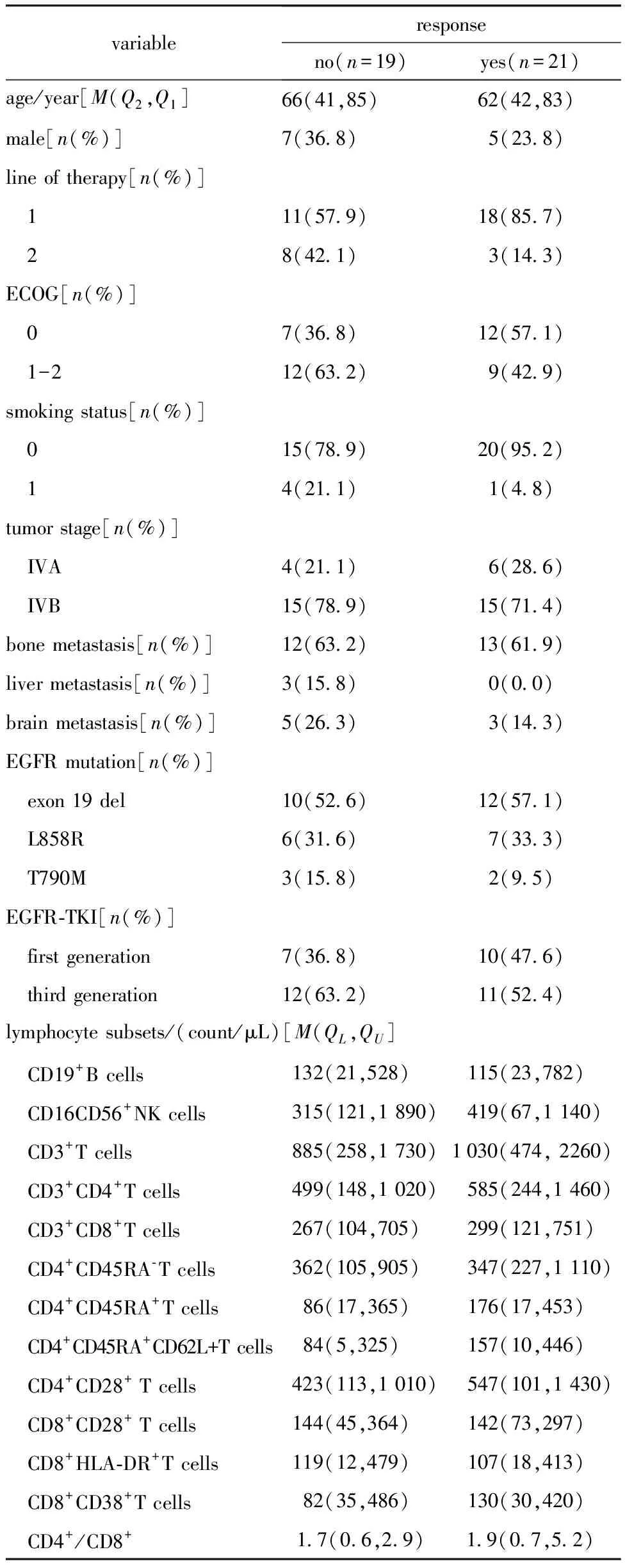
表1 EGFR-TKI应答者和EGFR-TKI无应答者的基线特征和Pearson卡方检验结果
2.2 CD4+CD45RA+CD62L+ T细胞计数与肿瘤治疗客观有效率
CD4+CD45RA+T细胞计数和CD4+CD45RA+CD62L+T细胞计数与EGFR-TKI治疗应答相关(表1)。单因素和多因素Cox分析显示,CD4+CD45RA+CD62L+T细胞计数对PFS没有预测价值。同时,CD4+CD45RA+CD62L+T细胞计数高的患者具有显著更高的客观有效率(objective response rate,ORR)(79.2%vs12.5%),特异性为0.74,敏感性为0.91(图1)。循环淋巴细胞水平动态变化与疗效的相关性方面,CD4+CD45RA+CD62L+T细胞计数增加或稳定时,客观有效率显著提高(81.8%vs16.7%;P<0.001)(图2A,C),特异性和敏感性分别为0.79和0.86(图2B)。
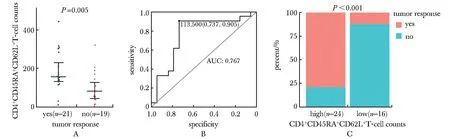
A.comparison of CD4+CD45RA+CD62L+ T-cell counts of EGFR-TKI therapy responders and nonresponders;B.validation of the predictive value of the CD4+CD45RA+CD62L+ T-cell counts for the EGFR-TKI therapy response using a ROC curve;C.comparison of EGFR-TKI therapy responses of patients with high(≥114 cells/μL) and low(<114 cells/μL) CD4+CD45RA+CD62L+ T-cell counts.
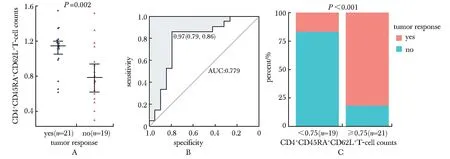
A.comparison of dynamic changes in CD4+CD45RA+CD62L+ T-cell counts between EGFR-TKI therapy responders and nonresponders; B.validation of the predictive value of the CD4+CD45RA+CD62L+ T-cell counts for the EGFR-TKI therapy response using a ROC curve.The cutoff value of 0.75 was calculated using R software; C.comparison of EGFR-TKI therapy response of patients with increased or stable(≥0.75) and decreased(<0.75) CD4+CD45RA+CD62L+ T-cell counts.
2.3 CD4+CD45RA+CD62L+ T细胞计数与生存结局
研究中共发生6例死亡和23例进展。总人群ORR为52.5%。中位PFS为27.1个月,中位OS未达到。然而,基线循环淋巴细胞亚群与PFS之间没有显著相关性。单因素Cox回归分析(表2)显示,CD19+B细胞和CD4+CD45RA+CD62L+T细胞的动态变化是EGFR-TKI治疗后PFS的潜在预测指标。
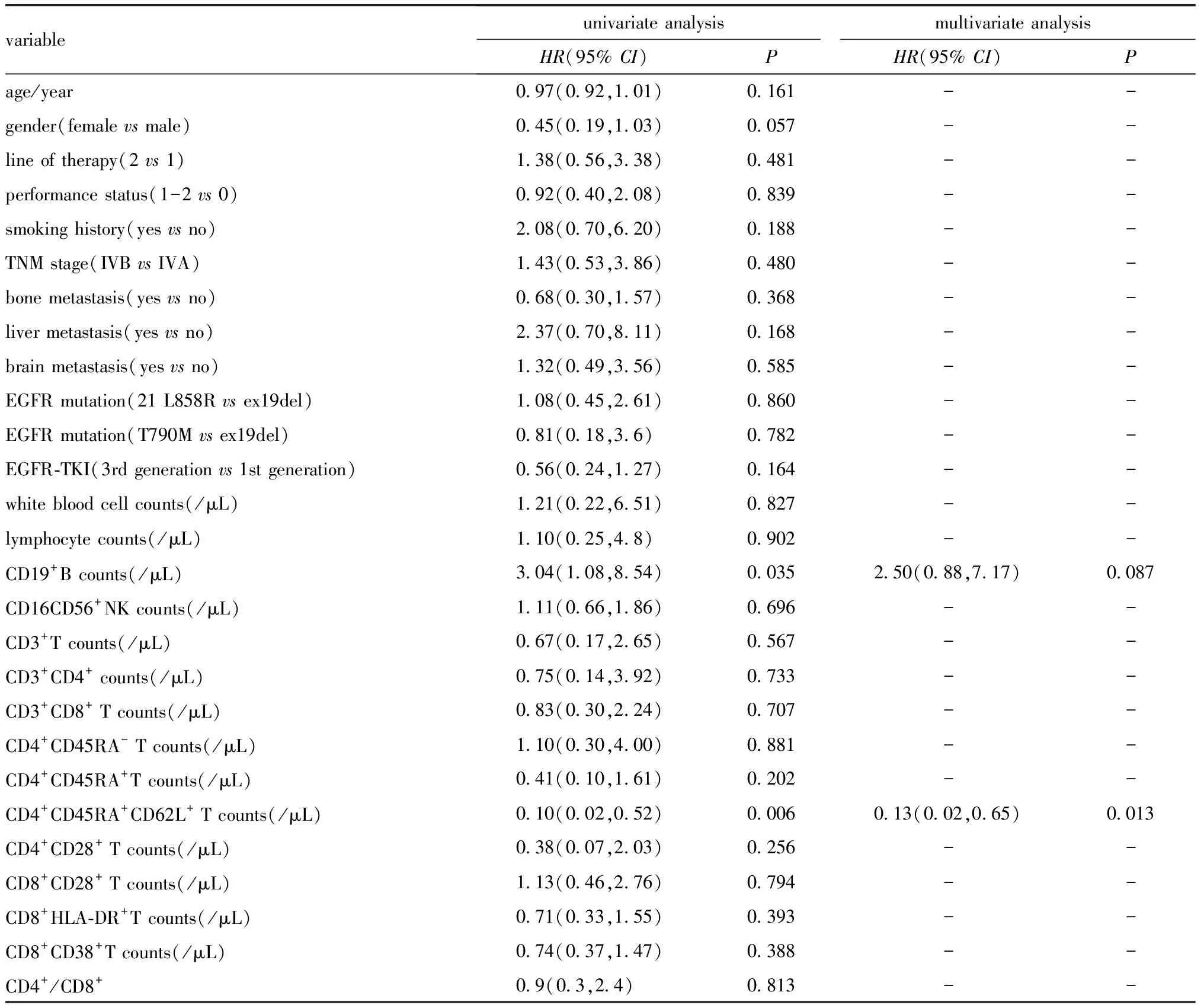
表2 循环T淋巴细胞计数及其动态变化与PFS的相关性
此外,多变量分析显示,CD4+CD45RA+CD62L+T细胞计数的动态变化是EGFR-TKI治疗效果的独立预测因,P<0.05)。然而,没有存在T淋巴细胞亚群与OS相关。根据治疗后CD4+CD45RA+CD62L+T细胞计数与基线CD4+CD45RA+CD62L+T细胞计数的比值,将患者分为两组,临界值为0.75(升高或稳定组:≥0.75; 减少组:<0.75)。PSM分析显示,增加或稳定组的PFS更长(P<0.05)。然而,OS差异无统计学意义(图3)。

A.Kaplan-Meier curves of PFS with increased or stable(≥0.75) and decreased(<0.75) CD4+CD45RA+CD62L+ T-cell counts;B.Kaplan-Meier curves of OS with increased or stable(≥0.75) and decreased(<0.75) CD4+CD45RA+CD62L+ T-cell counts;C.Kaplan-Meier curves of PFS with increased or stable(≥0.75) and decreased(<0.75) CD4+CD45RA+CD62L+ T-cell counts after using PSM;D.Kaplan-Meier curves of OS with increased or stable(≥0.75) and decreased(<0.75)CD4+CD45RA+CD62L+ T-cell counts afer using PSM.
3 讨论
靶向治疗可显著延长驱动基因阳性NSCLC患者的生存期,同时降低肿瘤治疗不良的发生率。然而,目前缺乏具有满意灵敏度的动态监测的无创生物标志物。本研究探讨了循环淋巴细胞在预测转移性NSCLC患者EGFR-TKI治疗应答的价值。组织活检和无创液体活检已成为动态监测非小细胞肺癌靶向治疗的重要手段。用于液体活检的常见生物标志物包括循环肿瘤细胞、循环肿瘤DNA、无细胞DNA和外泌体[8]。既往研究表明,循环淋巴细胞在抗肿瘤治疗中具有预后价值,CD8+CD28+T细胞计数是预测肿瘤免疫治疗效果的重要因素[9]。尽管外周循环淋巴细胞亚群对免疫治疗的预后价值已经得到了很好的研究,但EGFR-TKI治疗的疗效与外周循环淋巴细胞亚群之间的关系尚不清楚。本研究发现基线CD4+CD45RA+和CD4+CD45RA+CD62L+T细胞与EGFR-TKI疗效相关,有趣的是,只有CD4+CD45RA+CD62L+T细胞计数的动态变化与EGFR-TKI治疗的疗效相关。白细胞共同抗原CD45(common lymphocyte antigen CD45,CD45RA)是幼稚T细胞的标志物。L-选择素在幼稚T细胞从外周血向淋巴结的迁移中起重要作用。当细胞因子刺激发生时,CD4+CD45RA+CD62L+T细胞分化为辅助性T细胞,在免疫应答中起作用[10]。在抗肿瘤免疫应答过程中,当T淋巴细胞识别肿瘤特异性抗原并抑制其在肿瘤部位的T淋巴细胞浸润时,T细胞表面CD62L表达会下降[11]。一些研究发现,幼稚T细胞计数在NSCLC患者中下降,这种差异在晚期NSCLC人群中更为显著[12]。本研究是第一个使用动态监测方法描述接受EGFR-TKI治疗的晚期NSCLC患者循环CD4+CD45RA+CD62L+T细胞预后价值的研究。然而,本研究仍然有一些局限性。首先,样本量很小,没有包括所有类型的EGFR突变。其次,患者复杂的临床特征可能会产生潜在的偏倚。第三,由于流式细胞测量术中使用的表面标志物的局限性,可能不足以包括所有参与抗肿瘤免疫的免疫细胞。
综上,本研究证实了循环淋巴细胞与接受EGFR-TKI治疗的转移性NSCLC的疗效相关,同时期待更大样本量的研究进一步验证,并探索更多NSCLC靶向治疗过程中的生物标志物。
