血尿素氮水平对急性冠状动脉综合征患者PCI术后MACE的预测价值
2024-04-26高晓倩于华惠焦晓璐吕倩雯秦彦文
高晓倩,于华惠,刘 圣,焦晓璐,吕倩雯,张 铭,秦彦文*
1.首都医科大学附属北京安贞医院/北京市心肺血管疾病研究所,北京 100029;首都医科大学附属北京安贞医院 2.心血管重塑相关疾病教育部重点实验室;3.心内科,北京 100029
心血管疾病是世界上常见的死亡原因之一[1],急性冠状动脉综合征(acute coronary syndrome,ACS)是一种常见的严重的心血管疾病,是冠心病的一种严重类型。ACS是以冠状动脉粥样硬化斑块破裂或侵袭,继发完全或不完全闭塞性血栓形成为病理基础的一组临床综合征[2],经皮冠状动脉介入(percutaneous coronary intervention,PCI)是治疗ACS的重要方法,可最大程度恢复冠状动脉血液灌注。然而,仍有ACS患者在接受PCI术后出现主要不良心血管事件(major adverse cardiovascular events,MACE)[3]。尽管已经开发出不同的预测模型和评分来评估ACS患者MACE的风险并指导临床决策[4],但其在预测外部队列不良事件和改善预后方面的有效性尚未完全确定。因此,迫切需要找到有效的预测生物标志物来评估PCI术后MACE的风险,更好地为ACS患者进行风险分层,选择适当的治疗策略,改善疾病预后。
血尿素氮(blood urea nitrogen,BUN)是蛋白质的代谢产物,受肾小管重吸收的影响。肾小管的重吸收过程受肾素-血管紧张素-醛固酮活性、交感神经活性和精氨酸-血管加压素活性的调节[5]。目前临床上广泛将BUN作为肾功能的诊断标志物,高水平的血 BUN 可能反映了肾脏低灌注状态,而肾脏低灌注状态可能是由低血容量、肾血管疾病、心排血量减少、神经激素激活等原因引起[6]。血BNU检测方法简单、成本低、易测量。已有研究表明血清BUN水平与急性或慢性心力衰竭患者的死亡率密切相关[7]。尿素氮与急性心肌梗死患者的死亡率相关[8]。BNU可能是接受PCI治疗的ACS患者造影剂诱导肾病的预测因子[9]。BUN也可以作为反映心脏病学功能受损和神经激素激活的综合标志物[5]。然而,目前BUN对接受PCI治疗的ACS患者心血管事件预后的影响并未完全阐明。因此,本研究主要探讨血BUN水平对ACS患者PCI术后发生MACE的预测价值。
1 材料与方法
1.1 一般资料
纳入2017年4月至2017年11月在首都医科大学附属北京安贞医院心内科就诊并诊断为ACS且接受PCI手术患者共853例,对其中512例患者进行了随访。随访收集了患者的心血管危险因素、合并症、实验室检查、冠状动脉形态和出院用药数据。该研究的随访时间长达36个月,中位数为29.3个月,四分位距(interquartile range,IQR)为12.5~33.6个月。ACS包括ST段抬高型心肌梗死(ST elevated myocardial infarction,STEMI)、非ST段抬高型心肌梗死(non-ST elevation myocardial infarction,NSTEMI)、不稳定型心绞痛(unstable angina pectoris,UAP)和Ⅰ型心肌梗死[12]。本研究得到北京安贞医院伦理委员会批准并已在中国临床试验注册中心注册(No.ChiCTR-COC-17010792),研究遵守《赫尔辛基宣言》,所有患者均签署书面知情同意书。
主要纳入标准:1)受试者年满18 岁;2)受试者计划进行择期冠状动脉导管插入术;3)受试者正在接受PCI;4)受试者愿意并能够提供书面知情同意书。主要排除标准:1)进行PCI术时受试者的预期寿命少于 2 年;2)需要进行其他心脏或非心脏外科手术(例如:瓣膜置换术、颈动脉血运重建术等);3)心源性休克和/或需要机械/药物血流动力学支持;4)左心室射血分数低于30%;5)正在接受器官移植评估;6)已参与或计划参加其他临床试验;7)无法接受6个月双重抗血小板治疗;8)既往冠状动脉旁路移植术(coronary artery bypass grafting,CABG)或既往PCI;9)存在左主干病变需要血运重建;10)合并有其他肝脏疾病、肾功能不全、急性传染病、癌或正在怀孕。
研究的主要终点是随访期间的主要不良心血管事件。心血管事件为复合终点,定义为心源性死亡、心脏骤停、心肌梗死、心力衰竭和急性缺血性心脏病(包括稳定型心绞痛和不稳定型心绞痛)。
非吸烟者定义为参加研究前≥1年内从未吸烟或戒烟的患者。其余所有患者均被归类为吸烟者。饮酒者定义为每周≥3次达到每日酒精摄入量。降脂药包括他汀类药物、贝特类药物、胆酸螯合树脂类药物、烟酸及其衍生物药物、依折麦布;降糖药包括磺酰脲类、双胍类药物、α糖苷酶抑制剂药物、胰岛素增敏剂药物、促进胰岛素分泌药物、胰岛素;降压药包括利尿剂、钙通道阻滞剂、肾素-血管紧张素系统抑制剂、交感神经抑制药、血管扩张剂、复方制剂。患者出院后的所有随访信息均通过患者到门诊就诊或再次入院或通过与患者及其家属的电话访谈获得。结果数据由训练有素的研究人员输入,不良事件的发生由不参与程序的独立委员会裁决。
1.2 冠状动脉介入治疗
PCI术的治疗策略及支架选择均由术者决定。所有初次PCI术后患者至少接受24 h监测。根据《中国经皮冠状动脉介入治疗指南》给予患者PCI术后标准治疗药物,包括双重抗血小板药物、他汀类药物、血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体和β受体阻滞剂。
1.3 实验室参数检测
ACS患者在进行PCI术前经肘前静脉采集禁食状态下静脉血样进行血液常规实验室检查,检测指标包括空腹血糖(fasting blood glucose,FBG)、三酰甘油(triglyceride,TG)、总胆固醇(total chole-sterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、BUN、肌酐(creatinine,CR)、尿酸(uric acid,UA)和高敏C-反应蛋白(high sensitivity C-reactive protein,hs-CRP)浓度。所有生化参数均用北京安贞医院检验科的生化分析仪(Hitachi-7600)中测量,并进行质控。
人体测量和血液提取在1天内进行。参与者赤脚在校准的便携式电子称重秤和便携式非柔性身高测量杆测量身高和体质量。在坐姿休息 5 min后测量血压,在右上臂至少测定3次血压,并在分析中使用平均值。
1.4 统计学分析

2 结果
2.1 研究人群基线特征及组间比较
该研究前瞻性纳入512例符合条件的患者,其中25例失访,其余487例患者获得有关MACE的随访数据。根据研究人群血尿素氮水平三分位数将人群分为3组:低水平血尿素氮组T1(BUN<3.2 mmol/L)、中水平血尿素氮组T2(3.2≤BUN≤7.1 mmol/L)、高水平血尿素氮组T3(BUN>7.1 mmol/L)。研究基线临床特征如表1,总体平均年龄为(54.5±10.95)岁,男性占86.54%,低水平BUN组、中水平BUN组和高水平BUN组的年龄、性别、BMI、血压、血糖、血脂、是否使用药物等均无显著差异。

表1 研究对象一般资料及生化特征Table 1 Anthropometric and biochemical characteristics of the subjects included in the study
2.2 随访结果
在3年随访期间,114例患者(占研究人群的23.41%)至少发生过1次MACE,且高BUN水平组(35.21%)患者PCI术后MACE的发生率最高,其次是中BUN水平组(14.96%)和低BUN水平组(10.26%)。本研究按照ACS患者PCI术后有无临床终点事件MACE发生将研究人群分为MACE组和非MACE组。MACE组和非MACE组之间的临床、实验室和其他特征如表2所示。该研究发现,吸烟患者的MACE发生率显著高于无MACE患者(59.65%)。另外,与无MACE组患者相比,MACE组患者的HDL-C水平显著降低(P<0.01)、BUN水平显著增高(P<0.001),而其他临床指标均无明显差异。由此,将吸烟和HDL-C水平作为多因素模型校正分析的校正因素。
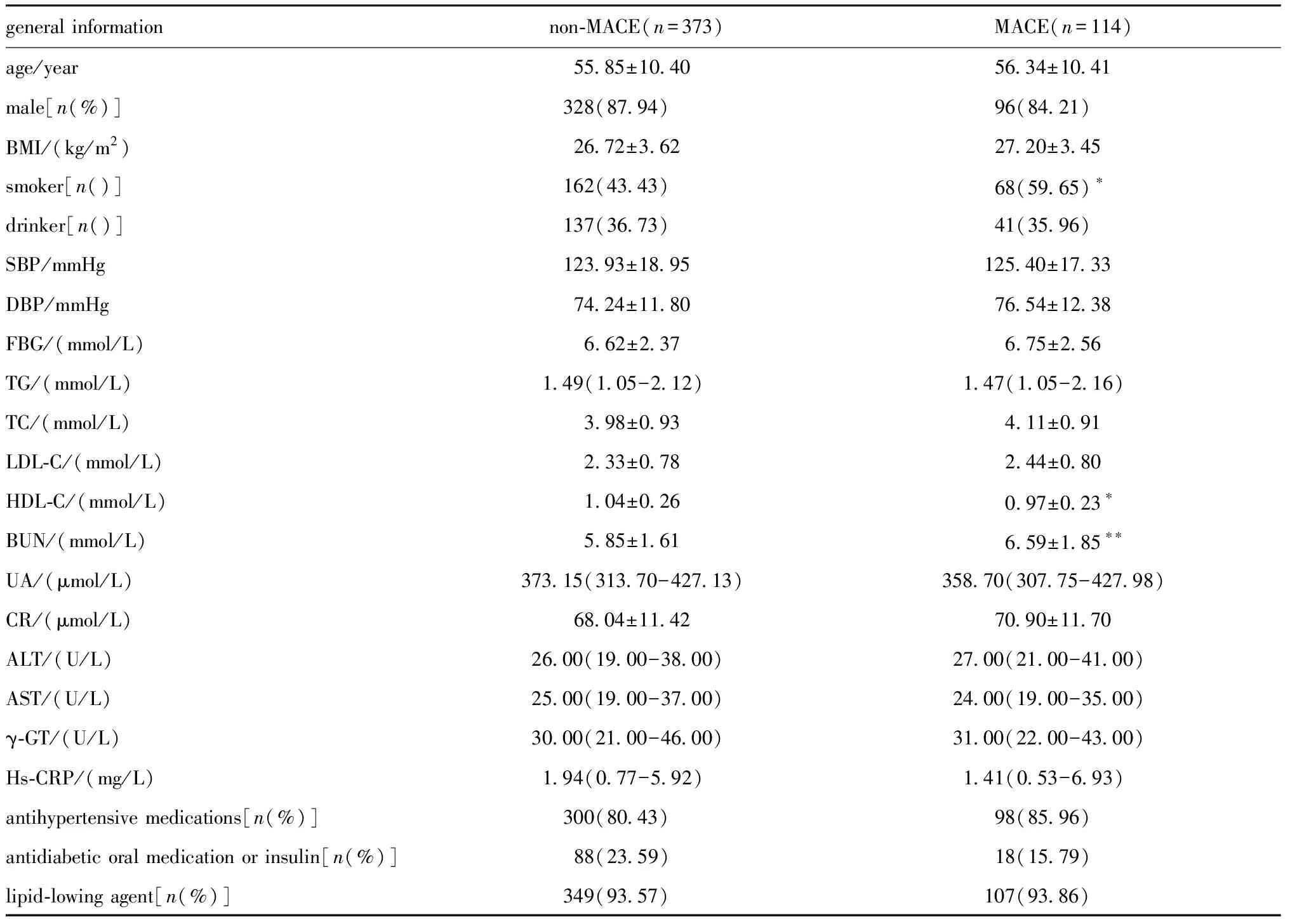
表2 MACE组和非MACE组中受试者的人体测量和生化特征Table 2 Anthropometric and biochemical characteristics of the subjects included in MACE and non-MACE
根据BUN水平三分位数,以低水平BUN组(T1)作为参考,使用Cox回归分析BUN水平对MACE发生率的影响。Schoenfeld residual检验结果显示BUN变量服从等比例风险假设(P>0.05),与低水平BUN组患者相比,高BUN水平的ACS患者PCI术后3年随访中发生MACE的风险比为4.936(P=0.002)。与此同时,将影响MACE的因素吸烟及HDL-C作为校正因素对模型进行调整后,高水平BUN仍存在预测能力(OR=4.722,P=0.003)(表3)。图1 Kaplan-Meier曲线显示,高水平BUN组在随访时未发生MACE的无事件生存率明显低于中等或低水平BUN患者。由此可见,基线血尿素氮水平与ACS患者PCI术后发生MACE事件风险相关,且不受其他心血管危险因素的影响。

图1 不同BUN水平的累计无MACE生存率Fig 1 Cumulative non-MACE survival at different BUN levels
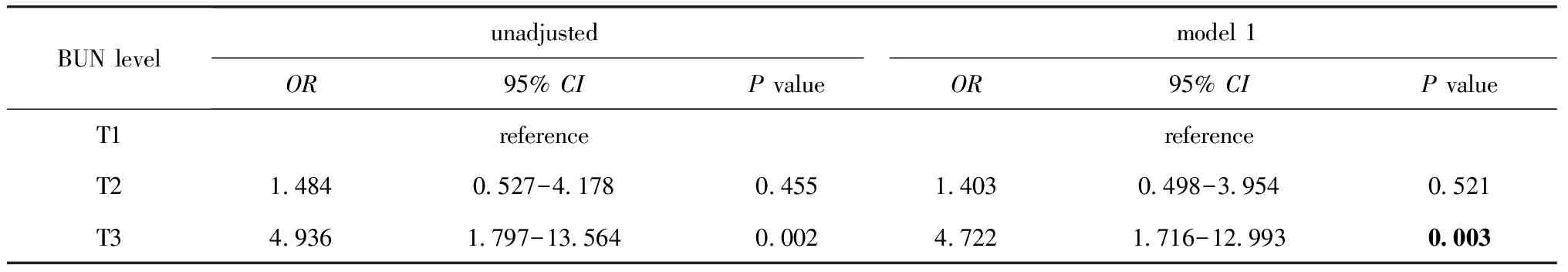
表3 Cox回归分析术前BUN水平对PCI术后MACE发生率的影响Table 3 Cox regression analyses of preprocedural BUN levels and MACE
研究进一步探究了BUN在MACE风险预测模型中的效用,使用Delong检验来检验AUC间差异。基本心血管风险预测模型(Default)包含患者年龄、性别、BMI、TC、TG、LDL、HDL、高血压状态、当前吸烟状态、2型糖尿病状态和冠状动脉粥样硬化性心脏病状态;欧洲心脏病学会(European Society of Cardiology)提出的SCORE算法模型(SCORE)包含年龄、性别、TC、SBP和当前吸烟状态。心血管风险预测模型ROC曲线的AUC增益显示(表4),将BUN额外纳入基本预测模型后,加入BUN的基本心血管风险预测模型的C统计量为0.742(95%CI0.687~0.797),高于不加BUN的基本心血管风险预测模型预测的结果(Delong检验P<0.001),表明AUC有显著增益。此外,加入BUN的SCORE模型C统计量为0.698(95%CI0.638~0.757),高于不加BUN的SCORE模型(Delong检验P<0.001),ROC曲线的AUC面积也得到显著改善。

表4 有和没有BUN的心血管风险预测模型ROC 曲线的AUC增益
3 讨论
本研究对487例接受PCI手术的ACS患者进行随访,研究表明高BUN水平与ACS患者PCI术后发生MACE的高风险之间存在显著关联。这种关联与其他心血管危险因素(包括Ⅱ型糖尿病和冠心病)无关。
BUN是一种易于检测的血清生物标志物,在临床中已被广泛用于与肌酐联合评估肾功能[10]。在急性冠状动脉事件中,肾功能不全与病死率增加之间的关系已得到充分证实[11],一项横断面研究表明,肾功能与冠状动脉疾病的范围和严重程度密切相关。已有研究证明,PCI术后MACE的发生率与肾功能呈正相关[12]。 除了作为肾功能不全的指标外,尿素氮还可以用作心血管疾病的预测指标。据报道,高尿素氮水平与肾素-血管紧张素-醛固酮和交感神经系统的激活之间存在关系,提示低血容量、肾血管疾病和心输出量减少导致的肾灌注不足以及肾小球滤过率降低[11]。另外,BUN是高血压发展的已知危险因素,可能通过激活肾素-血管紧张素系统导致肾血管收缩[13]。在流行病学研究中,BUN被用作心力衰竭和病死率的有力预测标志物[1]。因此,BUN可以作为心肾功能不全和神经体液激活的指标。 在本研究中,初次PCI术后的ACS患者MACE的总体发病率与既往研究报道的结果基本一致[14]。这一较高的MACE发病率推动着对生物标志物的不断深入探究,因此易于测量且可以提供超越传统危险因素预后信息的新生物标志物可为临床ACS患者治疗方式的选择提供了更多思路。
本研究中注意了偏倚的避免。首先,在对研究对象实验室参数检测中,使用盲法质控标本来测量BUN水平。此外,在统计分析中,对心血管事件危险因素的混杂效应进行了调整。另外,本研究中连续招募受试者,以减少选择偏倚。但本研究依旧存在一些局限性。首先,这是一项短期前瞻性研究,本研究结果应该在长期前瞻性研究中得到验证。其次,本研究结果应该在更多、更广泛人群中得到证实。此外,本研究参与者均为接受PCI治疗的患者,不能完全代表一般人群。
总之,在接受PCI治疗的ACS患者中,与低水平BUN组相比,高水平BUN组发生MACE显著增加。血BUN可独立于传统危险因素预测ACS患者PCI术后的MACE风险。将BUN纳入心血管事件风险的基本预测模型后,可以显著提高预测能力。
