芬兰型先天性肾病综合征1例并文献复习
2024-04-25张星林新宇王姣付晓伟张立明
张星,林新宇,王姣,付晓伟,张立明
患儿,女,1 d,因“生后气促15 min”于2022年9月8日入院。患儿系第1胎第1产,孕33+6周因“胎儿宫内窘迫”剖宫产娩出,出生体质量1.78 kg,羊水Ⅰ°污染,胎盘、脐带未见异常,1 min Apgar评分9分,母亲有桥本甲状腺炎病史,父亲体健,家族无肾脏病患者。入院查体:T 36.5℃,P 160次/min,R 60次/min,SpO290%。早产儿貌,反应差,呼吸促,面部浮肿;双肺呼吸音粗,闻及湿啰音,心音有力,律齐,未闻及杂音;腹平软,肝脾未触及肿大,腹水征阳性,肠鸣音存在;双下肢凹陷性水肿,肌张力差,原始反射未引出。实验室检查:尿常规示蛋白质(+++),红细胞(++),24 h尿蛋白 4.5 g;血液生化示血清总蛋白21.9 g/L,白蛋白13.7 g/L,球蛋白8.2 g/L,胆固醇正常;凝血常规示凝血酶原时间13.1 s,凝血酶时间18.0 s,活化部分凝血活酶时间35.8 s,D-二聚体1.75 μg/ml。甲状腺功能三项、血培养无明显异常;EB病毒衣壳抗原、Torch均阴性。肝胆胰脾肾以及心脏彩色超声未见明显异常。腹部B超:腹腔探及液性暗区约2.3 cm。胸腹X线片示双肺纹理模糊、肠胀气。初步诊断:先天性肾病综合征,后采集患儿及其父母静脉血,基因检测显示患儿存在NPHS1的3个杂合突变位点,分别为c.397+1G>T、c.2633del、c.2629A>T,其中c.2633del、c.2629A>T为国内首次报道。患儿父亲c.397+1G>T发生杂合突变,导致氨基酸发生剪接突变(splicing),母亲在该位点无变异(图1A)。母亲c.2633del杂合突变,导致氨基酸发生移码突变(p.Asn878ThrfsTer27)、2629号核苷酸由腺嘌呤A变为T(c.2629A>T)的杂合突变,导致第877号氨基酸由赖氨酸变为终止子(p.Lys877Ter),患儿父亲在该位点无变异(图1B、C)。根据美国医学遗传学与基因组学学会(ACMG)指南评估该3个突变位点均为可疑性致病性变异,导致基因功能丧失,结合患儿临床表型及基因检测结果,患儿为NPHS1基因杂合突变所致的芬兰型先天性肾病综合征(congenital nephrotic syndrome of the Finnish type,CNF)。入院后予反复输注白蛋白、丙种球蛋白及维持内环境稳态等支持治疗,定期复查尿常规、生化等相关检查,血液白蛋白持续下降且患儿全身水肿进行性加重,入院后10 d,家长放弃治疗出院,随访2个月患儿死亡。
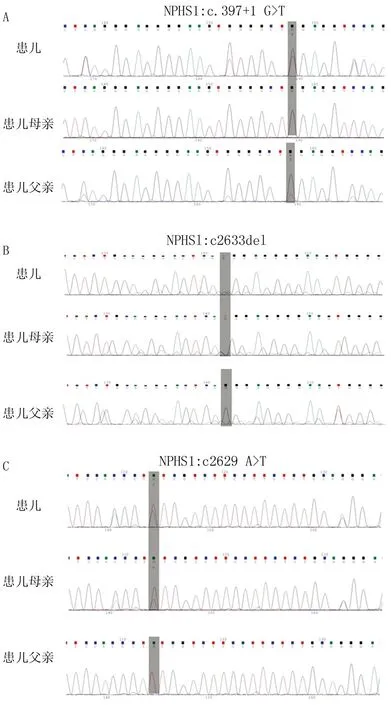
注:A.患儿及其父亲在c.397+1G>T发生杂合突变,患儿母亲不携带该突变;B.患儿及其母亲在c.2633del发生杂合突变,其父亲不携带该突变;C.患儿及其母亲在c.2629A>T发生杂合突变,其父亲不携带该突变。
讨 论先天性肾病综合征(congenital nephrotic syndrome,CNS)为新生儿罕见疾病之一,多发于西欧国家,主要是新生儿在出生3个月内出现的肾病综合征,临床症状包括大量蛋白尿、低白蛋白血症、高胆固醇血症以及严重水肿[1]。根据病因,CNS分为原发性(遗传性)和继发性(非遗传性)。继发性CNS多见于宫内感染,如巨细胞病毒、人类免疫缺陷病毒、风疹、弓形虫感染、汞中毒、婴儿系统性红斑狼疮、溶血尿毒症综合征以及其他先天异常(如Denys-Drash综合征、指甲—髌骨综合征等)[2]。而有研究表明,60%~80%的患者有遗传基础,主要因编码足突细胞肾滤过屏障的基因突变所致,NPHS1是引起CNS最常见的致病基因,由于在芬兰发病率极高,约1/8 000,因此,又称为芬兰型先天性肾病综合征(CNF)[3]。
CNF是一种罕见的常染色体隐性遗传病,1998年首次报道CNF与NPHS1基因突变有关[4]。Kestil等[5]发现NPHS1基因位于19号染色体长臂13.1位点上,编码由1 241个氨基酸组成的肾病蛋白nephrin,该蛋白是肾小球足细胞裂孔隔膜的核心组成部分,特异性表达于肾小球足细胞裂孔隔膜上,与足细胞足突间相互连接,形成拉链样的结构选择性屏障,只允许水分子及小的血浆分子通过,而防止免疫球蛋白等大分子滤过,对于肾小球滤过和足细胞稳定性方面有至关重要的作用。当NPHS1发生突变时,足细胞过滤屏障功能受损,导致尿液中出现大量蛋白质。目前发现的NPHS1基因突变类型已超过260种,且世界各地NPHS1突变谱仍在扩大,我国报道的NPHS1突变类型也越来越多[3],NPSH1的突变类型主要包括错义突变、剪切突变、无义突变、框移突变等,但并非所有的NPHS1基因变异都有很严重的临床表现[6]。目前认为错义突变为较轻的突变类型,而框移突变、剪切突变及零效突变被认为是较重的突变类型。根据ACMG指南评估该患儿的3个位点突变均属于严重的突变类型,在笔者后续的随访过程中,该患儿于生后2个月死亡。
CNF对于免疫抑制剂及激素治疗具有耐药性,肾移植是唯一有效的治疗方式。但移植前患儿的管理往往具有挑战性,要面临低白蛋白血症相关的液体过载、血液动力学不稳定、感染和血栓形成等并发症,还需要提供优质营养以达到足够的喂养体质量,经过单侧或双侧肾脏切除后,才能进行肾移植[7]。遗憾的是,本患儿由于严重的水肿、代谢紊乱而死亡,并未进行肾脏移植。
因此,目前对于该疾病仍然是预防重于治疗。随着分子遗传学技术的不断发展,基因检测已经成为遗传性肾病检查的重要手段,基因检测可以为基因突变危险的家庭提供遗传咨询,并为计划下一胎提供产前诊断。
