血清SIRT1、TGF-β1表达与退行性腰椎管狭窄症患者功能障碍指数及疼痛评分的相关性分析
2024-04-25冯海涛田有勇赵敦郭程亮
冯海涛,田有勇,赵敦,郭程亮
退行性腰椎管狭窄症(degenerative lumbar spinal stenosis,DLSS)是一种退化性疾病,其发病率随着年龄的增长而逐渐增加,严重影响患者日常生活[1]。DLSS的发病与炎性反应以及血液循环障碍相关,病理改变引发椎管容积下降,出现慢性进行性变化[2-3]。研究发现,DLSS患者神经根性疼痛的原因与炎性因子有关,在疾病发展中具有重要作用[4]。沉默信息调节因子(SIRT1)广泛表达于机体组织中,现已明确其能够降低炎性反应,参与多种疾病的发展[5-6]。转化生长因子β1蛋白(TGF-β1)广泛存在于哺乳动物淋巴细胞中,受到炎性细胞因子调节,包括白介素-6(IL-6)、肿瘤坏死因子α(TNF-α)等[7]。现阶段,鲜少有关于血清SIRT1、TGF-β1水平与DLSS病情的关系研究,本研究对DLSS患者血清SIRT1、TGF-β1水平进行检测,并分析其水平与患者功能障碍指数与疼痛评分的相关性,旨在为患者的临床治疗提供参考,报道如下。
1 资料与方法
1.1 临床资料 选取2020年10月—2023年10月山西省汾阳医院创伤与脊柱科收治的DLSS患者86例作为DLSS组,依据Oswestry腰痛功能障碍指数(ODI指数)[8]分为轻中度功能障碍亚组(ODI指数≤24,n=50)及重度功能障碍亚组(ODI指数>24,n=36);选择同期医院体检的健康者85例作为健康对照组。本研究已经获得医院伦理委员会批准(20208160521),受试者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①符合《腰椎管狭窄症手术治疗规范中国专家共识》中相关诊断标准[9],经磁共振成像(MR)、X线及CT确诊为DLSS的患者;②患者年龄≥50岁。(2)排除标准:①意识不清晰或伴随精神疾病;②合并恶性肿瘤;③1个月内服用过止痛消炎药物;④感染性疾病;⑤伴随代谢性骨病;⑥伴随肝肾功能不全或凝血功能障碍;⑦存在腰椎手术史;⑧脊椎畸形或先天肌无力。
1.3 观测指标与方法
1.3.1 临床资料收集:包括性别、年龄、体质量指数(BMI)、疾病史(糖尿病、冠心病、高血压)、吸烟史及饮酒史等。
1.3.2 多裂肌形态检测:指导患者取仰卧位,使用MR扫描仪(Ingenia3.0,Philips Healthcare公司)从T12至骶骨进行矢状位T2加权扫描,测量(使用图像处理软件)受检者的总无脂肪多裂肌横截面积(TFCSA)、总多裂肌横截面积(TCSA),并计算TFCSA/TCSA比值。
1.3.3 血清SIRT1、TGF-β1、皮质醇、ACTH水平检测:患者入院后次日清晨、健康对照组于体检当日抽取空腹肘静脉血4 ml,室温下离心留取血清置于超低温冰箱保存待用。使用ELISA试剂盒检测血清SIRT1、TGF-β1(货号:ab156065、ab100647,上海艾博抗贸易有限公司)、皮质醇、促肾上腺皮质激素(ACTH)水平(货号:D711340-0096,T510005-0001,生工生物工程股份有限公司),所有操作均按照试剂盒说明书严格进行。
1.3.4 腰部功能障碍检测:采用ODI指数[8]评估受检者的腰部功能障碍,包括疼痛程度、承受重物能力、生活自理能力、站立、坐、走路、性生活、睡眠质量、旅行以及社交生活方面进行评分,共计50分,将累计积分与总分的比值记为ODI值,ODI值越高则功能障碍损伤越严重。
1.3.5 疼痛评分:采用视觉模拟疼痛评分(VAS)[10]评估受检者疼痛情况,取游动标尺(约10 cm),两端分别为“10分”及“0分”,无痛为0分,剧烈疼痛为10分。

2 结 果
2.1 2组临床资料及腰部多裂肌形态差异比较 2组在性别、年龄、BMI、TCSA、疾病史(糖尿病、冠心病、高血压)、吸烟史、饮酒史方面比较,差异无统计学意义(P>0.05),DLSS组患者TFCSA及TFCSA/TCSA水平低于健康对照组(P<0.01),见表1。
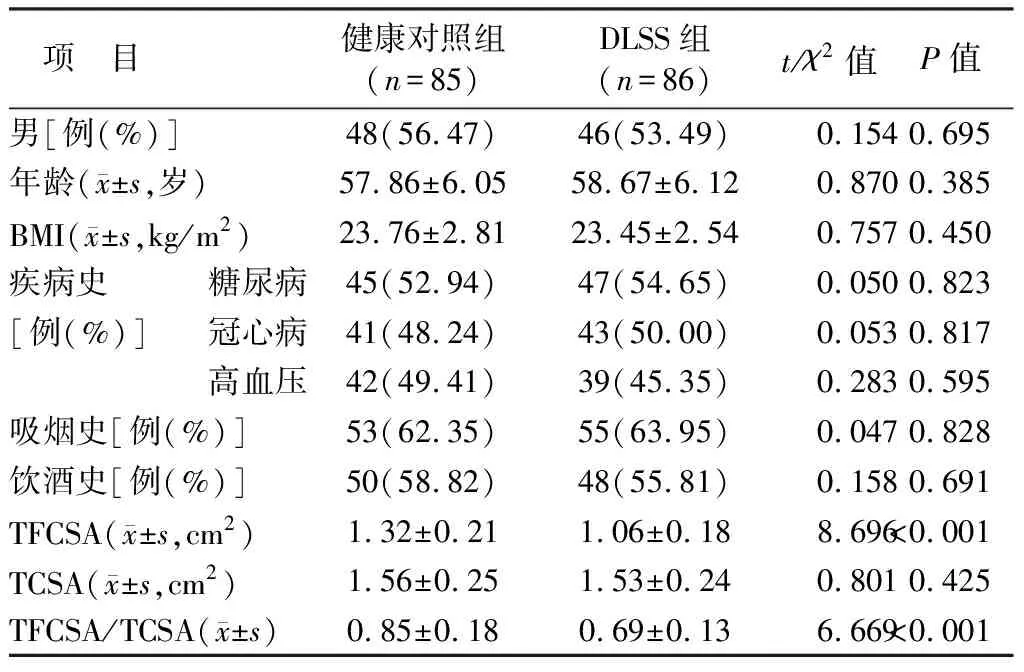
表1 健康对照组与DLSS组临床资料及腰部多裂肌形态差异比较
2.2 2组血清SIRT1、TGF-β1、应激指标水平、ODI指数及VAS评分比较 DLSS组血清SIRT1、TGF-β1水平低于健康对照组(P<0.01),皮质醇、ACTH、ODI指数、VAS评分均高于健康对照组(P<0.01),见表2。

表2 健康对照组与DLSS组血清SIRT1、TGF-β1、应激指标水平、ODI指数及VAS评分比较
2.3 不同功能障碍患者腰部多裂肌形态差异及血清SIRT1、TGF-β1水平、应激指标比较 轻中度功能障碍亚组血清SIRT1、TGF-β1、TFCSA、TFCSA/TCSA水平高于重度功能障碍亚组(P<0.05),皮质醇、ACTH、ODI指数、VAS评分均低于重度功能障碍亚组(P<0.05),见表3。

表3 不同功能障碍DLSS患者腰部多裂肌形态差异及血清SIRT1、TGF-β1水平、应激指标比较
2.4 血清SIRT1、TGF-β1水平与ODI指数及VAS评分的相关性 Spearman法相关性分析显示,血清SIRT1、TGF-β1水平与ODI指数及VAS评分均呈负相关(P<0.01),见表4。

表4 DLSS患者血清SIRT1、TGF-β1水平与ODI指数及VAS评分的相关性
2.5 多因素Logistic回归分析DLSS发生的影响因素 以是否发生DLSS为因变量,将表1、2中有显著差异的因子作为自变量进行多因素Logistic回归分析,结果显示:血清SIRT1高、TGF-β1高水平是DLSS发生的保护因素,皮质醇高、ACTH高、ODI指数高、VAS评分高是DLSS发生的危险因素(P<0.05),见表5。
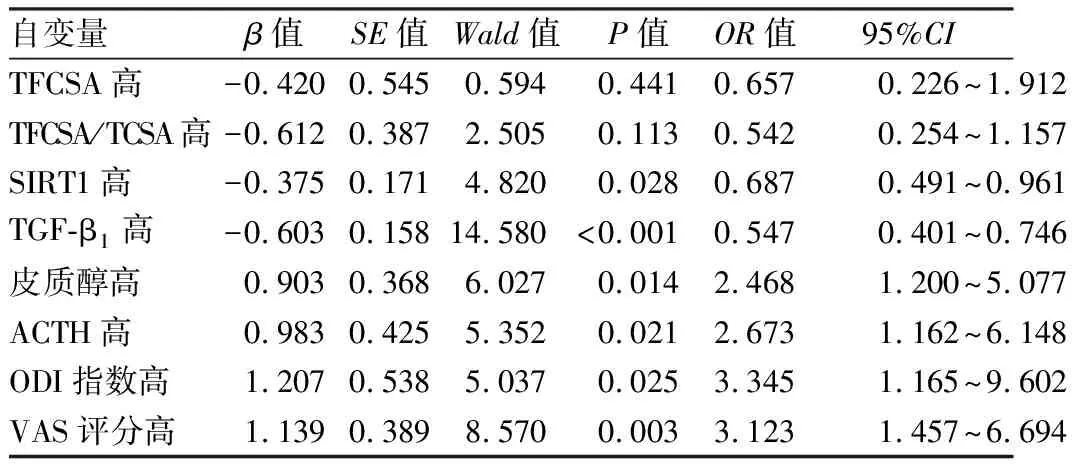
表5 多因素Logistic回归分析DLSS发生的影响因素
3 讨 论
DLSS是骨科疾病,常见于中老年人群,患者临床表现包括腰腿麻木以及间歇性跛行[11]。DLSS的发病机制包括骨赘过度生长、小关节肥大、椎间盘退变等,出现活动力降低、肌力变弱以及机体疼痛等症状,患者神经根受压处发生缺氧、水肿,椎管内血流不畅,炎性因子以及炎性介质在发病部位大量堆积,改变患者椎管内环境,大量释放炎性因子,引发患者腰椎功能障碍[12-13]。现阶段,DLSS的发病机制以及病因尚不完全清晰,多数患者的临床症状能够通过药物抑制炎性反应得到缓解,炎性因子在DLSS患者发生腰腿疼痛过程中十分重要[14]。
SIRT1是一种炎性抑制因子,能够减轻炎性因子引发的损伤,此外还能够抑制炎性因子的分泌[15]。相关研究显示,腰痛患者血清中SIRT1水平下降,与ODI指数以及VAS评分呈负相关[16]。本研究同样发现DLSS患者血清SIRT1水平下调,推测DLSS发生后引发患者体内炎性反应,炎性因子在患者发病部位逐渐积累,SIRT1水平较低时无法扭转炎性因子造成的伤害,血清SIRT1可能参与了DLSS的发病过程。
TGF-β1是调节因子,能够调节免疫反应,诱导细胞凋亡,在疾病发展中十分重要[17]。研究显示,膝骨关节炎患者血清TGF-β1水平降低,与患者的病情程度密切相关[18]。本研究中DLSS患者血清TGF-β1水平低于健康对照组,现阶段已明确DLSS的发生与炎性反应相关,TGF-β1的水平受炎性细胞因子调节,推测DLSS发生引发患者体内炎性反应,进一步影响炎性细胞因子释放TGF-β1,TGF-β1参与DLSS的具体机制目前尚不清晰,需要进一步探索。
ODI指数能够评估患者腰部功能障碍,而VAS评分能够反映患者的疼痛情况[19-20],相关性分析显示血清SIRT1、TGF-β1水平与ODI指数及VAS评分呈负相关,进一步证实血清SIRT1、TGF-β1可能参与了DLSS的发病过程,临床评估患者病情时可辅助参考患者血清SIRT1、TGF-β1水平,增加诊断的准确性。进一步数据分析发现,DLSS发生的影响因素包括血清SIRT1、TGF-β1水平、皮质醇、ACTH、ODI指数以及VAS评分。皮质醇为活性生物激素,在蛋白质降解、病毒激活以及降低免疫力发挥重要作用,能够改变体内环境[13]。本研究中皮质醇水平升高,其可能是通过炎性反应参与DLSS的发病过程。ACTH是多肽类激素,患者感染后发生炎性反应,ACTH被大量释放[21]。本研究中ACTH水平升高可能是DLSS发病过程中发生炎性反应,患者体内释放大量ACTH,后续将扩大样本量,进一步对试验结果进行验证。
综上所述,DLSS患者血清SIRT1、TGF-β1水平降低,与ODI指数及VAS评分呈负相关,是DLSS发生的影响因素。本研究仅对86例DLSS患者进行分析,样本量不够多且未对患者进行炎性因子水平的检测,后期将纳入更多患者对试验结果进行验证以及进一步分析,以期能为DLSS患者的临床治疗提供帮助。
利益冲突:所有作者声明无利益冲突
作者贡献声明
冯海涛:设计研究方案,实施研究过程,论文撰写;田有勇:提出研究思路,分析试验数据;赵敦:实施研究过程,资料搜集整理,进行统计学分析;郭程亮:论文审核,论文修改
