PRMT5和CDKN2B在宫颈癌组织的表达及临床意义
2024-04-25胡晓菡周强孙武陈静沈瀚李强
胡晓菡,周强,孙武,陈静,沈瀚,李强
宫颈癌是女性生殖道常见恶性肿瘤,每年新发60.4万例[1]。宫颈癌治疗以手术、放化疗为主,但仍有部分患者出现肿瘤术后复发和转移[2]。蛋白精氨酸甲基转移酶5(protein arginine methyltransferase 5,PRMT5)是蛋白精氨酸甲基转移酶成员,调控DNA修复、mRNA剪接和信号传导等生物学过程[3]。研究表明,PRMT5在胃癌、乳腺癌等许多恶性肿瘤中过表达[4-5],能够转录激活AKT等癌基因的表达,促进癌细胞增殖、侵袭和迁移。细胞周期蛋白依赖性激酶抑制剂2B(cyclin dependent kinase inhibitor 2B,CDKN2B)属于CDKN2B/p20家族,能够结合并抑制细胞周期素依赖激酶4/6的活性,负调控细胞周期素D1,抑制细胞增殖,在胃癌、甲状腺癌等多种人类恶性肿瘤中发挥肿瘤抑制的作用[6-7]。宫颈癌中PRMT5、CDKN2B的表达及临床意义尚不明确。本研究分析宫颈癌中PRMT5、CDKN2B表达与临床病理特征及预后的关系,探讨两者的临床意义,报道如下。
1 资料与方法
1.1 临床资料 收集2019年3月—2020年3月南京大学医学院附属鼓楼医院妇产科诊治宫颈癌患者88例,年龄29~79(58.67±8.36)岁,病程3~21(8.12±2.37)d;基础病:高血压20例,糖尿病7例,高血脂12例;病理类型:宫颈鳞癌55例,宫颈腺癌33例;参照国际妇产科联盟分期标准(International Federation of Gynecology and Obstetrics,FIGO分期)进行宫颈癌临床分期[8],ⅠA~ⅠB1期61例,ⅠB2~ⅡA期27例;肿瘤大小:<4 cm者62例,≥4 cm者26例;肿瘤浸润深度:<1/2全层者60例,≥1/2全层者28例;肿瘤分化程度:低分化30例,高中分化58例;有淋巴结转移者24例,无淋巴结转移者64例。本研究已经获得医院伦理委员会批准(M20220119),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①均接受根治性手术治疗,术后病理证实为宫颈癌;②病例资料完整;③原发性肿瘤且为首次诊治。(2)排除标准:①术前有新辅助放化疗;②未能达到根治性手术标准;③伴其他恶性肿瘤;④不能配合随访。
1.3 检测指标与方法
1.3.1 PRMT5、CDKN2B检测:取宫颈癌及癌旁组织(距肿瘤边缘>2 cm),10%中性甲醛固定12 h,常规石蜡包埋切片,60℃烤片1 h,二甲苯透明化,梯度酒精脱水,柠檬酸盐抗原热修复,100 ℃ 10 min,3%过氧化氢阻断内源性过氧化物酶,3%羊血清封闭,PRMT5、CDKN2B抗体4℃孵育过夜(兔单克隆PRMT5、CDKN2B抗体购自美国Abcam公司,货号ab151321,ab81278,稀释比均为1∶200),二抗室温孵育1 h,DAB显色4 min,苏木素复染,梯度酒精脱水,中性树脂封片,显微镜下(DX31,日本奥林巴斯公司)观察。染色面积评分:阳性面积≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。染色强度评分:无阳性染色(0分),淡黄色(1分),棕黄色(2分)。免疫组化评分为染色面积评分乘以染色强度评分,0~2分为阴性,>2分为阳性。
1.3.2 随访:所有患者自治疗结束后以电话及门诊复查方式进行随访。随访时间:治疗结束后2年内3~6个月随访1次,第3年每6~12个月随访1次。复查内容根据患者实际情况选择腹盆腔CT或MR等影像学检查和血常规、肝肾功能等实验室检查。记录患者随访期内肿瘤复发转移情况,患者生存情况等。随访截止时间为2023年4月1日。无进展生存时间定义为自宫颈癌确诊到术后肿瘤复发、转移及患者肿瘤相关死亡的时间。随访终点为患者出现肿瘤进展或随访时间结束。
1.4 统计学方法 采用SPSS 26.0软件统计分析数据。计数资料以频数或率(%)表示,组间比较采用卡方检验。Spearman秩相关分析宫颈癌组织中PRMT5与CDKN2B表达的相关性。绘制Kaplan-Meier生存曲线,生存曲线比较采用Log-Rank法。多因素Cox比例风险回归模型分析影响宫颈癌无进展生存预后的因素。P<0.05为差异具有统计学意义。
2 结 果
2.1 PRMT5、CDKN2B在宫颈癌及癌旁组织表达的比较 PRMT5棕黄色阳性染色位于细胞浆和细胞膜,CDKN2B棕黄色阳性染色位于细胞核,见图1。癌组织中PRMT5阳性率70.45%(62/88),高于癌旁组织6.82%(6/88)(χ2=75.155,P<0.001)。癌组织中CDKN2B阳性率22.73%(20/88),低于癌旁组织79.55%(71/88)(χ2=75.336,P<0.001)。相关性分析发现,宫颈癌中PRMT5与CDKN2B表达呈显著负相关(r=-0.734,P<0.001)。

图1 宫颈癌及癌旁组织中PRMT5及CDKN2B蛋白表达(免疫组化染色,×200)Fig.1 Expression of PRMT5 and CDKN2B in cervical cancer and paracancer tissues (immunohistochemical staining, ×200)
2.2 PRMT5、CDKN2B表达在不同临床病理特征中差异比较 FIGO分期ⅠB2~ⅡA期、有淋巴结转移宫颈癌患者癌组织中PRMT5阳性率分别高于FIGO分期ⅠB2~ⅡA期、无淋巴结转移患者(P均<0.05)。FIGO分期ⅠB2~ⅡA期、有淋巴结转移宫颈癌患者癌组织中CDKN2B阳性率分别低于FIGO分期ⅠB2~ⅡA期、无淋巴结转移患者(P均<0.05),见表1。
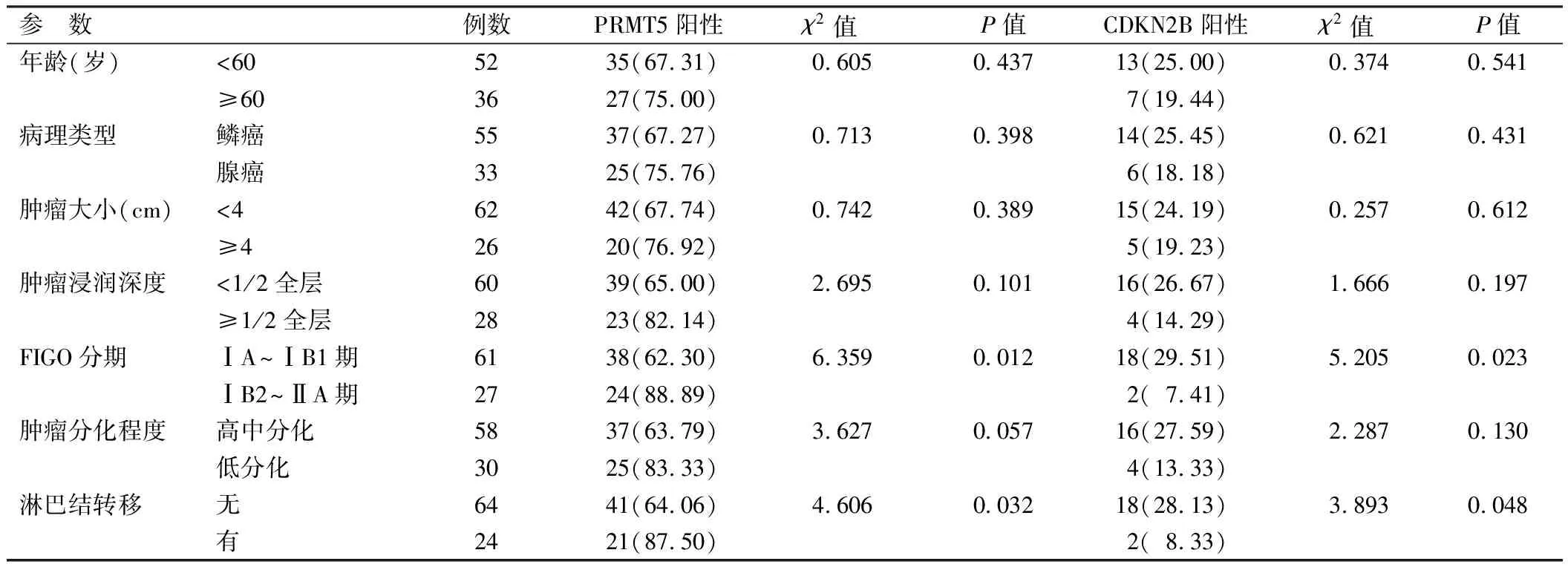
表1 不同临床病理特征患者PRMT5、CDKN2B表达比较 [例(%)]
2.3 宫颈癌中PRMT5、CDKN2B表达与预后的关系 88例宫颈癌患者随访中,出现肿瘤进展18例,3年无进展生存率为79.55%(70/88)。PRMT5阳性和阴性组3年无进展生存率分别为74.19%(46/62)和92.31%(24/26),PRMT5阳性组3年累积无进展生存率低于PRMT5阴性组(Log-Rankχ2=4.386,P=0.017)。CDKN2B阳性及阴性组3年无进展生存率分别为95.00%(19/20)和75.00%(51/68),CDKN2B阴性组3年累积无进展生存率低于CDKN2B阳性组(Log-Rankχ2=4.423,P=0.012),见图2。
2.4 多因素Cox回归分析宫颈癌无进展生存预后影响因素 以是否发生肿瘤进展为因变量(0=无,1=有),以上述结果中P<0.05项目为自变量进行多因素Logistic回归分析,结果显示:FIGO分期ⅠB2~ⅡA期、合并淋巴结转移、PRMT5阳性、CDKN2B阴性是影响宫颈癌患者无进展生存预后的独立危险因素,见表2。

表2 多因素Cox回归分析宫颈癌预后影响因素
3 讨 论
宫颈癌是我国女性常见的恶性生殖系统肿瘤,每年新发病例达10.9万例,约占全球新发病例数的1/6[9]。近年来随着宫颈癌早期筛查的普及,宫颈癌的发病人数逐渐增多。宫颈癌的治疗包括根治性子宫切除术加盆腔淋巴结清扫,但术后仍有20%~30%的患者3年内出现肿瘤复发转移,且出现肿瘤复发转移后治疗手段有限,患者预后较差[10]。研究宫颈癌的疾病机制,寻找能够评估患者临床预后的肿瘤标志物,对于术后高危进展患者的术后辅助治疗方式的选择具有重要意义。
PRMT5属于蛋白质精氨酸甲基化转移酶家族的9个成员之一,通过甲基化蛋白精氨酸残基,调控如RNA剪接、细胞周期、细胞死亡和代谢信号等通路。研究表明,子宫内膜癌中PRMT5能与雌激素受体α及类固醇受体共激活因子-1相互作用,促进细胞周期蛋白D1、c-Myc的蛋白表达,增强癌细胞的增殖和迁移能力,并抑制其凋亡[11]。本研究中,宫颈癌组织PRMT5表达升高,与既往学者在宫颈癌组织芯片中报道的结果一致[12],但该研究选取的患者以高分期和高分级的患者为主,研究群体的代表性存在一定的局限。宫颈癌中PRMT5的表达上调与转录调控失常有关。研究发现,宫颈癌中转录因子Snail能够结合PRMT5基因上调PRMT5的表达,进而形成MTA1转录抑制复合物,催化组蛋白二甲基化和脱乙酰化,抑制E-钙黏蛋白的表达,促进肿瘤上皮—间充质转化,导致肿瘤侵袭和转移[12]。另外,PRMT5表达与不良临床病理特征有关,提示PRMT5促进宫颈癌的肿瘤进展。研究表明,PRMT5通过组蛋白H3R2的对称二甲基化,增强信号转录因子与转录活化因子1的转录,促进宫颈癌细胞中程序性死亡因子配体1的表达,抑制T细胞中干扰素-γ、肿瘤坏死因子-α和颗粒酶B的分泌,促进肿瘤免疫逃逸及肿瘤恶性进展[13]。亦有研究报道,PRMT5还能抑制E3泛素连接酶含F-box/WD重复序列的蛋白7的表达,增加c-Myc蛋白的稳定性,促进胰腺癌的无氧糖酵解,导致肿瘤的过度增殖[14]。本研究中,PRMT5阳性宫颈癌患者无进展生存预后较差,表明PRMT5是新的评估宫颈癌患者无进展生存预后的肿瘤标志物。笔者分析,PRMT5阳性的宫颈癌患者肿瘤往往合并淋巴结转移、较高的FIGO分期等高危复发进展的因素,导致术后治疗进展风险增加。另外,PRMT5还能促进肿瘤耐药性形成,降低术后辅助治疗疗效,导致患者不良预后。Mueller等[15]研究表明,PRMT5的表达能够促进微管调节蛋白2的表达,导致肺癌肿瘤细胞对紫杉醇等化疗药物的获得性耐药性的形成[13]。
CDKN2B又称为INK4B,该基因编码蛋白作为细胞周期依赖激酶抑制剂,能与细胞周期蛋白依赖激酶4或6结合形成复合物,抑制细胞周期依赖激酶的激活,在控制细胞周期G1期进展中发挥作用。研究发现,甲状腺癌中CDKN2B表达缺失,导致细胞周期依赖性蛋白丝/苏氨酸激酶的激活,促进肿瘤细胞的过度增殖[16]。本研究中,宫颈癌组织CDKN2B表达下调,这与既往学者利用甲基化特异PCR在宫颈癌组织中发现CKDN2B基因的高甲基化沉默的研究结果一致[17],但该研究样本量较小,仅纳入20例宫颈癌患者,结果可能存在偏倚。宫颈癌中CDKN2B的表达与表观遗传学修饰有关。研究表明,CDKN2B基因的异常甲基化导致CDKN2B表达缺失,增加宫颈癌、卵巢癌等恶性肿瘤发生的易感性[17-18]。本研究发现,宫颈癌中CDKN2B表达与FIGO分期、淋巴结转移有关,表明CKDN2B促进宫颈癌的恶性进展。Xu等[19]报道,胃癌中E2F转录因子1的表达能够通过诱导组织分化诱导非蛋白质编码RNA的转录,促进其与STAU1蛋白的结合,降低CDKN2B mRNA的稳定性,抑制CDKN2B的蛋白表达,导致肿瘤细胞过度增殖。本研究中,CDKN2B阴性的宫颈癌患者无进展生存预后较差,提示CDKN2B是新的评估患者预后的肿瘤标志物。笔者分析,CDKN2B阴性的宫颈癌肿瘤增殖能力强,FIGO分期较高,肿瘤容易出现淋巴结转移,术后复发转移风险较高。另外,CDKN2B阴性的宫颈癌对化疗及靶向治疗存在耐药性,降低术后辅助治疗的有效性,导致肿瘤复发和转移。研究表明,人白血病细胞KG1a中miR-4755-5p通过靶向抑制CDKN2B基因的表达,增强癌细胞对地西他滨等化疗药物治疗的耐药性[20]。另外,有研究报道,在吉非替尼获得性耐药的肺癌患者中CDKN2B表达存在明显的缺失型突变,检测CDKN2B基因表达情况有助于评估靶向药物治疗敏感性[21]。因此,宫颈癌中CDKN2B的表达下调促进肿瘤的发生发展,是新的评估宫颈癌患者预后的肿瘤标志物。本研究中,宫颈癌组织PRMT5与CDKN2B表达呈负相关,提示两者在宫颈癌中存在相互作用的关系。分析其原因,PRMT5的表达上调能够与果蝇Zeste基因增强子2相互作用,促进组蛋白H4R3me2和H3R8me2表达,增加CDKN2B基因的启动子区CpG的甲基化水平,沉默CDKN2B的表达,诱导肿瘤细胞过度增殖[22-24]。
综上所述,宫颈癌中PRMT5表达升高,CDKN2B表达降低,均与FIGO分期、淋巴结转移相关。FIGO分期ⅠB2~ⅡA期、合并淋巴结转移、PRMT5阳性、CDKN2B阴性是影响宫颈癌患者无进展生存预后的独立危险因素。临床医师可根据癌组织中PRMT5、CDKN2B表达,同时结合传统的FIGO分期及淋巴结转移等临床病理特征,对宫颈癌患者的预后进行评估,对于高危复发进展的患者积极诊治和随访,以改善临床预后。本研究也存在局限性,样本量较小,随访时间较短,有待今后设计多中心大样本前瞻性的临床试验进一步研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
胡晓菡:设计研究方案,实施研究过程,论文撰写;周强:提出研究思路,分析试验数据,论文审核;孙武:实施研究过程,资料搜集整理;陈静:实施研究过程,资料搜集整理;沈瀚:进行统计学分析;李强:论文修改
