SIRT5、CRIP1在肝细胞肝癌组织中的表达及临床意义
2024-04-25韩璐纪爱芳魏子白栗彦琪王彪
韩璐,纪爱芳,魏子白,栗彦琪,王彪
肝癌是全球发病率和病死率较高的恶性肿瘤之一[1]。据报道2022年中国肝癌发病和死亡例数分别为431 383例、412 216例[2]。肝细胞肝癌(hepatocellular carcinoma,HCC)是肝癌最常见的病理学类型(75%~85%),恶性程度高,长期预后较差[3]。沉默调节蛋白5(sirtiun 5,SIRT5)是一种去乙酰化酶,能通过乙酰化修饰作用参与肿瘤发生发展[4]。实验报道,SIRT5在肝癌细胞中低表达[5]。富含半胱氨酸肠蛋白1(cysteine rich protein 1,CRIP1)是一种LIM/双锌指蛋白,能通过抑制免疫和激活信号通路参与肿瘤发生发展[6]。实验报道,CRIP1在肝癌细胞中高表达[7]。相关研究指出,SIRT5异常表达与结直肠癌、分化型甲状腺癌等肿瘤患者预后不良有关[8-9];CRIP1异常表达与卵巢癌、急性髓细胞性白血病等肿瘤患者预后不良有关[10-11]。但关于SIRT5、CRIP1在肝细胞肝癌组织中的表达及临床意义尚不明确,基于此本研究报道如下。
1 资料与方法
1.1 临床资料 选取2018年1月—2020年5月长治医学院附属和平医院肝胆外科手术切除HCC患者150例,其中男91例,女59例,年龄27~75(60.00±5.75)岁,≥60岁79例,<60岁71例;乙型肝炎病毒(hepatitis B virus,HBV)/(hepatitis C virus,HCV)阳性128例,HBV/HCV阴性22例;肿瘤位置:左叶63例,右叶74例,跨叶13例;甲胎蛋白(alpha-fetoprotein,AFP)79.26~857.68(507.20±148.15)μg/L,≥400 μg/L 129例,<400 μg/L 21例;肿瘤数目:单发67例,多发83例;肿瘤直径1.15~7.98(4.63±1.99)cm,≥5 cm 66例,<5 cm 84例;分化程度:低分化38例,中高分化112例;有脉管侵犯72例;TNM分期[12]:Ⅰ期37例,Ⅱ期61例,Ⅲ期52例。本研究已经获得医院伦理委员会批准(2018005),患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①年龄≥18岁;②初次确诊为HCC(经病理诊断);③接受根治性或姑息性切除;④TNM分期Ⅰ~Ⅲ期。(2)排除标准:①入院前已接受任何抗肿瘤治疗;②拒绝随访;③合并其他部位恶性肿瘤;④不能耐受手术;⑤严重肝肾功能障碍;⑥合并严重感染;⑦肝移植患者;⑧合并自身免疫性疾病;⑨资料不完整。
1.3 观测指标与方法
1.3.1 免疫组化检测肝组织SIRT5、CRIP1表达:术中收集部分癌组织及对应癌旁组织(距离癌组织>2 cm)福尔马林固定,取部分福尔马林固定组织,常规石蜡包埋、切片、脱蜡、水化后,pH 6.0柠檬酸钠缓冲液进行高压热修复5 min,室温自然冷却。切片放置于3%H2O2避光15 min,磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤3次(5 min/次)阻断非特异性反应。再将一抗[兔抗人SIRT5(1∶100)、CRIP1(1∶100),武汉三鹰生物技术有限公司,编号 67257-1-IG、15349-1-AP]滴加到切片中,4℃下过夜。次日滴加辣根过氧化物酶标记的二抗,PBS洗涤3次(5 min/次),二氨基联苯胺显色,苏木精反染,乙醇梯度脱水,中性树胶封片。显微镜下观察拍照,以PBS(代替一抗)作为阴性对照,以已知阳性切片作为阳性对照进行免疫组化评分(染色强度×阳性细胞比例),以≥3分为阳性表达。染色强度:无染色、黄色、浅褐色、深棕色分别为0分、1分、2分、3分;阳性细胞:0、<5%、5%~<30%、30%~<50%、≥50%分别为0分、1分、2分、3分、4分[8]。根据HCC组织中SIRT5、CRIP1表达将HCC患者分为SIRT5、CRIP1阳性/阴性表达组。
1.3.2 随访:HCC患者术后通过电话、门诊、互联网等方式随访3年,截止日期为2023年5月31日或失访/死亡,统计SIRT5、CRIP1阳性/阴性表达HCC患者3年总生存率。

2 结 果
2.1 SIRT5、CRIP1在HCC组织及癌旁组织中表达比较 HCC组织SIRT5阳性表达率低于癌旁组织,CRIP1阳性表达率高于癌旁组织(P<0.01),见表1。
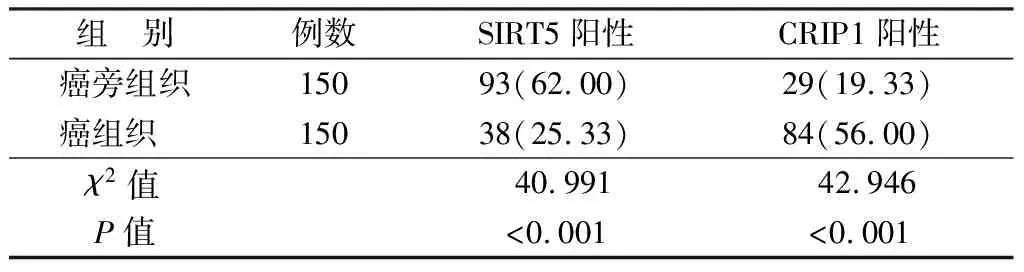
表1 SIRT5、CRIP1在HCC组织及癌旁组织中表达比较 [例(%)]
2.2 SIRT5、CRIP1阳性表达在HCC患者不同临床/病理特征中比较 肿瘤单发、肿瘤直径小、中高分化程度、无脉管侵犯、TNM分期Ⅰ~Ⅱ期的HCC组织较肿瘤多发、肿瘤直径大、低分化、有脉管侵犯、TNM分期Ⅲ期SIRT5阳性表达率升高、CRIP1阳性表达率降低,差异均有统计学意义(P<0.05),不同性别、年龄、HBV/HCV、肿瘤位置、AFP的HCC组织SIRT5、CRIP1阳性表达率比较差异无统计学意义(P>0.05),见表2。
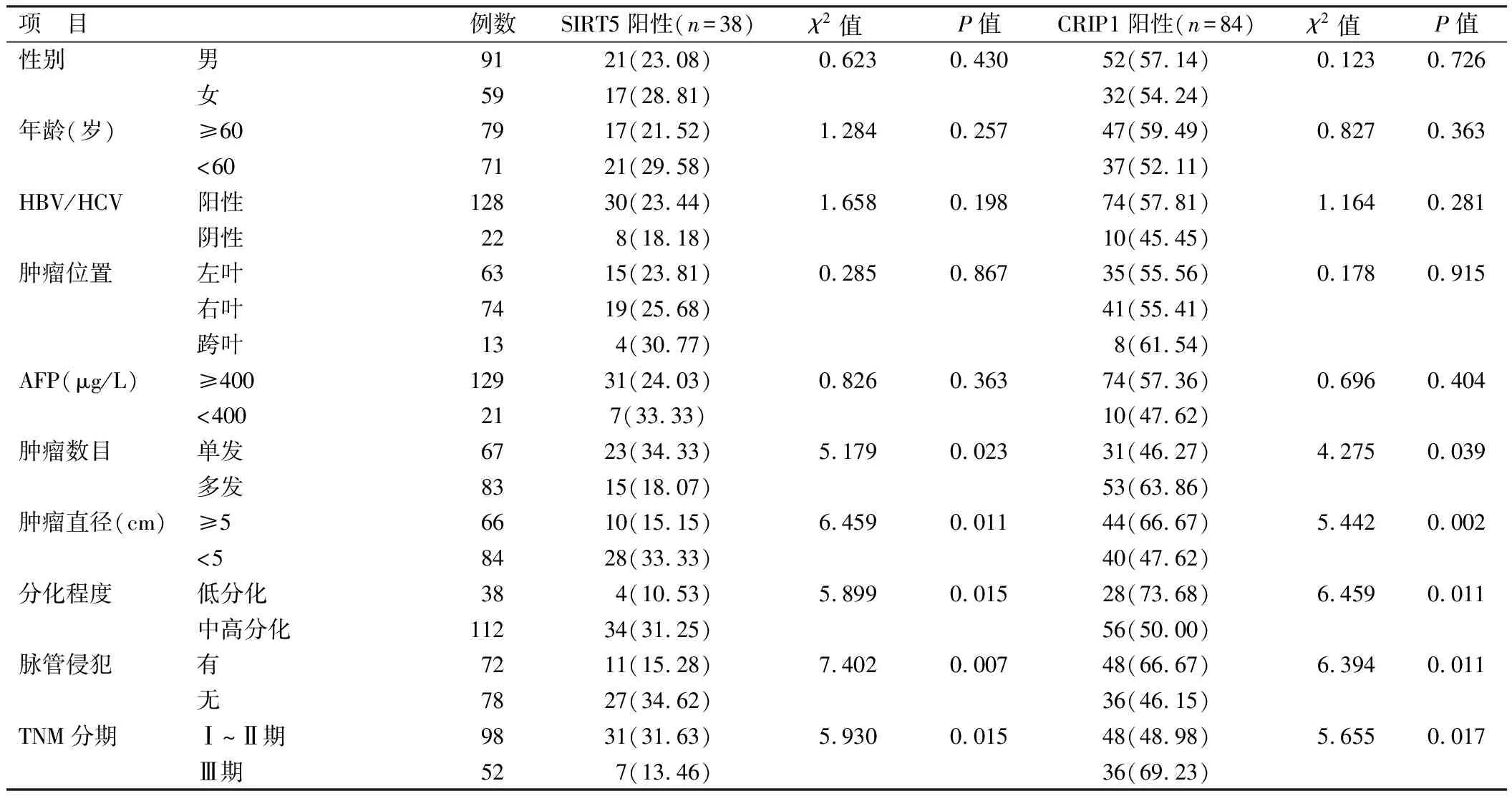
表2 SIRT5、CRIP1表达在HCC患者不同临床/病理特征中差异比较 [例(%)]
2.3 不同SIRT5、CRIP1表达的HCC患者生存率比较 150例HCC患者随访3年,失访11例,死亡71例,3年总生存率为56.83%(79/139)。Kaplan-Meier生存曲线分析显示,SIRT5阳性表达组(35例)3年总生存率68.57%(24/35)高于SIRT5阴性表达组(104例)的42.31%(44/104);CRIP1阳性表达组(82例)3年总生存率31.71%(26/82)低于CRIP1阴性表达组(57例)的73.68%(42/57)(Log-rankχ2=7.552、20.942,P=0.006、<0.001),见图1。
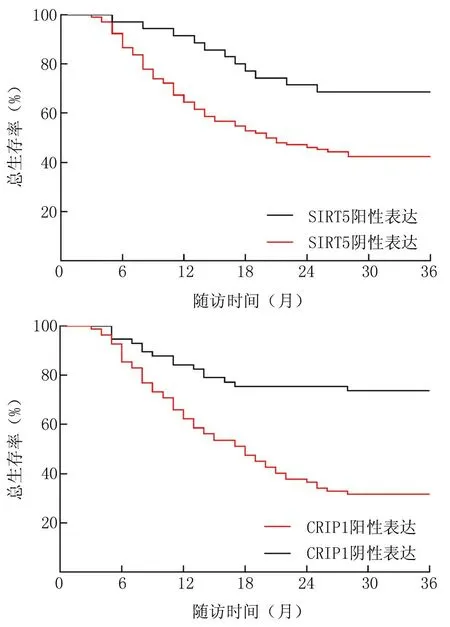
图1 SIRT5、CRIP1阳性/阴性表达HCC患者Kaplan-Meier生存曲线Fig.1 Kaplan-Meier survival curve of patients with positive/negative expression of SIRT5 and CRIP1 in HCC
2.4 Cox回归分析影响HCC患者预后的因素 以HCC患者预后(死亡/存活=1/0)为因变量,以上述结果中P<0.05项目为自变量进行多因素Cox回归分析,结果显示:肿瘤数目多发、肿瘤直径≥5 cm、低分化、脉管侵犯、TNM分期Ⅲ期、CRIP1阳性为HCC患者死亡的独立危险因素,SIRT5阳性为独立保护因素(P<0.05),见表3。

表3 Cox回归分析影响HCC患者预后的因素
3 讨 论
HCC是起源于肝细胞且血供丰富的恶性肿瘤,其发病可能与HBV/HCV感染、非酒精性脂肪性肝炎、饮酒过度、肝硬化、食用黄曲霉毒素污染食物等有关[3]。根治性切除是早期HCC的有效治疗方法,但由于其起病隐匿和HCC高危人群筛查未能普及,导致70%~80%的初诊患者处于中晚期,5年总体生存率不足15%[13]。虽然近年来基于程序性细胞死亡蛋白-1及配体的免疫药物和基于血管生长因子的靶向药物被用于HCC治疗,但HCC血供复杂、恶性程度高且进展迅速,仅部分患者能获得临床效益[14-15]。因此有必要确定更多HCC预后生物标志物,对指导临床早期干预和促进预后改善意义重大。
蛋白质翻译后修饰是蛋白质翻译中或翻译后的共价加工过程,乙酰化修饰作为最常见的酰化修饰类型,参与代谢调控、转录因子激活、染色质重塑等几乎所有的生命活动过程,在恶性肿瘤中发挥至关重要的作用[14]。SIRT5是沉默信息调节因子2的同源基因家族第5个成员,主要定位于线粒体,能通过催化脱丙醇酰化、脱琥珀酰化、赖氨酸脱谷氨酰化等过程参与细胞代谢、损伤修复、氧化应激、细胞周期、DNA转录、血管生成等调控[4,16]。近年来多项研究报道了SIRT5与肿瘤的关系,如SIRT5能抑制磷脂酰肌醇3-激酶/蛋白激酶B信号通路,抑制前列腺癌细胞转移[17];SIRT5能通过促进醛脱氢酶5家族成员A1去琥珀酰化,促进乳腺癌细胞的增殖[18]。这些研究提示SIRT5在不同肿瘤中发挥抑癌或促癌作用。有学者报道,肝癌细胞SIRT5低表达会促进肝癌细胞生长[5]。同时SIRT5低表达导致胰腺癌患者预后不良,SIRT5高表达与乳腺癌预后不良相关[19-20]。本研究结果显示,HCC组织SIRT5低表达,与肿瘤数目、肿瘤直径、分化程度、脉管侵犯和TNM分期有关,且SIRT5阳性表达患者3年生存率升高,可降低HCC患者死亡风险,说明SIRT5低表达与HCC恶性进展和预后不良有关。究其原因,SIRT5低表达有助于波形蛋白乙酰化激活,促进上皮—间质转化,增强HCC细胞迁移和侵袭能力,促进HCC发生发展[21];同时SIRT5低表达也有助于激活信号传导及转录激活蛋白3乙酰化激活,通过Nanog同源基因维持肿瘤细胞干性,促进HCC细胞增殖和分化失控,从而导致HCC发生发展[5]。
CRIP1是一种在肠道广泛表达的小分子蛋白,可通过LIM结构域的锌指结构调节蛋白质—蛋白质相互作用,从而影响细胞增殖、分化、迁移、免疫、信号传导、细胞凋亡等肿瘤进程[6]。近年来大量研究报道了CRIP1参与肿瘤进程,如CRIP1能促进p65结合CXC趋化因子1/5,增加核因子-κB转录,抑制CD8+T细胞浸润,从而促进胰腺癌细胞免疫逃逸[22]。CRIP1能激活Wnt/β-连环蛋白信号通路,促进上皮性卵巢癌细胞侵袭和转移[23]。有学者报道,肝癌细胞CRIP1高表达会促进肝癌细胞增殖和转移[7]。本研究结果显示,HCC组织CRIP1高表达,与肿瘤数目、肿瘤直径、分化程度、脉管侵犯和TNM分期有关,且CRIP1阳性表达患者3年生存率降低,会增加HCC患者死亡风险,说明CRIP1高表达与HCC恶性进展和预后不良有关。究其原因,CRIP1能与γ-丁甜菜碱羟化酶相互作用激活Wnt/β-catenin信号通路,维持HCC细胞干性,从而导致HCC发生发展[24]。同时CRIP1还能与大鼠肉瘤基因相互作用,激活大鼠肉瘤基因/蛋白激酶B信号通路,促进HCC细胞增殖[25]。
综上所述,SIRT5在HCC组织中低表达,CRIP1高表达,与肿瘤数目、肿瘤直径、分化程度、脉管侵犯和TNM分期有关,是HCC患者死亡的独立危险因素,可能成为HCC患者预后评估的生物标志物。但仍需多中心、大样本研究验证。
利益冲突:所有作者声明无利益冲突
作者贡献声明
韩璐、纪爱芳:设计研究方案,实施研究过程,论文撰写;魏子白:课题设计,论文撰写;栗彦琪:提出研究思路,分析试验数据,论文审核;王彪:实施研究过程,资料搜集整理,论文修改
