生物可降解聚酯/生物陶瓷3D 打印骨组织工程支架研究进展
2024-04-25刘嗣聪刘宏治殷亚然
刘嗣聪, 刘宏治, 殷亚然
( 1.浙江理工大学 材料科学与工程学院,杭州 310018;2.浙大宁波理工学院 材料科学与工程学院,宁波 315100 )
社会老龄化现象的不断加剧使得更易面临骨骼问题(如骨缺损和关节软骨损伤)的老年人对骨修复手术的治疗需求日益迫切。此外,患者在面临严重创伤、传染病或肿瘤引起的重大骨骼缺损情况下,也需依赖手术植入外源性骨移植物以彻底治愈。其原因在于骨骼的自我恢复能力有限,当骨缺损创口达到6 cm 以上时,骨骼将无法自愈[1]。据统计,全球每年进行的骨移植手术数量超过220 万例,总费用高达25 亿美元[2]。
然而,金属、同种异体骨等传统骨植入物存在着一系列诸如需进行二次手术、应力遮蔽风险[3]、免疫原性隐患及供体部位发病率较高[4]等问题(表1),这进一步加重了老年人进行骨修复手术的风险。生物活性陶瓷虽然具有良好的成骨活性与可降解性能,但因其脆性大,难以进行精密加工。因此,亟需发展一种力学性能适宜、生物降解性及生物相容性优异的骨修复材料,以减小骨修复手术给患者带来的潜在风险。
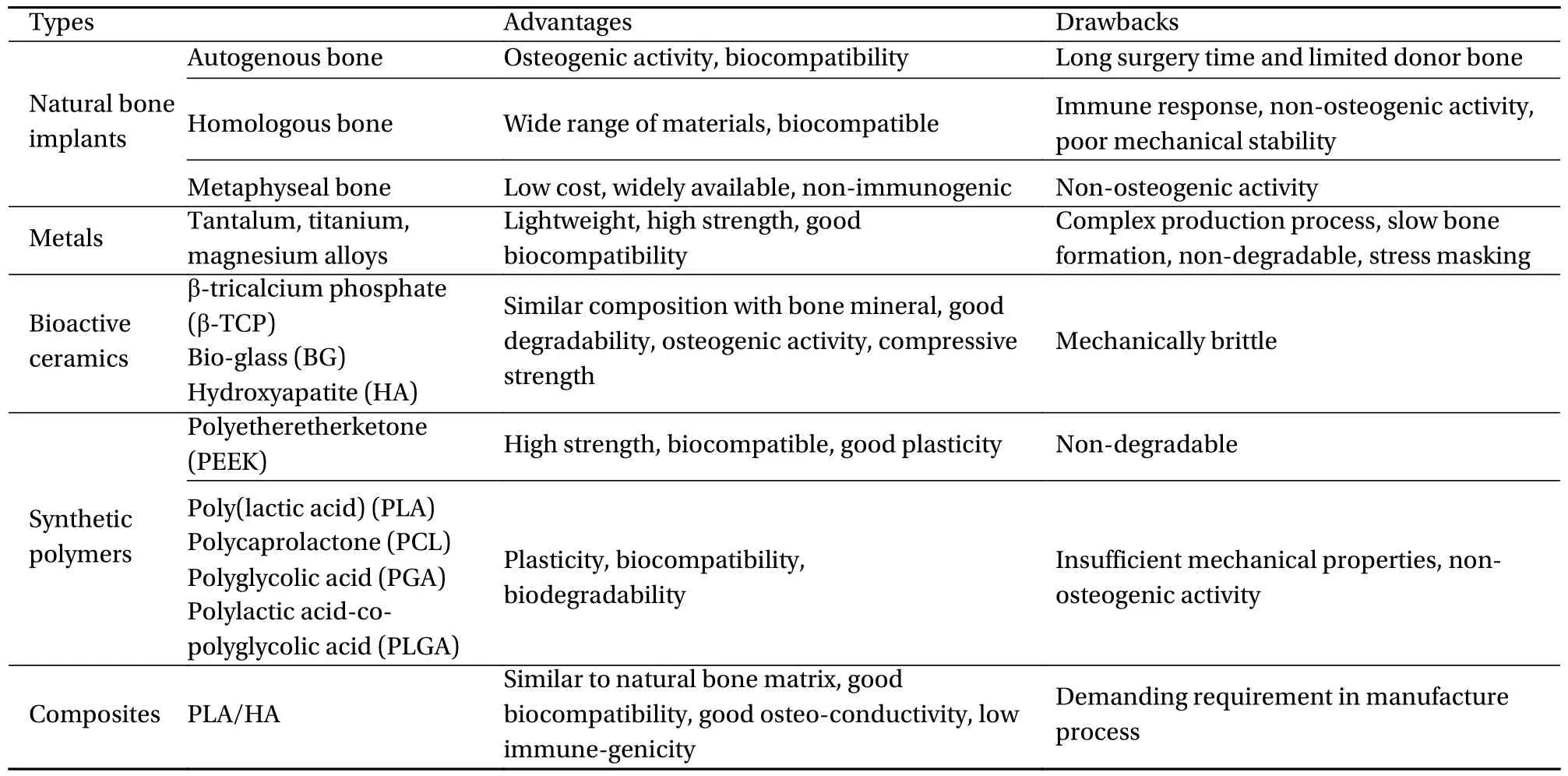
表1 典型骨植入物材料性能对比Table 1 Performance comparison of typical bone implant materials
生物可降解聚酯如聚乳酸(PLLA、PDLA)、聚己内酯(PCL)、聚乙醇酸(PGA)、聚乳酸-乙醇酸(PLGA)等由于良好的生物可降解性和生物相容性使其在骨修复领域受到了广泛的关注,被美国食品药品管理局(FDA)在内的多个国家监管机构批准可用作生物医用材料。它们能在体内逐步降解,并且无残留、无刺激性、无毒副作用。同时,通过调节分子量、改变聚合方法及成型方法,能改变这些生物可降解聚酯的降解速率与力学性能。然而,生物可降解聚酯仍然存在一定的问题,如单一的聚酯材料力学性能较低、无生物活性,且其降解所产生的酸性产物可能不利于组织和细胞的生长。
然而,这些生物可降解聚酯本身不具有成骨活性,不能促进新骨的形成,反而在降解过程中会释放出H+,使植入部位环境pH 下降,可能引发机体炎症反应[5]。生物陶瓷不仅具有良好的生物活性和力学模量,而且由于成分与人体骨骼的无机相(大部分为羟基磷灰石晶体)类似,在降解过程中能缓慢释放出Ca2+和,可为骨重建提供重要的原材料[6]。此外,生物陶瓷降解所产生的碱性环境能中和聚酯降解产生的H+,进而减少炎症反应发生的几率,因此生物可降解聚酯/生物陶瓷复合材料制备的骨植入物(如骨钉、骨板等)具有良好的骨修复效果[7]。
国内外学者对骨修复进程的深入研究表明,理想的骨植入物在具备合适力学性能与降解性能的同时,还应能促进新骨的形成以缩短骨修复疗程。然而,生物可降解聚酯/生物陶瓷骨钉、骨板是以负载件为目的设计,其比表面积较低,因而与植入部位的物质交换缓慢,促进骨骼再生的效果有待提高。
骨组织工程受到骨的层次结构与发育过程的启示,通过模拟松质骨结构以提供一个适合宿主细胞增殖分化、新的骨组织重建的微环境,从而加速骨缺损的修复(图1)。组织工程支架是模拟松质骨结构的良好选择[8]。理想的骨组织工程支架应具备一系列关键特性,如良好的力学性能、适当的孔隙度、表面粗糙度、生物可降解性、细胞相容性及成骨活性等。因此,骨组织工程概念的引入,让生物可降解聚酯/生物陶瓷复合材料所具备的成骨活性得到充分发挥。

图1 基于自然骨结构的骨植入物设计Fig.1 Bone implant design based on natural bone structure
目前,生物可降解聚酯/生物陶瓷支架的制备途径主要包括静电纺丝[9]、气体发泡[10-11]、溶剂铸造/颗粒浸出[12]、热诱导相分离[13-14]等(图2、表2)。然而,这些方法得到的支架结构通常不规则、孔径不可控、强度相对较低且可重复性较差,从而降低了支架的实用性。

图2 支架制造技术示意图Fig.2 Schematic illustrations of classical scaffold fabrication techniques

表2 传统骨组织工程支架制备方法Table 2 Preparation methods of bone tissue engineering scaffolds
3D 打印技术显著改进了传统支架制备的局限性。该技术于1989 年首次被报道[8],并在支架成型领域迅速得到广泛应用。3D 打印,也被称为增材制造,是一种基于分层制造和逐层叠加原理,通过计算机辅助设计和数控技术,能够快速、精确地制作出骨组织工程支架实体模型的技术。该制备过程通常包括CT 扫描或磁共振成像获取患者骨缺损部位的三维数据,并通过计算机辅助设计(CAD) 软件对这些数据进行“切片”,将每一层的数据导入3D 打印系统,然后将材料逐层打印堆积,最终得到所需的骨组织工程支架[15]。
由于生物可降解聚酯/生物陶瓷复合材料具有良好的可塑加工性,能作为3D 打印的原材料,这为骨组织工程支架制备带来了一种崭新的方法[16]。3D 打印技术,如熔融沉积建模或熔丝制造(FDM/FFF)[17]、扫描激光烧结(SLS)等[18-19](图3、表3)[17-22],使得生物可降解聚酯/生物陶瓷支架制备更加精确、高效且可重复。通过该技术制造的骨支架可最大程度地模拟患者骨缺损处的原始解剖结构,且支架内部的孔径可进行精确调控,因此该技术在生物可降解聚酯/生物陶瓷组织工程支架制备领域受到了广泛关注。
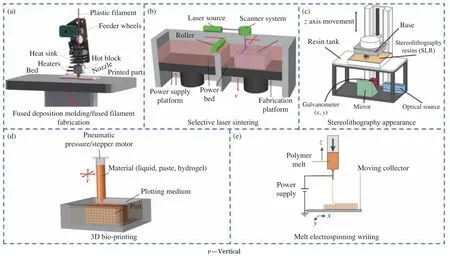
图3 各种3D 打印工艺的示意图:(a) 熔融沉积建模/熔丝制造[17];(b) 扫描激光烧结[19];(c) 立体光刻打印[20];(d) 3D 生物打印[21];(e) 熔融电写[22]Fig.3 A compilation/schematic of various 3D printing processes: (a) Fused deposition molding/fused filament fabrication[17];(b) Selective laser sintering[19]; (c) Stereolithography[20]; (d) 3D bio-printing[21]; (e) Melt electrospinning writing[22]
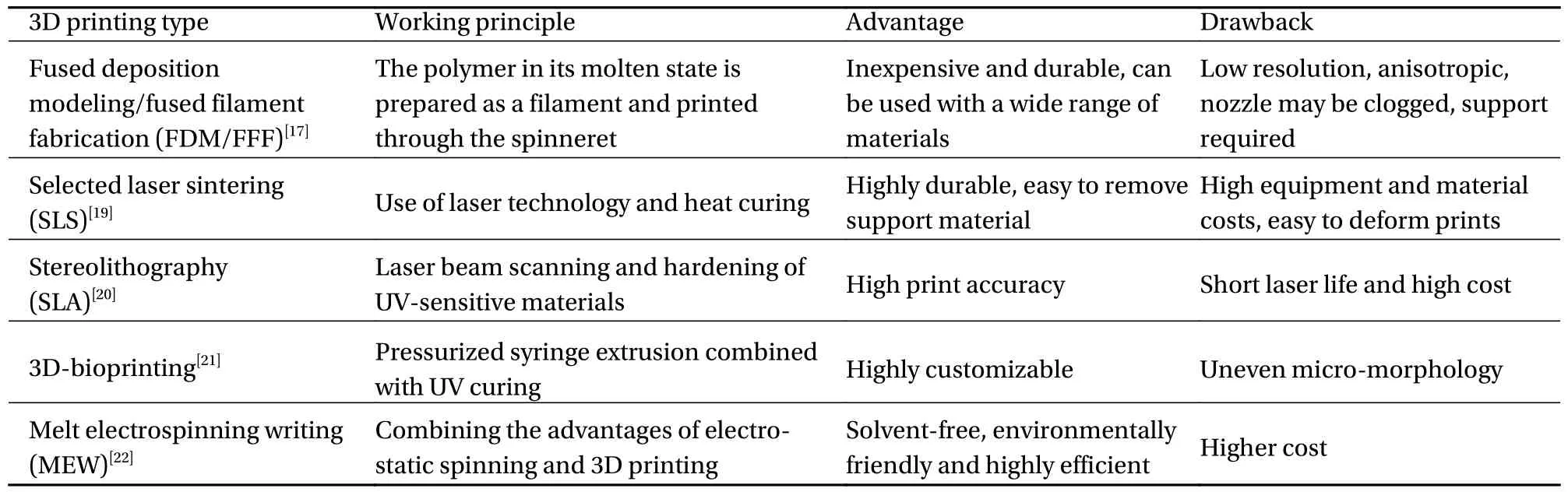
表3 3D 打印骨组织工程支架制备方法Table 3 Preparation methods of 3D printing bone tissue engineering scaffold
本文总结了生物可降解聚酯/生物陶瓷骨组织工程支架的结构、性能要求及其表征方法,同时回顾了近年来提升3D 打印生物可降解聚酯/生物陶瓷骨组织工程支架性能的策略,并对未来3D打印生物可降解聚酯/生物陶瓷支架的发展进行了展望。
1 生物可降解聚酯/生物陶瓷概述
1.1 生物可降解聚酯
生物可降解聚酯材料最早在上世纪30 年代投入医疗行业,最早应用于外敷伤口材料或是医用缝合线材料。可应用于骨修复的生物可降解聚酯主要包括聚乳酸(PLA)、聚己内酯(PCL)、聚乙醇酸(PGA)、聚乳酸-乙醇酸(PLGA)等。图4 与表4 分别总结了常见生物可降解聚酯的合成方式与理化性能。
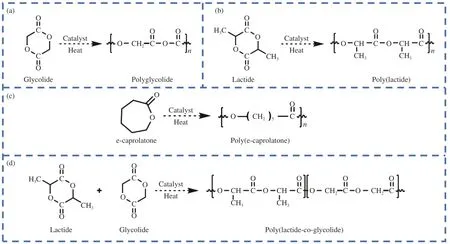
图4 各类生物可降解聚酯的合成路径:(a) 聚乙醇酸(PGA);(b) 聚乳酸(PLA);(c) 聚己内酯(PCL);(d) 聚乳酸-乙醇酸(PLGA)Fig.4 Synthetic paths of various biodegradable polyesters: (a) Poly(glycolic acid) (PGA); (b) Poly(lactide acid) (PLA); (c) Poly(e-caprolactone) (PCL);(d) Poly(lactide-co-glycolide) (PLGA)
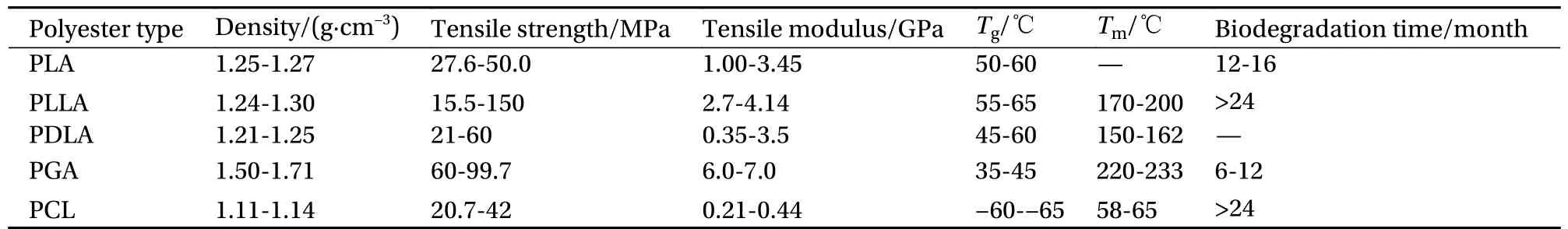
表4 典型生物可降解聚酯的性能对比Table 4 Performance comparison of typical biodegradable polyesters
1.1.1 聚乳酸(PLA)
PLA 是一种以乳酸或其二聚体丙交酯缩聚而成的热塑性聚酯,被FDA 在内的多个国家监管机构批准可用作生物医用材料。由于PLA 具有良好的机械强度、生物降解性及生物相容性,在生物可降解骨修复材料中潜力很大[23]。PLA 是一种具有旋光性的聚合物,可分为左旋聚乳酸(PLLA)、右旋聚乳酸(PDLA)及内消旋聚乳酸(PDLLA),它们的物理性能有所差异,降解速度也不同。
1.1.2 聚己内酯(PCL)
PCL 是另一种经FDA 批准的常用于骨组织再生领域的生物可降解聚酯。PCL 具有良好的生物相容性、力学性能与高柔韧性、高伸长率,且酸性分解产物较少。虽然PCL 的降解速度相对其他聚酯(如PLA)较慢,但这为患者的骨重建提供了充足时间。此外,PCL 的熔化温度为55~60°C,具有良好的加工性能。但PCL 的降解时间相对其他聚酯较长,且同样没有骨传导性与骨诱导性,不能促进新骨的生成。
1.1.3 聚乙醇酸(PGA)
与其他生物医学聚合物相比,PGA 具有较高的结晶度,杨氏模量为 7.0 GPa,熔化温度约为230℃,与其他可生物降解聚合物相比具有更高的机械强度。PGA 的机械强度与人体骨骼相似,因此是一种适用于骨骼、软骨和牙齿再生的支架材料。此外,PGA 还能改善细胞的黏附、增殖、迁移和分化,从而促进组织的快速再生。
1.1.4 聚乳酸-乙醇酸(PLGA)
PLGA 是聚乳酸与乙醇酸的共聚物,其力学性能与降解性能可根据聚乳酸/乙醇酸的比例调整。PLGA 具有良好的生物相容性、可调降解性和力学性能,因此被广泛应用于人体不同部位的骨组织修复。
1.1.5 其他生物可降解聚酯
聚(3-羟基丁酸-3-羟基戊酸) (PHBV)是一种具有良好生物降解性、生物相容性和生物基可降解聚酯。然而,PHBV 也有一些突出的缺点,如力学性能弱、热稳定性低、加工困难和高疏水性。
1.2 生物陶瓷
生物陶瓷是一类与人体骨骼的主要组分相似的陶瓷基材料,已被研究应用于骨组织替代植入物。生物陶瓷纳米材料,尤其是基于磷酸钙的材料,已被广泛用于骨科和牙科领域,包括β-磷酸三钙(β-TCP)、羟基磷灰石(HA)及生物玻璃(Bioglass)等材料。
1.2.1 羟基磷灰石 (HA)
HA 的化学式为Ca10(PO4)6(OH)2,其结构成分与天然骨骼、牙齿相似,因此具有良好的生物相容性。HA 的良好生物降解性能提高骨缺损部位的Ca2+离子浓度,从而加强植入物与植入部位骨组织的缔合。另外,HA 还有良好的骨传导性,因此是生物可降解聚合物基复合材料的良好选择。
1.2.2 磷酸三钙 (TCP)
TCP 有3 种多晶体,包括α-TCP、β-TCP 和 α'-TCP,是另一种著名的骨修复用生物陶瓷。β-TCP 因其优异的生物相容性和生物活性而受到越来越多的关注。虽然HA 的力学强度高于β-TCP,但β-TCP 的可吸收性更强,从而使其具有更强的成骨活性,因而在一些不需要较高负载的骨植入物器件中,磷酸三钙成为了更优秀的选择。
1.2.3 生物玻璃 (BG)
BG 是一种化学组成与骨骼相似,具有良好生物相容性的骨组织替代物。BG 通常由含钙硅酸盐组成。其商业化最成功的牌号为45 S5。BG 的骨结合机制可归结为一系列界面反应,从而在材料表面形成类似骨的磷灰石层,而BG 的成骨潜力则归因于其释放的如 Ca2+、PO43-和 Si4+等离子。在常见的生物陶瓷中,生物玻璃具有较强的力学性能,但其降解速度较慢,适用于需要较高力学性能的植入部位。
1.2.4 磷酸八钙(OCP)
OCP 被认为是形成骨磷灰石晶体的前体之一,并可在生理环境下转化为HA,因此受到广泛关注。它被认为在生物矿化和骨重建过程中发挥着重要作用。与其他磷酸钙材料相比,OCP 具有更高的骨传导性和生物降解性。它可以通过类似耦合的代谢机制,与成骨细胞、破骨细胞合作。此外,OCP 可通过激活成骨细胞来促进骨形成,并诱导破骨细胞样细胞的出现,从而促进骨形成。由于其卓越的骨诱导特性和生物活性特性,OCP有可能被用作一种前景广阔的骨移植替代物。
2 骨组织工程支架的结构与性能
骨修复工程用骨植入物是由以承重为主要目标的负载件向兼具多功能性的组织工程支架方向发展的。设计骨组织工程支架既需要满足骨缺损所需要的力学性能,又要尽量提升其降解性与生物功能性。组织工程支架的骨修复能力受其微观形貌与宏观结构、力学性能、降解性能及生物功能性等因素的综合影响。支架的形态结构、力学性能及降解性能决定了其基础性能,而生物功能性赋予其促进骨修复的能力。图5 为3D 打印生物可降解聚酯/生物陶瓷骨组织工程支架的结构、性能及改进策略。
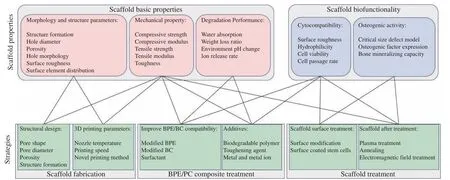
图5 3D 打印生物可降解聚酯/生物陶瓷骨组织工程支架的结构、性能及改进策略Fig.5 Structure, properties and improvement strategies of 3D-printed biodegradable polyester/bioceramics bone tissue engineering scaffolds
2.1 形态结构参数
3D 打印技术虽然使支架整体结构变得可控,但是支架内部结构设计仍需深入探究。支架的宏观形态与微观形貌直接影响支架的力学性能与生物功能性。支架的宏观形态指的是支架整体结构设计、孔径、孔隙率、孔形态等能直观观察到的结构部分。微观形貌指其表面粗糙度和表面元素分布等,可通过SEM、TEM、XPS、EDS 等手段来表征。
支架的孔隙率决定了单位体积中微孔的孔径与密度。较高的孔隙率能促进体液中营养物质的交换从而加快细胞生长,但增加中空区域也会导致支架的力学性能下降[15]。为了模拟细胞外基质(ECM),骨组织工程支架的孔径应当在100~300 μm之间,在此范围内体液中的营养成分能够顺利进行转运[24],因此在设计支架时需要找到孔径、孔隙率及支架力学性能三者之间的平衡。在此基础上,3D 打印技术可以设计支架的整体结构及其孔形态,在保证打印出支架精密结构的同时赋予其额外的力学性能和生物功能性。
微观形貌也是决定支架性能的重要结构参数。比表面积的增大能使支架与体液的接触面积增加,亲水性增强,进而促进细胞附着和支架的降解[25]。生物可降解聚酯/生物陶瓷由于其良好的加工性,能在较高精度下准确打印出设计的支架结构。此外,生物陶瓷作为填料使支架具有较高的表面粗糙度,故以生物可降解聚酯/生物陶瓷复合材料为基体设计的支架具有更广泛的应用前景。
2.2 力学性能
骨组织工程支架的基本要求是具有与植入患部骨骼相近的力学性能,能在骨修复早期提供一定承载能力,且不会因强度过高而导致应力遮蔽。一般而言,支架在人体内承担的是压应力,压缩模量应当在小梁骨与皮质骨之间,即0.01~2.0 GPa至14~18 GPa[26]。依据不同骨损伤植入部位所需的抗压强度,支架性能应能在此范围内调节。在植入过程中,支架也需要承受其他形式的变形,因此抗拉、抗弯及抗扭转性能也在考虑范围之内。国内外研究表明,通过改善生物可降解聚酯/生物陶瓷间的界面相容性[27-29]、添加助剂[30-32]或调整支架结构[33-36]等方式能有效提升支架的力学性能。
2.3 降解性能
早期研究表明,纯聚酯植入物具有降解慢、降解不完全或降解时易引发炎症反应等问题[5],将生物活性陶瓷引入聚酯材料,能显著改善其降解性能[8]。另外,生物陶瓷能中和聚酯材料降解时产生的酸性环境,自身能降解生成Ca2+离子促进骨骼的再生,赋予了支架成骨活性[37]。Backes等[38]比较了PLA/HA 与PLA/β-TCP 复合材料支架的性能,结果发现由于Ca/P 比较低,β-TCP 的生物降解过程比HA 快3~12 倍,但是HA 具有更优异的力学性能和与骨修复疗程更匹配的降解周期[7]。目前,可通过测定支架的吸水率、失重率、植入环境pH 变化、Ca2+离子释放等方式可评估其降解速率。另外,调节支架的降解性能使其降解进程与设计疗程中新骨形成的速度相匹配,这也是当前研究探索的方向之一。
2.4 生物功能性
在生物可降解骨组织工程支架的结构、力学性能、降解率达到骨修复要求之后,如何提升支架的生物功能性变得尤为关键。兼具良好细胞相容性、成骨活性与骨矿化能力、抗菌性及抗肿瘤性能的组织工程支架,其区别于传统的生物可降解骨修复材料,能展现出多功能性、高比表面积、高生物活性的特征。
2.4.1 细胞相容性
良好的细胞相容性是支架生物功能性的基础。在支架表面提供细胞生存的理想环境,能提升成骨细胞吸附、生长、传代、分化的效率。支架细胞相容性可通过物理方法(如测定表面粗糙度、亲水性)[38]或生物方法(测定细胞存活率、传代速度等)[39]来表征。
由于聚酯材料通常是疏水的高分子,例如纯PLA 支架的水接触角约为87°,细胞相容性较差,而生物陶瓷是亲水的小分子,分散均匀的PLA/HA复合材料的水接触角可降至65°左右[40],有效改善了支架的细胞相容性。部分研究者通过向支架中添加亲水的高分子[39]或对支架表面进行等离子体处理[41],能使生物可降解聚酯/生物陶瓷复合材料支架表面的水接触角进一步下降[41]。
2.4.2 成骨活性
成骨活性是组织工程支架引导成骨细胞分化以促进骨修复的性能。成骨活性包括了骨传导性、骨诱导性及骨矿化能力[42]。骨传导性是指骨组织工程支架上附着的生物活性因子促进新生骨由自体骨长入非生物活性结构的能力,可由生物活性陶瓷赋予[43]。骨诱导性是指生物活性因子促进一种组织或其提取物分化成骨的过程。成骨活性可通过成骨因子的表达来评估。在体内测试中则可进一步观察新生骨面积以直观地观察骨修复进展,通过将骨组织工程支架植入临界尺寸缺损(CSD)模型有助于研究人员专注于实验策略的影响,排除各种其他干扰因素进而通过切片观察、评估新生骨面积等手段,直观地表征骨修复过程[44]。提升生物陶瓷在复合材料基体中的比例或在支架的表面接种各类干细胞,能赋予支架骨诱导性,增强支架的成骨活性[45]。
2.4.3 其他性能
骨组织工程支架的应用场景较复杂,因此也需要具备在特定应用场景下所需的其他功能。例如,对于肿瘤性骨缺损,组织工程支架需要拥有一定的抗肿瘤性能与缓释药物的功能[46];对于易感染的深度创伤部位,支架需要良好的抗菌性能[47];对于需要按期观察骨重建情况的病例,向组织工程支架中引入具有荧光能力的微量元素,能通过医学影像学手段观察骨骼的再生[48]。
3 生物可降解聚酯/生物陶瓷骨组织工程支架性能改善策略
近年来,研究者提出了多种改进3D 打印生物可降解聚酯/生物陶瓷骨组织工程支架结构与性能的策略:
(1) 基于不同的植入环境,对支架的结构、力学性能及降解速率进行调控;
(2) 提升支架促进骨修复能力,改善细胞相容性、提高成骨活性及骨矿化能力等;
(3) 提升支架的抗菌性能、抗肿瘤性能等,赋予支架应对不同骨损伤环境的功能。
下文总结归纳了近年来国内外研究者改善生物可降解聚酯/生物陶瓷骨组织工程支架性能的策略。
3.1 基础性能
3.1.1 力学性能
当生物陶瓷在复合材料中的添加比例较高时(20%~50%),能有效改善复合材料的生物活性,但也会降低复合材料的力学性能[8]。一方面生物陶瓷是亲水小分子,聚酯是疏水大分子,将大量生物活性陶瓷引入聚酯基体中易导致前者发生团聚,从而降低了复合材料的均匀性;另一方面聚酯基体分子链段的运动也会受到很大限制,导致复合材料韧性下降。
为了改善生物陶瓷与聚酯两相间的相容性,有学者通过加入具有生物相容性的界面改性剂(如多巴胺[27]、硅烷偶联剂[28]、硬脂酸[29]等)来减少生物陶瓷的团聚,提升支架的力学性能(图6)。Yang 等[27]使用多巴胺和六亚甲二胺修饰HA 纳米颗粒,并通过氨解反应将HA 接枝到PLLA 链上,从而改善了PLLA/HA 间的相容性(图6(a)),使用FDM 技术制备了孔径为800 μm 的支架。力学性能结果表明,该复合材料3D 打印支架相较于纯PLLA 支架抗压强度上升28%。
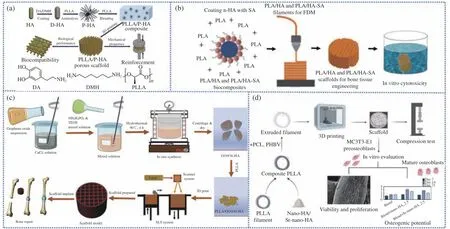
图6 (a) 左旋聚乳酸(PLLA)/左旋聚乳酸改性羟基磷灰石(P-HA)支架的制备流程[27];(b) 熔融沉积建模(FDM)技术制备PLA-硬脂酸(SA)支架[29];(c) 扫描激光烧结(SLS)技术制备PLLA/氧化石墨烯(GO)@Si-HA 复合材料支架[31];(d) PLA/PCL/聚(3-羟基丁酸-3-羟基戊酸) (PHBV)/锶取代纳米羟基磷灰石(Sr-nHA)复合材料支架的制备与表征[32]Fig.6 (a) Preparation process of poly(L-lactide) (PLLA)/PLLA-modified HA nanoparticles (P-HA) scaffolds[27]; (b) Preparation of PLA-stearic acid (SA)scaffolds by fused deposition modeling (FDM) technique[29]; (c) Preparation of PLLA/graphene oxide (GO)@Si-HA by selected laser sintering (SLS)technique[31]; (d) Preparation and characterization of PLA/PCL/poly(-3-hydroxybutyrate-co-3-hydroxyvalerate) (PHBV)/Sr-nano-hydroxyapatite (Sr-nHA) composite scaffolds[32]
Zhang 等[28]采用硅烷偶联剂(WD-10) 改善HA 与PLA 间的界面相容性,然后通过FDM 技术制备了HA 负载量分别为30wt%和50wt%的PLLA /HA复合材料骨修复支架。结果表明,含30wt%HA 的复合材料支架的抗拉模量相较纯PLLA 支架由43 MPa 上升到了45.5 MPa。而50wt%HA 支架的抗拉模量虽然也有所提升,但其抗压模量下降幅度较大。这说明HA 的填充度达到50%时,会对支架的力学性能有较大幅度的影响。SEM 观察发现,相较于未经改性的样品,含改性HA 的复合材料表面显示出更致密的微观结构,HA 颗粒在PLA基体中分布也更均匀。
Andrade 等[29]使用硬脂酸(SA) 包覆处理的HA 与PLA 共混制备了PLA/SA-HA 复合材料,然后通过FDM法制备了孔径为300 μm 的支架(图6(b))。PLA/HA 与PLA/SA-HA 支架的压缩实验表明,PLA/HA 支架与PLA/SA-HA 支架具有相近的抗压强度,而后者具有更高的韧性。这表明使用SA包覆HA 颗粒具有良好的效果,减少了HA 团聚体的形成,增强了HA 颗粒的分散。在PLA/HA 共混阶段,SA 涂层降低了最大扭矩与平衡扭矩,减少了物料间的摩擦。制备得到的长丝韧性上升,因此FDM 技术制备得到的支架韧性上升。
除了改善PLA 与HA 间的界面相容性,也可以向PLA/HA 中加入第三组分来改善其韧性。研究表明,向PLA 中加入核桃粉(WS) 会诱导PLA基体的球晶半径减小,结晶度下降,从而改善其抗拉强度[49]。Song 等[30]采用FDM 技术制备了孔径为1.2 mm 的PLA/WS/HA 复合材料支架,并对其进行压缩性能测试。研究结果表明,当WS 含量为8wt%,HA 含量为3wt%时,支架的抗压强度和模量达到最大值,分别为35.72 MPa和883.22 MPa,相较于纯PLA 支架分别上升了14%和48%,表明改性后支架的抗压和抗变形能力得到增强。
氧化石墨烯(GO)是一种有效的增强剂,将其掺入PLLA 基体,能有效提升其力学性能[50],同时掺硅HA (Si-HA)能在降解过程中释放Ca2+与Si2+,有效提升支架的生物学活性[51]。然而,GO 与Si-HA 与PLA 的相容性较差,为此,Wang 等[31]通过在GO 上原位生长Si-HA 获得GO@Si-HA 纳米体系,并将其与PLLA 复合,使用SLS 技术制备支架(图6(c))。力学性能测试发现,PLLA/GO@Si-HA复合支架的抗压强度和模量分别较纯PLLA 支架提高了85%和120%。
PCL 是另一种具有良好生物降解性和力学柔韧性的骨组织工程用热塑性聚酯材料,添加PCL 能赋予PLLA/HA 复合材料良好的拉伸性能[52]。Kontogianni 等[32]制备了含PLLA、PCL 及PHBV 的共混物,然后在该共混物中富集纳米羟基磷灰石(nHA)和锶取代纳米羟基磷灰石(Sr-nHA) 制备出FDM打印用长丝(图6(d))。结果显示,孔径为800 μm的PLLA/PCL/PHBV 复合支架的平均压缩模量达到了32 MPa,相较于纯PLLA 支架提升了23%。表5 归纳了文献报道的代表性添加剂对PLA/HA支架力学性能改善效果。

表5 文献报道的FDM 打印制备的PLA/HA 复合材料骨组织工程支架力学性能Table 5 Mechanical properties of PLA/HA bone tissue engineering scaffolds prepared by FDM printing reported in the literature
生物陶瓷的粒度能显著影响其在基体中的分散度,进而影响支架整体的力学性能。Jiao 等[53]采用自主研发的熔体微分 FDM 三维打印机制备了纳米HA/PCL 支架和20wt%micro-HA/PCL 支架。支架具有均匀分布且相互连接的矩形孔隙(长宽均在100~500 μm 范围内),孔隙率为65%。形态学研究结果表明,纳米-HA/PCL 支架中的 HA 颗粒分布均匀,而micro-HA/PCL 支架中的 HA 颗粒呈团块状,这使得前者具有更高的抗拉强度(23.29 MPa)和抗弯强度(21.39 MPa),比纯 PCL 试样分别高出26.0%和33.1%。
除了调控PLA/HA 的微观相形态外,优化支架结构(如孔形态)能改变支架的受力方式,从而改善其力学性能[54]。
Eshraghi 等[55]通过SLS 技术,使用PCL 和HA制成了具有适合骨组织工程的力学性能的生物可吸收支架。实验结果表明,在 PCL∶HA 质量比为100∶0、90∶10、80∶20 和70∶30 时,压缩模量分别为299.3、311.2、415.5 和498.3 GPa。随着HA 负载的增加和设计孔隙率的降低,抗压强度呈上升趋势。当PCL∶HA 从100∶0 变为 70∶30 时,压缩模量从 14.9 GPa 增加到 36.2 GPa (上升142%)。
Sahmani 等[33]研究了具备不同孔形态与孔径(编号1 为0.8 mm,编号2 为1.2 mm) 的PLA/HA支架的力学性能(表6)。结果表明,立方体、圆柱形及六边形孔形态的支架抗压强度分别为6.2 MPa、6.7 MPa 及7.55 MPa,通过改变孔隙的几何形状,所制备支架的杨氏模量可提高近4 倍。

表6 不同孔隙形状与孔径的3D 打印PLA/HA 骨组织工程支架的力学性能[33]Table 6 Mechanical properties of 3D printed PLA/HA bone tissue engineering scaffolds with different pore shapes and pore diameters[33]
Premphet 等[34]分别研究了3D 打印的喷嘴温度、支架密度及打印速度对PLA/HA 复合材料支架力学性能的影响。结果表明,通过提高喷嘴温度和支架密度可调控支架的抗压强度,而打印速度对支架的抗压强度无影响。
由于PLA 结晶速度慢,可通过退火处理提升其结晶度,进而增加复合材料支架的力学性能。Premphet 等[34]的进一步研究发现,PLA/HA 支架在80℃退火30 min 后,其抗压强度从63.98 MPa增加到71.40 MPa (较未退火试样提升了11.60%)。Hwangbo 等[35]发现退火处理对支架抗弯曲性能提升也有一定贡献。当PLLA/HA 复合材料支架的退火温度为110℃和退火时间为60 min 时,其抗弯强度提高了1.4 倍,抗弯模量提高了2.1 倍。
Pérez-Davila 等[36]开发了无需预制成丝的直接FDM 打印技术制备PLA/HA 复合材料支架。实验结果证明了该方法的多功能性,支架中HA 掺入量可高达13wt%,且基体中的HA 颗粒在支架纵向和横截面上均匀分布。
3.1.2 降解速率
将不同的生物可降解聚酯复合,能够调节骨组织工程支架的降解速率。PGA 的降解速率相对PLA 较快,为此Shuai 等[39]用SLS 技术制备了PLLA/PGA/HA 支架,探究了PGA 对支架降解速率的影响。结果表明,支架在磷酸盐缓冲溶液(PBS)环境中浸泡28 天后,其失重率从3.3%提高到25.0%。这归因于PGA 降解速度较快,PLLA 基体中产生大量孔隙,从而增加了其与体液的接触面积,提升了支架的降解速率。
PCL 因较高的结晶度与疏水性,导致其降解率相比于PLA 较慢[56]。但PLA/PCL 共混物的降解率高于PLA,这可能是由于PCL 的增塑作用破坏了PLA 的结晶区,进而增强了PLA 的降解能力[57]。基于此研究,Åkerlund 等[58]使用FDM 技术制备了PLA/PCL/HA 复合材料支架。加速降解试验表明,PLA/PCL/HA 复合材料支架的失重率增加至60%,相较于PLA/HA 支架提升了23%。
3.2 促骨修复活性
3.2.1 细胞相容性
喷雾干燥法制备的微球状HA 具有更高的比表面积与更低的表面能,能增大HA 与PLA 基体和体液的接触面积。Corcione 等[59]采用喷雾干燥法制备了微米级羟基磷灰石微球(sdHA),sdHA与PLA 共混后采用FDM 技术制备了骨组织工程支架。形态观察表明,纯PLA 支架表面光滑,细胞难以在其表面附着,而PLA/sdHA 支架表面具有粗糙形貌,能够增大与细胞间的接触面积,从而有效改善支架表面的细胞相容性。
低浓度的金纳米粒子能促进角质细胞的增殖,加快伤口的愈合。结合等离子体处理技术,Joseph等[60]将金纳米粒子固定在FDM 技术制备的PCL支架表面,以制备具有加速伤口愈合能力的支架。结果表明,等离子体改性后的支架亲水性显著提高。体外生物相容性研究表明,3D 打印支架表面的金纳米颗粒与活细胞具有良好接触,且无免疫反应。
聚多巴胺(PDA)是一种受贻贝启发,由多巴胺氧化聚合而产生的黏附材料,由于其含有大量的活性胺和儿茶酚基团,对多种有机或无机材料有很强的黏附作用[61-62]。Feng 等[40]采用PDA 改善了PLLA/HA 的界面相容性,然后采用SLS 技术制备了支架。该支架通过诱导磷灰石沉淀表现出良好的生物活性,为人骨间充质干细胞的附着和增殖提供了良好的环境。
Dou 等[63]通过3D 打印和冷冻干燥技术的结合,开发了一种具有较大的前孔尺寸(>1 100 μm×1 100 μm) 和侧孔尺寸(>500 μm)的分层PLGA/纳米羟基磷灰石(n-HA)/明胶支架,为细胞和组织向内生长提供足够的开放空间和可靠的一体化支撑。细胞培养结果证实,添加了明胶的PLGA/n-HA 支架更有利于细胞附着。在大鼠股骨缺损模型中的体内评估表明,该支架更有利于新骨的形成,并且支架与原始组织之间的结合更紧密。
Bahraminasab 等[41]将富血小板血浆(PRP)涂覆在3D 打印PLA/明胶-纳米羟基磷灰石(G-nHA)支架上。PRP 中含有生长因子,有助于促进成骨细胞的增殖与分化[45]。明胶是一种具有极好的生物相容性和生物降解性能的天然聚合物,将其与HA 复合有助于促进细胞黏附、分化和增殖[64]。细胞毒性测试(MTT) 结果显示,相较于纯PLA 和PLA/G-nHA 支架,PLA/G-nHA/PRP 支架在各时间点的细胞增殖率最高,且表面具有较好的细胞黏附性。
3.2.2 成骨活性
Feng 等[40]等使用多巴胺(DA)改善了PLLA 与HA 的界面相容性,并采用SLS 技术制备支架。结果表明,DA 的加入减少了HA 在PLLA 基体内的团聚。良好的分散性使该支架在体内均匀缓释HA,进而加快成骨和促进血管化;与纯PLLA 支架相比,骨体积分数和骨矿物质密度分别提高了44.44%和41.73%。
葫芦素B (CuB)是一种从葫芦科植物中提取的四环萜,它能促进体外血管生成。Cheng 等[65]采用3D 低温快速成型(LT-RP)技术将CuB 掺入PLGA/β-TCP 骨修复支架中。大鼠颅骨缺损模型试验结果表明,与不含CuB 的支架植入物相比,PLGA/CuB支架显著增强了骨缺损部位的新生血管和骨再生。
丹参酚酸B (SB)可通过调节糖皮质激素诱导刺激成骨细胞的总代谢活性和碱性磷酸酶活性以缓解骨质疏松症状。然而,SB 的化学结构不稳定,易被氧化。Lin 等[66]将SB 掺入PLGA/β-TCP 支架(图7)。结果表明,添加的 SB 从支架中稳定地释放出来。释放出的部分SB 能促进体外成骨和血管生成。在动物实验中,SB 对支架内新骨形成、矿物质沉积率和血管密度的影响随其浓度上升而增强。
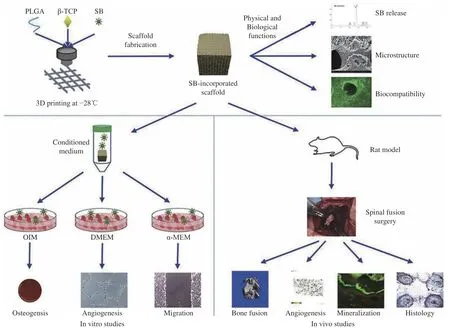
图7 聚乳酸-乙醇酸(PLGA)/β-磷酸三钙(β-TCP)/丹参酚酸B (SB)支架的制备流程与体内外表征[66]Fig.7 Preparation process and in vitro and in vivo characterization of polylactic acid-co-polyglycolic acid (PLGA)/β-tricalcium phosphate(β-TCP)/salvianolic acid B (SB) scaffolds[66]
部分金属或金属离子具有良好的促骨修复能力,但由于常规的引入方式难以控制其在体内长时间、缓慢地释放,因此将其与骨组织工程支架相结合能有效提升支架整体的促骨修复性能。
铕(Eu) 是一种具有促进骨髓间充质干细胞(BMSCs)的成骨分化潜能的稀土金属[67]。Marycz等[48]使用铕(III) (Eu3+)对PLLA/HA 复合材料支架进行功能化。研究发现,由于添加了Eu3+的PLLA/HA 支架促进了骨和关节软骨组织特异性细胞外基质蛋白的合成和分泌,进而促进了BMSCs的成骨和软骨形成。
Li 不仅可以影响钙稳态,提升植入部位的骨矿物质密度,从而显著降低骨折风险,而且能促进成骨基因的表达,在骨发育、体内平衡、成骨细胞分化和骨形成中发挥重要作用[68]。Wang 等[69]将Li 引入了3D 打印PLA/HA 复合材料支架,将其用于比格犬异位和兔股骨原位成骨研究。结果表明,添加了1wt%Li 的支架具有优异的成骨和血管生成性能,可诱导异位成骨和原位成骨。
镧(La)在治疗和预防骨病,尤其是骨质疏松症和代谢紊乱方面具有巨大的潜力。然而,La3+离子难以在体内的持续稳定释放。Xu 等[70]通过共沉淀法制备了 La-OCP 粉末,并制备了 La-磷酸八钙(OCP)/PLA 多孔支架。实验结果表明,支架具有均匀的结构和粗糙的微表面形貌,适宜BMSCs 细胞黏附、生长和增殖。在一定的 La3+浓度下,La-OCP/PLA 支架提取物能增加成骨相关基因的表达,从而促进 BMSCs 的成骨分化,调节骨折部位的免疫反应。
Huang 等[71]使用低温沉积制造(LDM)技术将Fe2O3引入了PLGA/I 型胶原蛋白(Col-I)/n-HA 支架,并在此基础上制备了双相磁性纳米复合材料支架(PLGA/Col-I-PLGA/n-HA/Fe2O3)。支架软骨层孔径为186 μm,孔隙率为89.5%;骨层孔径和孔隙率分别为394 μm 和86.1%。体外测试表明,双相磁性纳米复合支架BMSCs 共培养表现出良好增殖能力,并发现该支架能够促进分化导向细胞的分化。
增强骨髓(eBM)是由同种骨骨腔在扩孔过程中产生的碎屑,由于含有大量干细胞,因此具有良好的成骨活性[72]。Liu 等[73]研究了eBM 与3D打印PLA/HA 支架在修复兔模型临界尺寸骨缺损中的作用。8 周时,显微计算机断层扫描(μCT)分析显示PLA-HA/eBM 组骨体积和骨体积/组织体积(BV/TV) 显著高于PLA-HA 组和对照组。苏木精和伊红染色显示,PLA-HA/eBM 组新生骨面积显著高于PLA-HA 组和对照组。
牙髓干细胞(DPSCs) 具有高度的增殖和产生细骨颗粒的功效,因此是转化医学和骨组织再生的最佳候选材料之一[74]。Gendviliene 等[75]使用DPSCs 对3D 打印PLA/HA 支架进行细胞化,通过μCT 和组织学观察对缺损评估研究了支架在大鼠颅骨缺损模型中的治疗效果进行了评估。μCT结果显示,PLA/HA-DPSCs 支架组的骨体积比对照组大1.495 mm3,与商业化的骨植入物相当。
尿源性干细胞(USCs)是一种多功能成体干细胞,其生物学特性与间充质基质细胞(MSCs)相似[76]。与其他干细胞相比,USCs 具有分化为骨软骨和脂肪组织的潜力,且更易获得,因此具有很高的实用性[77]。Zhang 等[15]将USCs 接种于3D 打印PLA/HA 支架的表面,研究了其在大鼠颅骨缺损模型中的治疗效果。结果表明,负载USCs 的PLA/HA 支架可以有效促进缺损区域的新骨再生。μCT 图像显示PLA/HA 组中缺损区域几乎完全被新形成的骨覆盖(96.7%±1.6%),12 周时的覆盖率高于纯PLA 组(74.6%±1.9%)。组织学和免疫组化染色显示,12 周时缺损部位含USCs 的PLA/HA支架的新骨形成量最高。
Liao 等[78]将猪脂肪源性干细胞(pASCs) 植于涂覆有I 型胶原蛋白(COl-I) 的β-TCP-PCL 支架,并测试其成骨潜力。结果表明,支架孔隙率约为75%~77%,孔径约为 300~500 µm;在 PCL-TCP 支架上涂覆 I 型胶原后,亲水性和支架膨胀率上升。体外研究表明,pASCs 在 PCL-TCP-COl-I 组支架上的成骨分化效果最好,由于其碱性磷酸酶(ALP)活性、骨钙素 mRNA 表达和矿化度最高。裸鼠实验表明,PCL-TCP-COl-I 组比 PCL 组有更好的骨组织和血管组织形成。
PRP 在牙周再生治疗中具有促进受损组织愈合、治疗软骨和骨缺损的能力,并可能刺激BMSCs 的增殖和分化[45]。Bahraminasab 等[41]将PRP 涂覆在3D 打印PLA/G-nHA 支架上以增强成骨。PLA/G-nHA/PRP 不仅具有较好骨矿化性,而且较纯PLA 和PLA/G-nHA 支架更能促进骨再生。
Zheng 等[79]将成骨促进药物HA15 掺入了PLGA/β-TCP 骨组织工程支架。体外试验结果表明,负载了 HA15 的支架能在体外促进细胞分化成成骨细胞。兔桡骨缺损试验表明,缺损部位的骨骼及外周血管都有明显再生。
Zhao 等[21]提出了一种共培养生物打印策略,并设计了一种组织工程骨-骨膜双相复合物。以PLLA/HA 构建骨组织工程支架,采用明胶甲基丙烯酸酯(GelMA) 模拟骨、骨膜细胞外基质,BMSCs 模拟细胞组分,在骨和骨膜之间形成共培养层。通过调整PLLA/HA 的材料配比和GelMA的交联时间,构建出具有良好机械强度和细胞活性的复合物,并将其植入兔颅骨缺损区。影像学和组织学定量结果显示,骨-骨膜双相复合物组的修复效果明显优于对照组,表明骨-骨膜双相复合支架有利于骨修复和再生。
电磁场(EMF)疗法是一种安全、无创的治疗骨缺损疾病的方法[80]。Tu 等[81]制备了负载 BMSCs的PLLA/HA 支架,研究了电磁场对BMSCs 增殖和成骨分化能力的影响。结果表明,EMF 能增强支架上培养的BMSCs 的增殖和成骨分化能力。体内测试表明,与PLLA 支架相比,经过EMF 处理后的PLLA/HA/BMSCs 支架观察到明显更高的新骨形成和血管形成。
Zhang 等[82]受骨骼的血管化启发,利用体内生物反应器(IVB)策略和3D 打印技术制备了具有复杂结构的骨组织工程支架,并建立了兔血管化组织工程骨预制模型。IVB 是以植入体内的支架为基础,让新生骨组织以预定义的几何形状生长,进而形成具有较大规模的血管化骨组织[83]。4 周和8 周后,通过研究相关基因、μCT 和组间组织学检查分析了新生血管和骨组织。结果表明,该方法能够在体内生成带血管的组织工程骨。
表7 与表8 分别总结了部分研究者制备骨组织工程支架的性能参数与体内测试的方案及成果[28, 70, 75, 81-82, 84-91]。

表7 文献报道的生物可降解聚酯/生物陶瓷骨组织工程支架性能参数Table 7 Performance parameters of biodegradable polyester/bioceramic bone tissue engineering scaffolds prepared reported in the literatures

表8 文献报道的生物可降解聚酯/生物陶瓷骨组织工程支架的体内测试方案Table 8 In vivo testing protocols for biodegradable polyester/bioceramic bone tissue engineering scaffolds reported in the literatures
3.3 其他性能
3.3.1 抗菌性能
开放性的骨缺损治疗过程可能由于创口较深、难以清理等问题,面临感染风险。具备一定抗菌能力的骨修复支架能降低疗程中并发感染发生的概率,进而减小骨缺损治疗风险。
米诺环素(MH) 是一种半合成的四环素,具有广泛的抗菌谱,通过抑制细菌蛋白合成,进一步发挥抗炎症、抗氧化和抗凋亡作用[92-93]。Martin等[46]通过胶原蛋白(Col)、MH 对PLA/柠檬酸-羟基磷灰石(cHA) 3D 打印支架进行功能化改性以减少细菌生物膜的形成(图8(a))。研究表明,PLACol-MH 和PLA-Col-MH-cHA 有效抑制了细菌生长,其抑菌圈的直径约为26 mm,而米诺环素的空白样品(PLA-Col)未观察到抑菌圈。
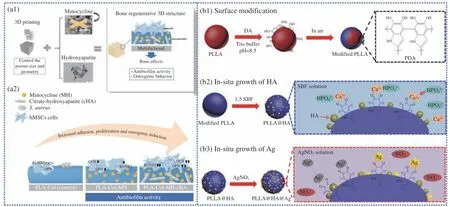
图8 (a1) PLA-胶原蛋白(Col)-米诺环素(MH)-柠檬酸-羟基磷灰石(cHA)支架的制备流程[46];(a2) PLA-Col、PLA-Col-MH、PLA-Col-MH-cHA 支架表面形态[46];((b1)~(b3)) PLLA@HA@Ag 颗粒的制备[47]Fig.8 (a1) Preparation process of PLA-collagen (Col)-minocycline (MH)-citrate-hydroxyapatite (cHA) scaffolds[46]; (a2) Surface morphology of PLA-Col,PLA-Col-MH, and PLA-Col-MH-cHA scaffolds[46]; ((b1)-(b3)) Preparation of PLLA@HA@Ag particles[47]
Li 等[94]将3D 打印技术与化学沉淀法相结合,制备了掺有地塞米松(Dex)的PLA/聚乙二醇(PEG)/n-HA 骨组织工程支架。细胞抗炎实验证明,支架释放的Dex 能成功抑制脂多糖诱导的M1 巨噬细胞分泌白细胞介素-6 和诱导型一氧化氮合酶,展现出了良好的抗菌性能。
纳米银(Ag)颗粒可与细菌膜蛋白上的巯基相互作用,改变膜的通透性,进而破坏细菌完整性,因此具有优良的抗菌性能[95]。Yang 等[47]将通过溶液原位生长法将纳米银颗粒引入PLLA/HA 复合材料,再使用SLS 技术制备了骨组织工程支架(图8(b1)~8(b3))。结果表明,PLLA 支架周围无抑菌圈,而PLLA@HA@Ag 支架周围抑菌圈明显更大,这表明前者具有较强的抗菌活性。浊度分析试验表明,PLLA 支架培养物的浊度与对照组相似,而 PLLA@HA@Ag 支架孵育的培养基变得透明,显示出PLLA@HA@Ag 支架组细菌的生长受到了强烈的抑制。PLLA@HA@Ag 支架的抑菌率超过92.5%,而PLLA 支架几乎没有抑菌活性。
3.3.2 抗肿瘤性能
二甲双胍(MET)是一种具有抗肿瘤性能的药物,由于其能协同促进骨组织再生,有助于治疗肿瘤性骨缺损[24,96]。Tan 等[97]将MET 引入了PLLA/HA 复合支架。支架通过上调凋亡相关基因表达诱导骨肉瘤(OS)细胞凋亡,在体外表现出了良好的肿瘤抑制特性。此外,由于随着PLLA 的降解,包裹于支架中的MET 颗粒被缓慢释放到体液中,该支架具有较长的药物释放时间。
3.3.3 生物成像性能
利用生物成像功能能够有效追踪患者骨重建进程。Eu 具有能在μCT 监测和磁共振(MR)技术下发出荧光的能力,常被应用于生物成像[98]。Marycz等[48]使用Eu3+修饰的HA 与PLLA 复合制备骨组织工程支架。随着支架上的HA 转化为新生骨,HA上修饰的Eu3+使新生骨具备荧光能力,从而能监测体内的骨组织再生过程或跟踪细胞的传代。
4 总结与展望
随着我国社会人口老龄化现象的不断加剧,生物可降解骨组织工程支架在骨修复中的应用将逐步推广。3D 打印制备的生物可降解聚酯/生物陶瓷支架不仅具有生物可降解性、成骨活性的同时,而且能够根据植入部位灵活调整形态并精确打印,在骨修复工程领域展现出了良好的发展前景。
然而,目前生物可降解聚酯/生物陶瓷骨组织工程支架研究仍主要停留在体外测试阶段,体内测试的案例较少,且仍需进一步改进来满足临床应用的要求。3D 打印生物可降解聚酯/生物陶瓷骨修复支架今后研究的改进方向如下:(1) 通过在支架表面加载成骨活性因子,赋予支架更高的成骨活性,缩短骨修复周期;(2) 设计新颖的支架形态,满足不同的骨植入环境的需要;(3) 探索更高效的3D 打印方式,缩短植入前准备时间;(4) 骨组织工程在植入体内前,需要经过紫外线等手段进行杀菌处理,而这可能会影响附着于支架表面干细胞的成骨活性,这也是今后研究中需要关注的内容。
