采空区碳封存条件下CO2-水界面特性及溶解传质规律
2024-04-25李树刚张静非林海飞包若羽周雨璇
李树刚 , 张静非 , 林海飞 , 包若羽 , 丁 洋 , 白 杨 , 周雨璇 , 朱 冰
(1.西安科技大学 安全科学与工程学院, 陕西 西安 710054;2.西安科技大学 西部矿井开采及灾害防治教育部重点试验室, 陕西 西安 710054;3.煤炭行业西部矿井瓦斯智能抽采工程研究中心, 陕西 西安 710054;4.应急管理部信息研究院, 北京 100029)
碳排放导致的全球气候变暖问题日益显著,加快了能源行业低碳化结构调整的进程[1-3]。CO2排放作为温室效应加剧的主要源头,与煤炭等化石能源使用密切相关[4-5]。“双碳”战略目标的推行要求在煤炭绿色低碳发展的基础上,应同时积极探索碳捕集、封存和利用(CCUS)技术,最大限度实现CO2的捕捉封存、回收循环及资源化利用[6-8]。对煤矿而言,CO2封存目标地质体主要为深部不可采煤层,而采空区作为非常规潜在封存地质体前景同样不容小觑[9-10]。采空区CO2封存作为解决煤炭行业碳排放难题的重要负碳技术储备,在采空区废弃资源二次利用、碳减排等方面具有广泛的应用价值[11-13]。
CO2在采空区碳封存的主要形式包括物理封存(构造封存、残余气封存)与化学封存(溶解封存、矿化封存)[14-15]。就安全性而言,化学封存尤其是矿化封存被认为是安全性最高的封存方式。其中,CO2的扩散溶解传质是化学封存发生的首要条件[16-17]。采空区上部覆岩与侧向封闭墙(煤柱+注浆封堵墙)形成封存空间,注入的游离态CO2会扩散溶解形成CO2-水体系[18-19],打破地层的地球化学平衡,经历CO2(g)→CO2(aq)→ H CO-3→C O23-的一系列动态化学转化过程[20-21]。溶解度和反应程度受气液界面张力、环境温压、地层水离子质量分数等因素影响。
CO2充注进入采空区后的扩散传质效率受到气液界面张力较大影响。CHOW 等[22]通过实验,在298~488 K 和0~50 MPa 条件下测量了(N2+CO2)+H2O 的界面张力(Interfacial Tension,以下简称为IFT),并改进了经验系数;美合日阿依·穆太力普等[23-24]重点对封存地层温度、压力条件下的CO2-咸水/油相间IFT、岩石接触角(CA)、CO2溶解度及溶解CO2的咸水pH、CO2-油混相压力等相界面特性进行了实验和数值分析;邸梦瑶等[25]开展了深部咸水层环境下CO2-水界面张力模型计算研究,并指出了界面张力测定对CO2安全封存的应用价值。CO2在地层水中的溶解度直接影响化学封存效率,研究点主要包括多尺度实验室研究及溶解度模型重构等[26]。实验研究方面,龙震宇等[27]利用高温高压反应釜等设备,测量不同温度、压力、矿化度下CO2在水中的溶解度,明确了CO2在水中的溶解规律;马丽丽等[28]通过恒温水浴振荡器使静态溶解平衡的CO2-水体系中的流体产生回旋运动,以此研究流体的流速对CO2-水体系静态溶解平衡的影响;溶解度模型研究方面,几乎所有的建模原理都是从热力学基本原理出发[29],DUAN 等[30-31]建立了预测CO2在纯水和NaCl 水溶液中溶解度的模型;MAO 以及LI 等[32-33]均采用基于Pitzer 电解质理论的活度系数和Peng-Robinson 状态方程的方法建立了CO2在不同条件下的溶解度热力学模型。
虽然前期探索CO2地下封存技术的方式较多,但多是基于CO2的超临界态处理,对采空区储层环境下气态CO2气液界面扩散-溶解机理的探索有待进一步分析。笔者利用原位界面张力测定仪开展了不同温压、地层水矿化度及阳离子溶液种类对CO2-地层水系统的IFT影响规律实验,明晰了CO2注入含水碎胀煤岩体中的气液界面扩散效应,并将基于统计缔合理论结合兰纳-琼斯势能模型的状态方程(SAFT-LJ 状态方程)与密度梯度理论(DGT)结合预测了IFT理论值;其次利用自主研发的地质封存地化反应模拟实验平台对相同条件下的CO2溶解性进行了探究实验,得到了采空区储层环境下CO2溶解度变化特征,采用DS 模型计算了对应CO2溶解度理论值,进一步阐明了CO2-地层水界面效应与溶解传质的耦合关系,以期为采空区CO2安全高效封存提供理论依据。
1 实验流程及设备
1.1 地质背景
本次实验以黄陵矿区某矿采空区为研究对象,该矿区位于鄂尔多斯盆地南缘,主要含煤地层为侏罗系中统延安组,目标区储层埋深628~632 m,实测研究采空区温度处于24~38 ℃,采空区积水的水化学类型以SO4·Cl—Na、Cl·SO4—Na 为主。
1.2 实验系统
(1)界面张力测定系统。CO2-地层水系统界面张力测定采用自主研发的原位界面张力测定仪,如图1(b)②所示。
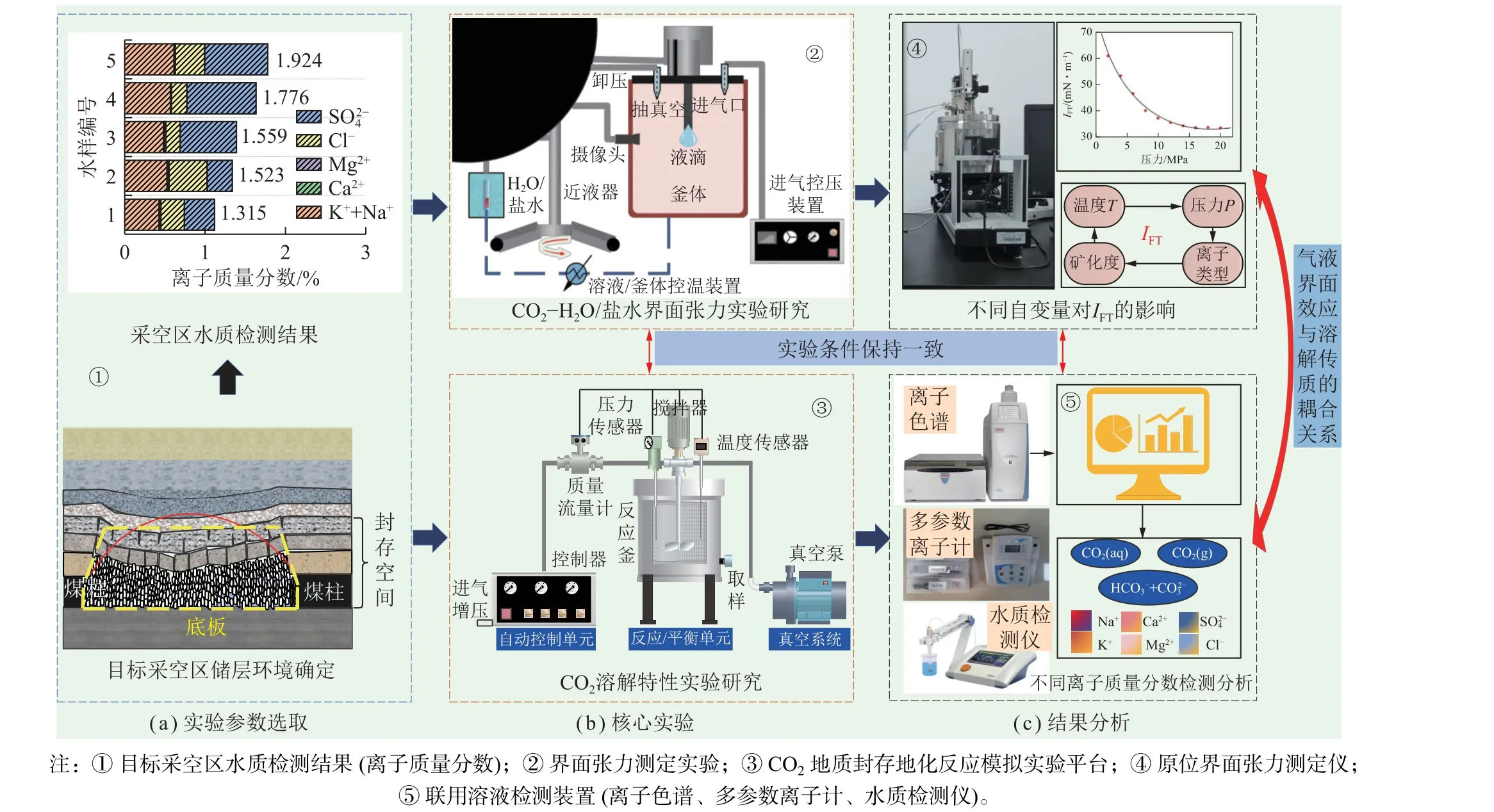
图1 整体研究思路、实验设备及流程Fig.1 Overall research ideas, experimental equipment and flow chart
设备主要包括密闭釜体、进气控压装置、溶液/釜体控温装置、进液装置、高分辨率摄像头以及抽真空装置等。可实现CO2气氛环境中不同温度(25~60 ℃)、压力(0~6 MPa)条件的参数测定。
1.3 实验流程
(1)根据目标采空区储层环境确定实验参数,并采集现场水样进行水质检测(图1(a)①),具体选取依据如1.4 部分(关键实验参数选取)所示。
(2)利用自主研发的原位界面张力测定仪进行不同模拟储层环境下,CO2-水界面张力变化规律实验研究。首先进行实验系统的气密性测试,以保证实验设备的可靠稳定性,并开展不同温度(25~45 ℃)、压力(0.5~2.5 MPa)、矿化度(0.5%~2.5%)、离子溶液类型(NaCl、MgCl2、KCl、CaCl2)条件下,自变量对IFT变化影响规律实验。
(3)利用CO2地质封存地化反应模拟实验平台进行不同模拟储层环境下,CO2溶解特性变化规律探究实验。首先进行实验系统的气密性测试,以保证实验设备的可靠稳定性,并开展不同温度(25~45 ℃)、压力(0.5~2.5 MPa)、矿化度(0~2.5%)、离子溶液类型(NaCl、MgCl2、KCl、CaCl2)条件下,自变量对溶液离子变化及溶解度影响规律实验。搅拌转速设定200 r/min,模拟动态条件下的平衡状态。实验平台外接PXS-CO2型多参数离子计与离子色谱,对反应液中的离子进行测定(图1(c)⑤)。
(4)IFT可由原位界面张力测定仪直接测得,CO2溶解度采用平衡取样测试法计算[23]。
1.4 实验方案及参数确定
本实验的目的是开展CO2注入采空区后气液间扩散-溶解的复杂物理化学过程,着重开展探究温度、压力、矿化度以及不同阳离子对CO2-水界面张力及CO2溶解性的影响规律。根据目前已开展的调研探究结果,综合确定实验模拟环境温度T、环境压力P、矿化度Kt、离子溶液类型,采用控制变量法设计实验方案,见表1。纯水条件下仅改变单一变量(温度或压力),共25 组实验;NaCl 溶液条件下,设置温度梯度2组(25、45 ℃),分别改变单一变量(矿化度或压力),共50 组;不同离子溶液类型条件下,固定矿化度1.5%,设置温度梯度2 组(25、45 ℃),分别改变单一变量(溶液类型或压力),共40 组。

表1 实验研究方案设计Table 1 Experimental research scheme design
关键实验参数选取依据如下:
(1)温度压力确定。实测研究采空区温度处于24~38 ℃,平均31℃,为了便于考察不同温度梯度对实验的影响,选用25、30、35、40、45 ℃五组温度作为实验参数,包含了实测数据范围并进行了扩展;目标储层埋深628~632 m,平均压力梯度0.70 MPa/hm,估算储层压力4.4 MPa,考虑采空区欠压实状态及应力重新分布等影响,设定实验压力梯度为0.5、1.0、1.5、2.0、2.5 MPa。
(2)离子溶液类型及质量分数确定。通过采集目标采空区水样,进行水质检测得到了水样离子类型及浓度参数(图2①),主要离子类型包括K+、Na+、Ca2+、Mg2+、Cl-等,矿化度为1.315%~1.924%。由于阳离子对水分子的吸引力强于阴离子,且离子溶液对气液界面张力的影响主要是由于阳离子价态的影响,相同条件下,阳离子对气液间IFT增加的贡献率排序为:NH4+< K+< Na+< Li+< Ca2+< Mg2+,这在其他学者研究成果中也得到了验证;而CO2在离子溶液中的溶解度影响主要也是阳离子价态。因此笔者仅以阳离子价态为变量进行实验探究,设定实验用离子溶液类型分别为NaCl、MgCl2、KCl、CaCl2,矿化度梯度0.5%、1.0%、1.5%、2.0%、2.5%。
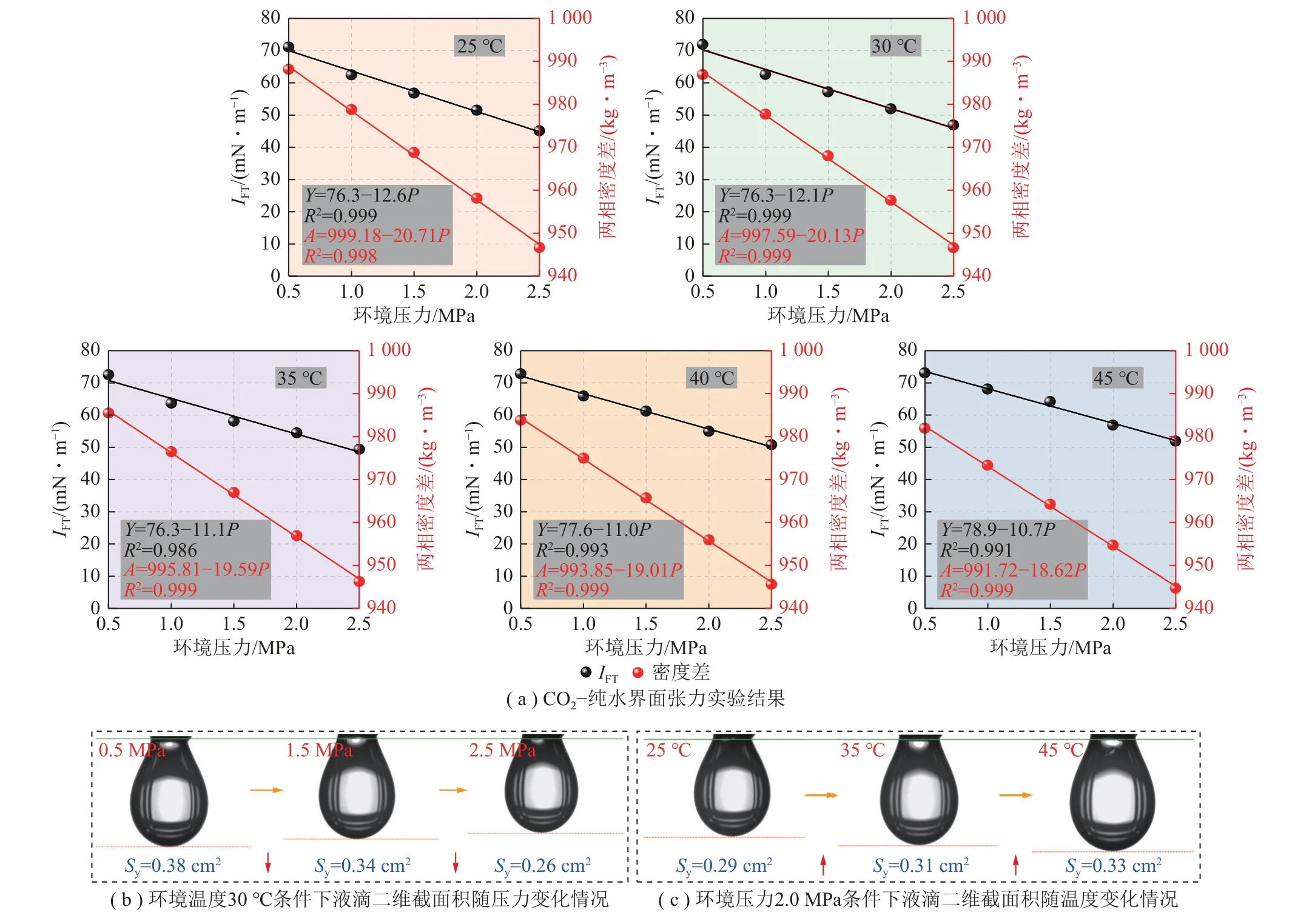
图2 不同温度、压力条件下CO2-纯水界面张力变化情况Fig.2 Change of interfacial tension of CO2-pure water under different temperature and pressure
2 结果与讨论
2.1 不同环境因素对CO2-水界面张力的影响规律
2.1.1 温压条件对界面张力的影响
本部分开展了不同温度(25、30、35、40、45 ℃)、不同环境压力(0.5、1.0、1.5、2.0、2.5 MPa)条件下CO2-纯水界面张力探究实验。图2(a)为CO2-纯水界面张力实验结果,图2(b)、(c)分别为环境压力0.5 MPa 下液滴二维截面积随温度变化情况及环境温度30 ℃时液滴二维截面积随压力变化情况。
根据图2(a)实验结果可知,采空区碳封存条件下,CO2与水的两相密度差Δρ与环境压力具备负相关性,同时IFT整体上随着压力增大显著减小。当温度为25 ℃、纯水条件下,压力由0.5 MPa 增至2.5 MPa,IFT由71.1 mN/m 降低至45.1 mN/m;当温度为30 ℃、压力由0.5 MPa 变化至1.0 MPa 时,其最大IFT绝对变化量(|ΔIFT|)达到9.3 mN/m(图3)。在CO2-水实验体系中,环境压力升高时,CO2分子的分压也会增加,气态CO2被压缩直接导致其密度ρg的发生显著增大,同时CO2的溶解也会改变纯水密度ρl,但改变幅度较小,因此最终会导致两相密度差Δρ减小(Δρ=ρl-ρg),根据Young-Laplace 方程理论可知,当密度差Δρ减小时,它会导致界面上液体和气体之间的压力差ΔP降低,从而进一步降低界面张力。
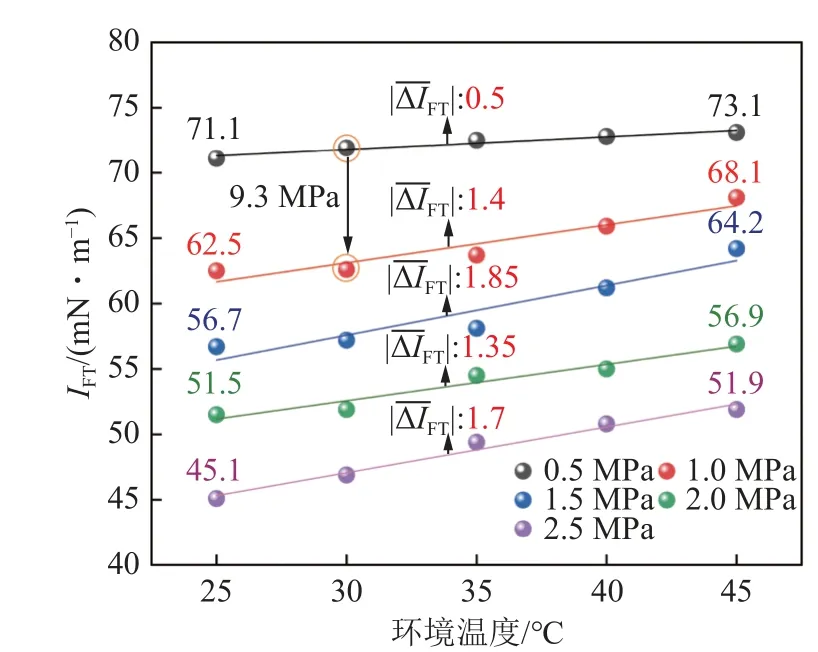
图3 温压效应对IFT 的影响Fig.3 Influence of temperature and pressure on IFT value
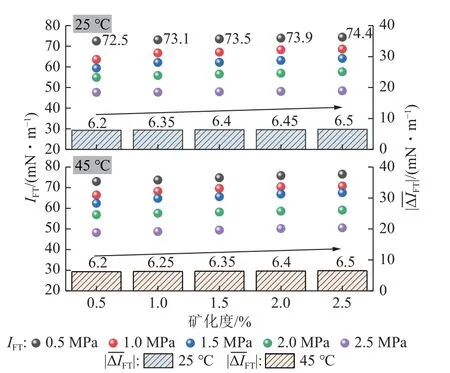
图4 不同矿化度条件下CO2-盐水界面张力变化情况Fig.4 Variation of interfacial tension of CO2-brine under different salinity conditions
由图2(b)可得,温度一定时,压力越高,IFT逐渐减小,液滴整体形态逐渐变小。采用MATLAB 软件通过对液滴形态照片进行二值化处理,计算了其液滴二维截面积(Sy)的数据变化情况,随着压力由0.5 MPa 升高至2.5 MPa,对应Sy变化为:0.38 cm2→0.34 cm2→ 0.26 cm2,数值逐渐减小。这点可从热力学原理出发,用Gibbs 自由能(G)来解释温度和压力对气液界面张力的影响,如式(1)所示:
其中,H为系统的焓;S为系统的熵。从体系能量角度来说,环境压力升高,CO2溶解在液滴内部时,这会导致液滴内部的分子之间相互作用增强,增加了液滴的焓(ΔH增加);而压力升高会减少气体分子的自由度,系统的熵(ΔS)会减小,根据式(1)可以看出,ΔH增加,ΔS减小增加了系统的自由能,使液滴不稳定。为了使系统更趋向平衡,减小的液滴体积和界面表面积有助于减小总自由能,因此随着环境压力升高,液滴会逐渐收缩,降低IFT,以此保证系统稳定[34]。
限于实验条件及参数范围选取差异,温度效应对IFT的影响存在不同结论。CHIQUET 等[35]认为环境压力一定时,温度升高会使气液两相体系的IFT减小,但减小幅度不大。BIKKINA[36]和CHALBAUD[37]则认为,当压力较低时二氧化碳为气态,界面张力会随着温度的升高而增大,而当压力较高时,界面张力值几乎不再随温度的变化而改变。

2.1.2 地层水矿化度及阳离子价态对界面张力的影响

矿化度对CO2-盐水界面张力的影响主要包括密度差Δρ变化以及分子间作用力两方面。首先本实验采用悬滴轮廓法测试界面张力,通过液滴形态测量结果计算界面张力,计算公式为
其中,η为液滴形状参数。矿化度升高,导致气液两相密度差Δρ增大,从而增加CO2-盐水界面张力。
从分子间作用力方面分析,CO2-盐水界面张力与体系中每个组分的贡献相关,如图5 所示,液滴在CO2气氛下形成后,分子间作用力会促使水分子会在气液界面上有序排列,当提高液相矿化度后(加入NaCl),NaCl 会在水中完全电离(图5(a)),由于Na+和Cl-离子具有相反的电荷,它们可能会形成电荷分层结构,这意味着在界面附近,Cl-离子可能更倾向于靠近液滴表面,而Na+离子更倾向于留在溶液内部。这种电荷分层可以减少电荷之间的排斥作用,导致界面附近的水分子形成更紧密、更有序的结构,增加了表面张力[38](图5(b))。除此之外,外加离子的进入,会对离子-分子相互作用力(Cl-—H2O、Na+—H2O)、离子-离子相互作用力(Cl-—Na+)以及水分子之间的作用产生影响,这些因素共同导致了气液界面张力的增加。

图5 NaCl 对气液界面分子-离子重新分布的影响Fig.5 Effect of NaCl on the molecular-ion redistribution at the gas-liquid interface
由图6 可得,温度、矿化度一定时,环境压力与不同离子溶液类型条件下的IFT具备较好的正相关性,而温度对IFT的正效应较弱。进一步分析可发现,存在一价阳离子的盐溶液(NaCl、KCl)对IFT的影响整体小于存在二价阳离子的盐溶液(CaCl2、MgCl2),当环境温度25 ℃、压力0.5 MPa 时(图5 标记处),NaCl、KCl 溶液条件下的IFT分别为73.4、72.5 mN/m,而CaCl2、MgCl2溶液条件下的IFT分别为75.8、76.1 mN/m,其他情况与此结果一致。

图6 不同离子溶液类型条件下CO2-纯水界面张力变化情况(矿化度统一为1.5%)Fig.6 Change of CO2-brine interfacial tension under different ionic solution types (the salinity is 1.5%)
如图7 所示,为不同类型盐溶液中阳离子价态对IFT值的影响分析。首先可以看出当温度为25 ℃和45 ℃时,不同CO2-盐溶液之间的最大IFT(IFTmax)与最小IFT(IFTmin)均呈现出随着阳离子价态升高而增大的现象,且二价阳离子溶液与CO2的IFT大于一价阳离子溶液,这与图6 表现的规律一致。同时,不同离子溶液与CO2的平均界面张力变化绝对值也存在类似规律。经过实验探究得出,在环境条件一致时,单一阳离子(在相同质量分数条件下)对IFT增加的影响强度排序为:K+< Na+< Ca2+< Mg2+。

图7 阳离子类型及价态对IFT 的影响Fig.7 Effect of cation type and valence on IFT
根据前述内容可知,盐溶液引起的界面张力增加是由于排斥了结构形成离子(阳离子),而破坏结构的阴离子一般聚集在界面上,并在其周围产生离子强度梯度,促进水分子对水相主体的吸引,这最终导致了界面面积的扩大和界面张力的增加(图5)。
二价阳离子具有比一价阳离子更高的电荷,其构型能力更强,这意味着它们在液体中能够引入更多的电荷,在液体-气体界面附近,这些额外的电荷会导致更强的静电相互作用力。针对二价阳离子来说,Mg2+的半径大于Ca2+,电荷密度更高,Mg2+在气液界面上的排布可能更加紧密,从而对界面性质产生更显著的影响[39]。但相关学者经过实验得出,在给定的物质的量浓度下,对于含有二价阳离子的溶液,界面张力的平均变化至少是含有一价阳离子的溶液(NaCl)的2 倍[40]。这在本研究中并未得到显著体现,这是因为采空区碳封存的环境条件跨度较小,对比大跨度的实验结果存在一定局限,但总体规律具有一致性。
2.1.3 气液界面张力预测模型及误差分析
前述部分开展了CO2-水界面张力探究实验,但众多学者所采用的实验设备、实验条件等不尽相同,所得出的结果也存在差异,因此本研究除了开展相关实验之外,还通过构建气液界面张力预测模型计算了理论值,以便更好验证本次实验的准确性。
根据相关学者研究发现,CO2-水界面张力存在的实质是两相密度差Δρ所引起,因此大部分理论模型都是基于密度函数所得,如密度梯度理论(DGT)和密度泛函理论(DFT)等[41]。本研究将文献[30]改进后的SAFT-LJ 方程与DGT 理论结合,对CO2-H2O/盐水界面张力进行建模研究,该状态方程除分子间缔合力外还考虑了排斥力、色散力、氢键力、多极相互作用力和离子间相互作用力对体系亥姆霍兹自由能的贡献。基于密度梯度理论得到的界面张力IFT计算模型[42]为

SAFT-LJ 状态方程利用Lennard-Jones 势能模型模拟短程作用力及多极作用力(偶极分子和四极分子之间)对体系亥姆霍兹自由能αres的贡献,如式(4)[43]所示
式中,α为体系的总自由能;αideal为理想气体自由能;最右边5 项分别代表以Lennard-Jones 势能模型描述的短程作用、成链作用、缔合作用、多极作用和离子作用贡献的亥姆霍兹自由能。
式(4)中 ΔΩ[ρ1(z),ρ2(z)]时,可采用式(5)计算:

如图8 所示,为纯水及NaCl 溶液条件下,界面张力IFT的预测模型理论值(ml)、实验值(ms)分布及偏差率F分析,当采用DGT 理论结合SAFT-LJ 状态方程预测CO2/NaCl 水溶液界面张力,此处需引入平均球近似理论(MSA),以考虑离子间远程静电力(库仑力)对体系能量的贡献。可以看出,数据分布于45°对角线附近,整体预测精度较高。纯水条件下的实验偏差率F为-2.65%~3.68%,NaCl 溶液条件下的实验偏差率F为-5.08%~7.77%。利用该模型预测气液界面张力考虑模型适用度情况还有待进一步验证。
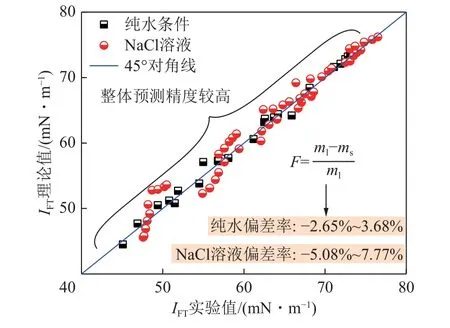
图8 IFT 的预测模型理论值与实验值误差分析Fig.8 Error analysis between the theoretical value and the experimental value of the IFT prediction model
2.2 不同环境因素对CO2 溶解性的影响规律
2.2.1 温压条件对溶解度的影响
本部分开展了不同温度(25、30、35、40、45 ℃)、不同环境压力(0.5、1.0、1.5、2.0、2.5 MPa)下CO2在纯水中的溶解性探究实验。由图9 和表2 可得,随着压力升高,CO2溶解度均呈现上升趋势,而压力一定时,温度与CO2溶解度存在负相关性。
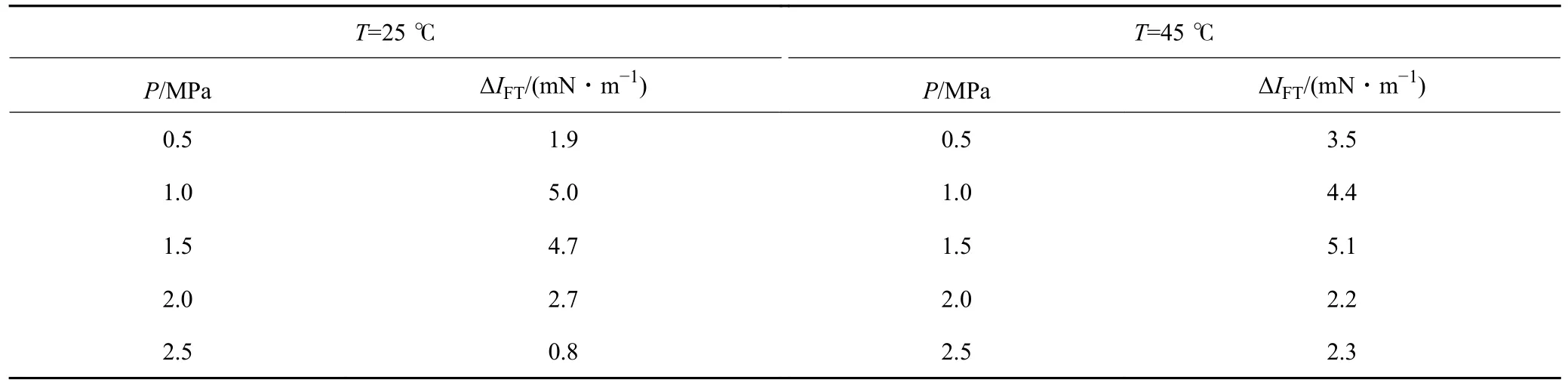
表2 不同温压条件下ΔIFT 数值(矿化度:0.5%→2.5%)Table 2 ΔIFT values under different temperature and pressure conditions (salinity: 0.5%→2.5%)
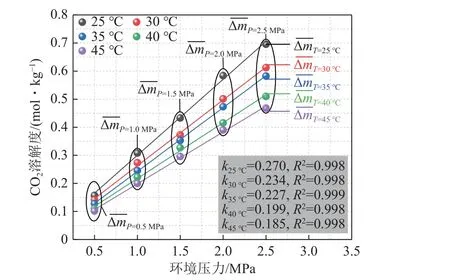
图9 温压条件对CO2 溶解度的影响(纯水)Fig.9 Effect of temperature and pressure conditions on CO2 solubility (pure water)
不同温度梯度下,CO2溶解度随压力变化数据拟合斜率k分布于0.185~0.270,压力变化引起的溶解度平均变化量 ΔmT分布于0.091 6~0.134 5 mol/kg,由此可以看出,温度升高会减弱压力效应对CO2溶解度的改变。压力一定时,温度变化引起的溶解度平均变化量 ΔmP处于0.014 0~0.056 8 mol/kg,压力升高会加剧温度效应对CO2溶解度的改变,见表3。
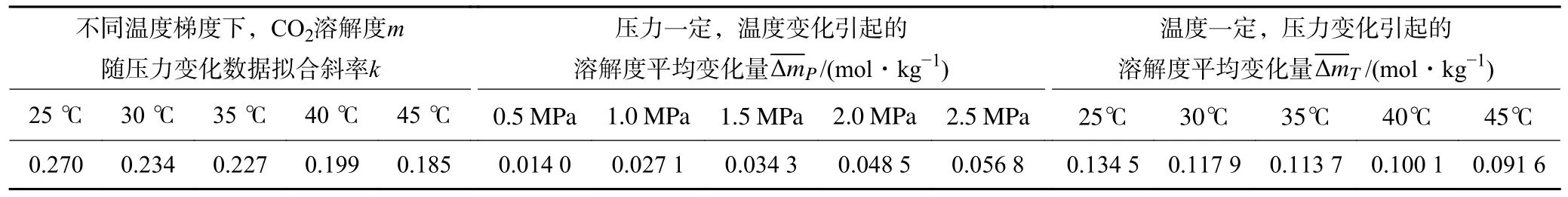
表3 温压效应与CO2 溶解度变化关系分析Table 3 Analysis of the relationship between temperature-pressure effect and CO2 solubility
压力对CO2溶解度的影响可根据Henry 定律来解释。根据亨利定律[44],溶解度与气体分压之间存在线性关系,即溶解度m与P成正比。数学上可以表示为
其中,KH为亨利常数,是与特定气体和液体组合有关的常数,每种气体在每种液体中都有自己的亨利常数,它与温度相关。温度一定时,当压力升高时,这会导致气体更多地溶解到液体中。而从化学平衡的角度来看,当外部条件发生变化时,系统会倾向于通过相应的反应来减轻这种变化。在这种情况下,增加压力会导致气液界面上的CO2从气相向液相移动,以减少对压力变化的响应反馈。
当环境压力(即CO2分压P)一定时,随着温度升高,亨利常数KH通常会减小,这是因为在高温下,液体分子的热运动增加,液体分子更容易逸出液体表面,导致气体分子离开液体,因此溶解度降低。
2.2.2 地层水矿化度及阳离子价态对溶解度的影响
该部分开展了不同矿化度(0.5%、1.0%、1.5%、2.0%、2.5%)及不同离子溶液类型(NaCl、MgCl2、KCl、CaCl2)对CO2溶解度影响的探究实验,为了便于对比分析,选取2 个温度梯度(25、45 ℃)进行。
如图10 所示,以NaCl 溶液为例,环境温压条件一定时,CO2溶解度随溶液矿化度增大而降低,当温度25 ℃、压力2.5 MPa 时,矿化度由0.5%升高至2.5%,对应溶解度由0.675 1 mol/kg 降低为0.635 3 mol/kg,降幅达5.9%。同样可以看出,温压条件对CO2溶解度的影响与纯水情况一致,温度与溶解度呈负相关性,与压力呈正相关性。
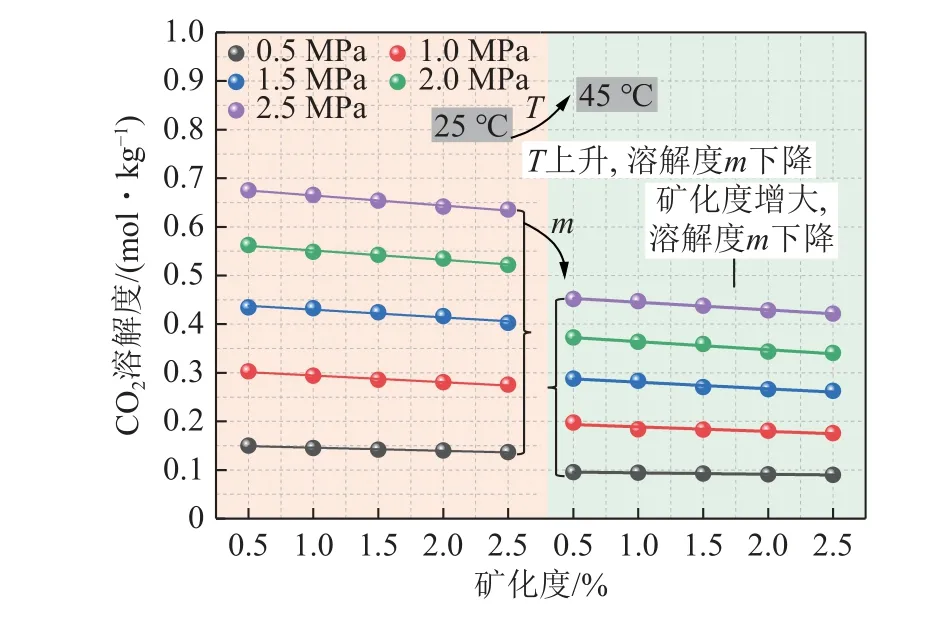
图10 矿化度对CO2 溶解度的影响Fig.10 Effect of salinity on CO2 solubility
矿化度对CO2溶解度的影响主要体现在电解质效应、溶解平衡与碳酸平衡等方面[45]。如图11 所示,Na+和Cl-的存在会增大IFT(2.1.2 节已解释),进一步弱化CO2的气液扩散传质作用;而采空区水中矿化度的增加会造成其电导率变化,导致溶液更加电解质化,影响水分子的极性和氢键形成,进而影响碳酸平衡,促使CO2转为 HCO-3和 CO23-,从而影响CO2的溶解度[46];同时,矿化度的增加会提高溶液的黏度,限制CO2分子在水中的扩散,导致CO2分子更难以从气相转移到水相。
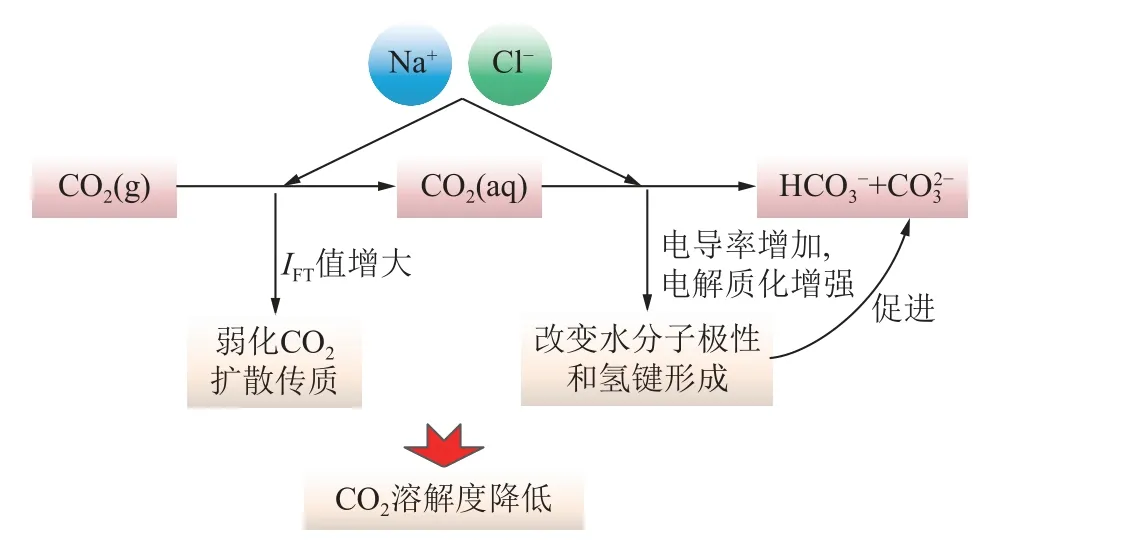
图11 矿化度对CO2 溶解度的影响机制Fig.11 Effect of salinity on CO2 solubility
图12 为不同类型离子溶液对CO2溶解度的影响规律分析。整体而言,CO2在一价阳离子溶液(NaCl、KCl)中的溶解度大于二价阳离子溶液(CaCl2、MgCl2),例如,当环境温度为25 ℃、压力为0.5~2.5 MPa时,CO2在KCl、NaCl 溶液中的溶解度分别为0.152 6~0.664 7、0.143 4~0.653 6 mol/kg,而在CaCl2、MgCl2溶液中的溶解度分别为0.139 7~0.629 0、0.138 2~0.624 5 mol/kg。不同离子溶液对CO2的吸收率排序为:K+> Na+> Ca2+> Mg2+。

图12 离子溶液类型对CO2 溶解度的影响Fig.12 Effect of ionic solution type on CO2 solubility
离子价态对CO2溶解度的影响主要体现在电荷数及离子半径差异方面。首先二价阳离子(Ca2+、Mg2+)所带电荷高于一价阳离子(Na+、K+),当CO2吸附于水表面后,二价阳离子具有2 个正电荷,可以更强烈地与CO2分子中的负电荷部分相互吸引,但也使CO2分子在水中更难溶解;其次,K+和Na+的电荷相同,都是+1 电荷。但钾离子的半径(220 pm)比钠离子(190 pm)大,导致电荷分布较为分散,即电荷密度较低,这使得钾离子与CO2分子之间的电荷相互作用相对较弱,有助于CO2分子更容易溶解在水中。
2.2.3 CO2溶解度预测模型及误差分析
进一步通过理论模型计算理论数值,以便更好验证本次实验的准确性。常用的CO2溶解度计算模型包括D-S 模型、PR-HV 模型、Chang 模型和Furnival 模型等[26]。其中D-S 模型(式(7))适用于温度0~260 ℃、压力0~200 MPa、矿化度0~4 mol/kg 的条件,同时考虑了不同矿物离子对CO2溶解度的影响,因此选用该模型进行理论计算[30-31]:
式中,m(CO2) 为溶解度,mol/kg;y(CO2)为CO2在本体相(气相)中的摩尔分数;φ(CO2)为逸度系数;μ(CO2)l(0)/(RT) 为无因次标准化学势;λ为二级交互系数; ζ为三级交互系数;mi为该离子的矿化度,mol/kg;c和a分别为不同的阳离子和阴离子。
图13 为CO2在纯水以及NaCl 溶液中溶解度的预测模型理论值(ml)、实验值(ms)分布及偏差率F分析,纯水条件下的实验偏差率F为-1.18%~5.64%,NaCl 溶液条件下的实验偏差率F为2.15%~8.35%,总体精度较高。纯水条件下不考虑离子交互影响,简化模型后主要利用液相化学势(μ(CO2)L)与气相化学势(μ(CO2)V)平衡的关系进行预测。
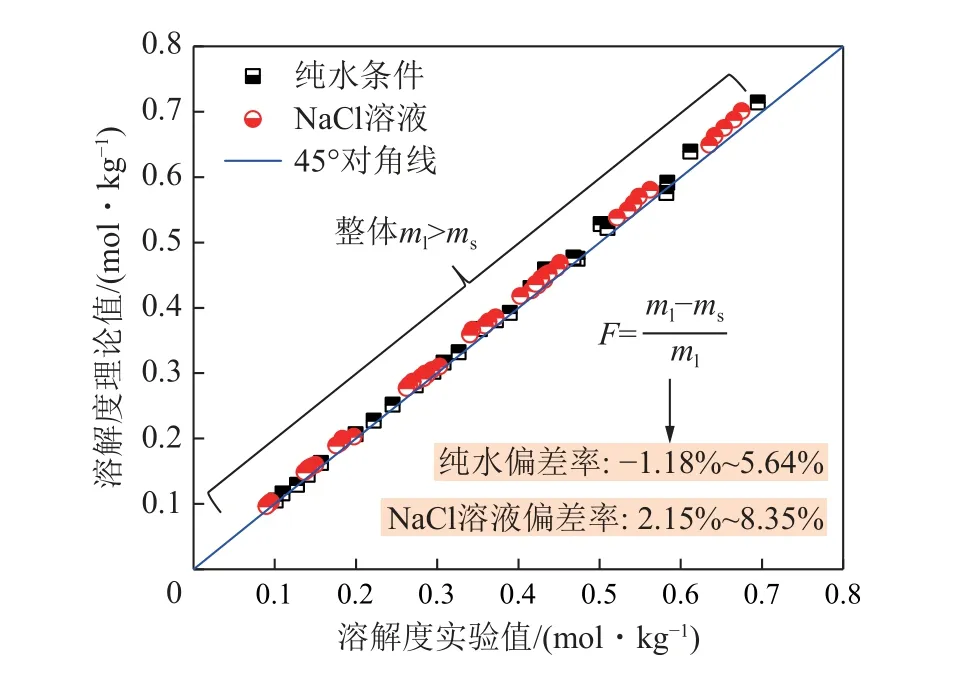
图13 溶解度的预测模型理论值与实验值误差分析Fig.13 Error analysis between the theoretical value and the experimental value of the solubility prediction model
3 CO2-地层水气液界面效应及溶解传质耦合机理
界面张力与溶解度分别为束缚气封存及溶解封存的重要评价参量,对阐明CO2-地层水气液界面效应与其溶解传质效应具有重要意义。首先应当进一步明晰采空区CO2-地层水气液界面效应及溶解传质过程,如图14 所示,当CO2注入采空区后发生的扩散传质-溶解效应是研究束缚气封存及溶解封存的重要基础,气态CO2(CO2(g))克服界面张力通过扩散传质作用进入采空水,转变为溶解态CO2(CO2(aq))后进一步溶解反应生成 HCO-3与 CO23-,此过程的封存效率受到环境温度、环境压力、采空水矿化度、采空水阳离子类型等因素影响。
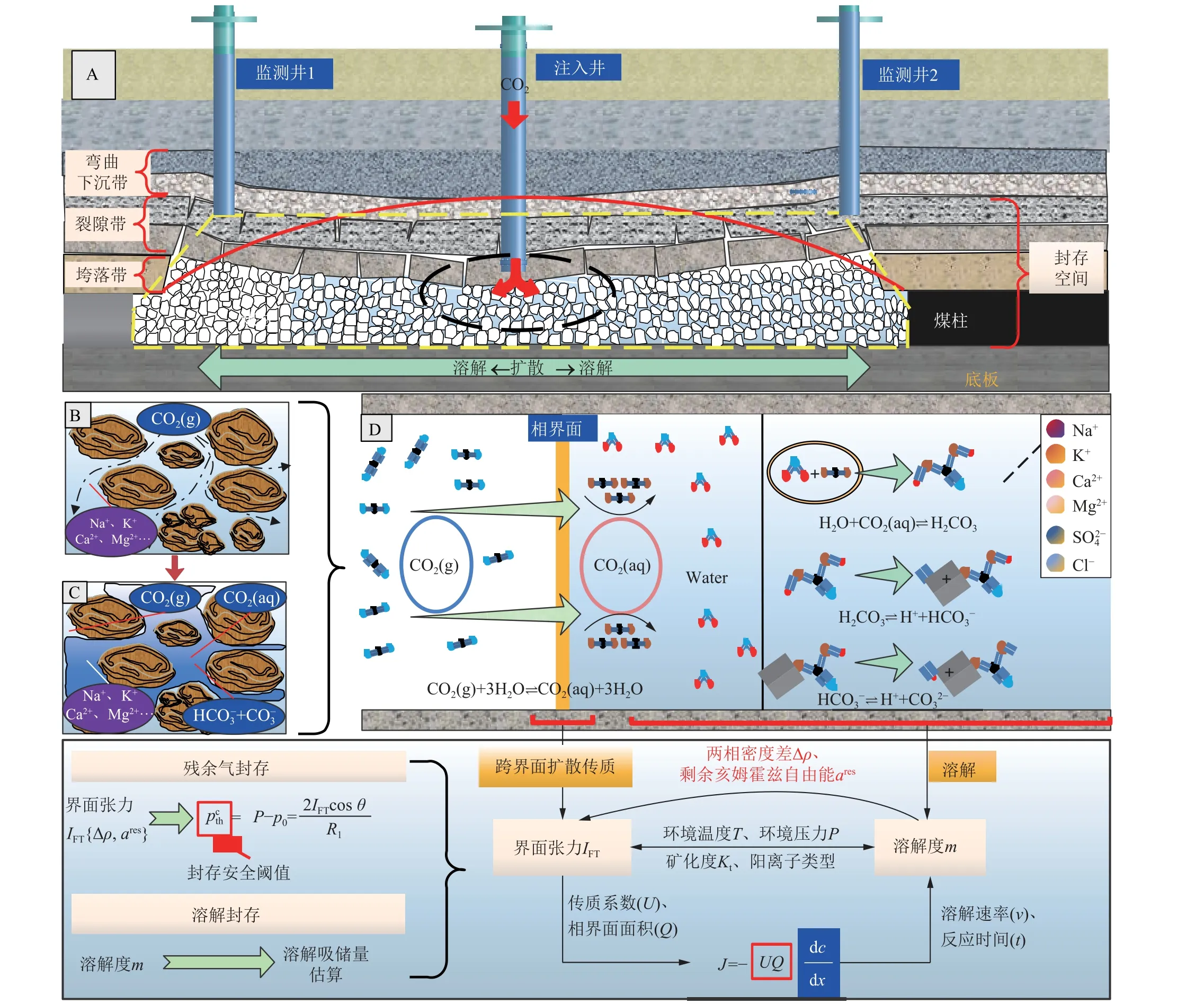
图14 采空区CO2-地层水气液界面效应及溶解传质机理Fig.14 Mechanism of CO2 diffusion-dissolution across the interface in goaf of closed mine
如图15 所示,为不同自变量与CO2-水界面张力、溶解度之间的变化规律。采空区碳封存实验条件下,界面张力与溶解度始终保持负相关关系,压力升高,IFT增大,CO2溶解度降低(图15(a));温度、矿化度以及溶液阳离子价态升高,IFT降低,CO2溶解度增大(图15(b)~(d))。
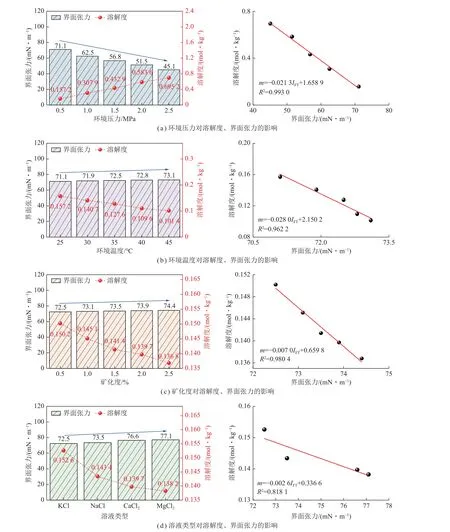
图15 自变量与界面张力-溶解度-溶解度变化规律Fig.15 Independent variables and interfacial tension-solubility change rule
界面张力与溶解度之间的互馈关系可以根据前述2 个参量的预测模型来初步解释。由式(3)~(5)的界面张力预测模型可以发现,界面张力求解的核心是获取热力学平衡条件下界面中2 组分的密度分布,要得到密度分布需要计算CO2-地层水体系的交互作用因子、亥姆霍兹自由能等参量,这些因素与环境温压、矿化度、采空水阳离子类型有关;同样由式(6)、式(7)的预测模型看出,溶解度也受到环境温压、矿化度、采空水阳离子类型的共同作用,通过溶解度的改变控制密度分布,进而影响界面张力,反之亦然。而从物理模型(图14)、自变量与界面张力-溶解度变化规律(图15)可知,界面张力变化会改变气液传质系数与相界面面积,根据菲克第二定律可得出,以上2 项参数会直接作用于气液界面的传质效率(J),进而改变CO2溶解速率、反应时间等,对CO2在采空水中的溶解度产生影响;反过来,CO2溶解度的改变会对气液两相密度差Δρ、剩余亥姆霍兹自由能ares产生影响(短程作用、成链作用、缔合作用、多极作用和离子作用),从而改变界面张力。
进一步可从分子间作用力角度阐述界面张力与溶解度之间的影响机理。界面张力是液体表面上分子间相互作用的结果,界面张力越大,水分子更加紧密地相互排列,形成一个相对难以渗透的屏障,使CO2分子较难进入水中并与水分子相互作用,因此溶解度下降[47]。同时可以看出,环境压力对界面张力及溶解度的影响效应远大于温度、矿化度,当其他环境条件一致时,压力由0.5 MPa 升高至2.5 MPa,对应IFT由71.1 mN/m 降至45.1 mN/m,溶解度由0.157 2 mol/kg升高至0.695 2 mol/kg;而温度由25 ℃升高至45 ℃,对应IFT只由71.1 mN/m 降至73.1 mN/m,溶解度由0.152 6 mol/kg 升高至0.101 4 mol/kg,幅度较小。这种现象除了实验取值跨度较小之外,还由于压力能够直接影响CO2气体分子进入液体的能力,以及液体分子在液体-气体界面上的排列,而温度升高会导致液体分子动能增加,分子间相互作用减弱,从而增加CO2分子进入液体的趋势,但这个影响通常不如压力的影响显著[48];矿化度变化可以影响液体中的离子强度,从而影响溶解度,但对界面张力的影响较小。因此,低温、高压、低矿化度能够更有效强化溶解封存效能,提升采空区碳封存安全性。
从采空区CO2地质封存安全性来说,一旦获得较为准确的CO2-地层水界面张力IFT,可求解封存地质体盖层的毛管压力阈值pcth(封存安全性系数),如式(8)所示[24],为CO2注入参数提供依据。其次,CO2在采空区水中溶解度的大小直接决定化学封存效能,对安全性评估及化学封存强化机理研究奠定基础。
式中,p0为储层流体压力;R1为盖层中最大的孔喉或者裂缝的直径; θ为接触角。
CO2在水中的溶解和扩散影响着CO2从气相向采空区水体的迁移,而CO2与水中溶解的盐类反应则可能导致地质封存岩层的溶解与岩石结构改变,进而影响储存系统的完整性和稳定性。此外,CO2溶解还可能引发地下水的酸化,增加了地层岩石溶解的风险,从而潜在影响地质封存的安全性。因此,在采空区地质封存的安全性评估与实施中,必须深入研究CO2-水界面效应与溶解传质的关系,以充分理解这些过程对封存系统的影响,确保CO2长期稳定储存,最大限度地减少潜在的环境风险。
4 结 论
(1)采空区碳封存条件下,CO2与水之间的IFT整体上随着压力增大显著减小,对应的气液两相密度差与环境压力具备负相关性;随着环境温度由25 ℃升高到45 ℃后,同等压力条件的IFT稍有增加;在温压条件一定时,溶液矿化度与IFT存在正相关性,且在本实验范围内,低压、高温、高矿化度会促使IFT的升高;CO2-盐溶液之间的IFT呈现出随着阳离子价态升高而增大的现象(K+< Na+< Ca2+< Mg2+);将SAFT-LJ 状态方程与DGT 理论结合预测的IFT理论值,整体预测精度较高,纯水条件下的实验偏差率为-2.65%~3.68%,NaCl 溶液条件下的实验偏差率为-5.08%~7.77%。
(2)随着储层环境压力升高,CO2溶解度均呈现上升趋势,而压力一定时,温度与CO2溶解度存在负相关性。环境温压条件一定时,CO2溶解度随溶液矿化度增大而降低,溶解度作为溶解封存量估算的重要参数,低温、高压、低矿化度能够更有效强化溶解封存效能。整体而言,CO2在一价阳离子溶液(NaCl、KCl)中的溶解度大于二价阳离子溶液(CaCl2、MgCl2),不同离子对CO2的吸收率排序为:K+> Na+> Ca2+>Mg2+。采用D-S 模型计算了对应CO2溶解度理论值,纯水条件下的实验偏差率为-1.18%~5.64%,NaCl 溶液条件下的实验偏差率为2.15%~8.35%。(3)从采空区CO2地质封存安全性来说,界面张力与溶解度分别为束缚气封存及溶解封存的重要评价参量。界面张力变化会改变气液传质系数与相界面面积,根据菲克第二定律可得出,以上2 项参数会直接作用于气液界面的传质效率,进而改变CO2溶解速率、反应时间等,对CO2在采空水中的溶解度产生影响;反过来,CO2溶解度的改变会对气液两相密度差、剩余亥姆霍兹自由能产生影响(短程作用、成链作用、缔合作用、多极作用和离子作用),从而改变界面张力,因此,低温、高压、低矿化度能够更有效强化溶解封存效能,提升采空区碳封存安全性。
