早期喉癌术后吞咽障碍的列线图预测模型构建
2024-04-24杨喜科
张 蕊,曲 莉,尹 昕,杨喜科,郑 佳
(南阳市中心医院 耳鼻喉二区,河南 南阳473005)
早期喉癌以手术治疗为主,部分患者术后可发生吞咽障碍[1]。吞咽障碍增加患者痛苦、损害患者心理健康及影响患者经口进食导致患者营养状况变差。部分由舌根麻木造成吞咽障碍的患者,如不及时处理,可增加术后感染、出血、舌体运动受限的风险[2-3]。列线图模型可整合预测变量并进行直观化呈现,对于医疗风险可起到较好的预测作用[4]。本研究通过构建预测早期喉癌术后发生吞咽障碍的列线图模型,以便及时筛查出术后吞咽障碍发生风险高的患者,报道如下。
1 对象与方法
1.1 研究对象
南阳市中心医院2020年3月至2022年5月收治的154例早期喉癌患者,纳入标准:①经纤维喉镜活检证实为喉癌,增强CT影像学检查临床分期 T1N0M0或T2aN0M0;②无手术禁忌指征;③无中枢系统脑病;④术前不存在吞咽障碍;⑤意识无障碍;⑥获得完整的病历资料。排除标准:①既往有颈部开放性手术史;②近3月内有颅脑手术史;③存在严重躯体疾病;④理解能力不正常。本研究经医院伦理委员会审批通过。
1.2 吞咽障碍判定及分组
于术后2周内通过洼田饮水试验(Water swallow test,WST)[5]判定患者有无吞咽障碍。要求患者在端坐的情况下饮用温水30 mL,记录其饮水用时及在此过程中是否发生呛咳。WST分为1~5级,其中5 s内能一次性饮下温水评为1级;分2次饮下,用时超过5 s,期间未发生呛咳评为2级;一次饮下,用时超过5 s,期间发生呛咳评为3级;分2次饮下,用时超过5 s,期间发生呛咳评为4级;10 s内不能饮下,发生多次呛咳评为5级。3级或以上者视为吞咽障碍并纳入病例组,1、2级者纳入对照组。
1.3 资料收集
患者临床资料包括性别、年龄(以是否为老年人进行划分,分成<60岁和≥60岁两个年龄组)、体质指数、学历、家庭人均月收入、生活方式(有无吸烟史、饮酒史)、既往病史(高血压、糖尿病、咽喉反流)、临床分期、肿瘤分化程度、手术方式、张口程度、手术时间、术后1周疼痛程度。每日吸烟1支或以上,且持续6个月以上视为有吸烟史;反流症状指数量表≥13且反流体征评分量表≥7判定为咽喉反流[6];每周饮酒1次或以上,每次饮酒量在30 mL或以上,且持续6个月以上视为有饮酒史;张口程度以卡钳测定,其中上下中切牙间距>20 mm判定为0度,间距15~20 mm判定为1度,10~14 mm判定为2度,<10 mm 判定为3度;疼痛程度采用数字分级法(numerical rating scale,NRS)[7]进行评分,NRS评分范围为0~10分,0分视为无痛,1~3分视为轻度疼痛,4~6 分视为中度疼痛,>6分视为重度疼痛。
1.4 统计学方法
2 结果
2.1 早期喉癌患者术后吞咽障碍的单因素分析
154例患者中,术后2周内发生吞咽障碍49例,发生率为31.82%。病例组年龄≥60岁、有吸烟史、有咽喉反流史、张口受限程度为3度、术后1周疼痛程度为重度的患者比例均显著高于对照组(P<0.05),见表1。

表1 早期喉癌患者术后吞咽障碍的单因素分析
2.2 早期喉癌患者术后发生吞咽障碍的多因素Logistic回归分析
以早期喉癌患者术后是否发生吞咽障碍为因变量,将年龄≥60岁(否=0,是=1)、有吸烟史(否=0,是=1)、有咽喉反流病史、张口受限程度为3度(否=0,是=1)、术后1周疼痛程度为重度(否=0,是=1)等5项具有临床意义的单因素为自变量,开展Logistic回归分析,结果显示,年龄≥60岁、有咽喉反流病史、手术方式为喉裂开术、张口受限程度3度、术后1周疼痛程度为重度是早期喉癌患者术后发生吞咽障碍的危险因素(P<0.05),见表2。

表2 早期喉癌患者术后发生吞咽障碍的多因素Logistic回归分析
2.3 早期喉癌患者术后吞咽障碍的列线图模型构建
将4项确认的危险因素引入R软件,构建预测早期喉癌患者术后吞咽障碍的列线图模型,结果显示,年龄≥60岁者权重分为87.5分;咽喉反流病史者权重分为97.5分;手术方式为常规喉裂开术者权重分为80分;张口受限程度为3度者权重分为100分;术后1周疼痛程度为重度者权重分为82.5分,见图1。
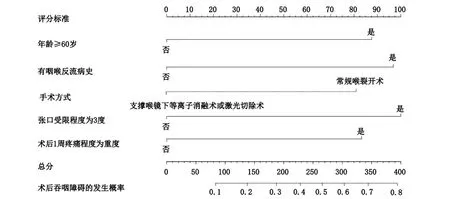
图1 预测早期喉癌患者术后发生吞咽障碍的列线图预测模型构建
2.4 预测早期喉癌患者术后发生吞咽障碍的列线图模型检验
列线图模型预测术后吞咽障碍发生风险的ROC曲线下面积(AUC)为0.759(95%CI=0.674~0.844),见图2。预测概率和实际概率基本一致(见图3),且拟合优度HL检验χ2=10.293,P=0.173,提示列线图模型的区分度和一致性均较好。
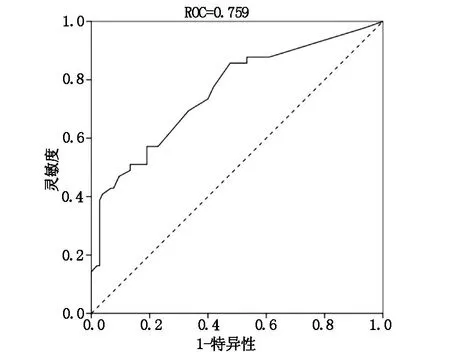
图2 列线图模型预测早期喉癌患者术后发生吞咽障碍的ROC曲线
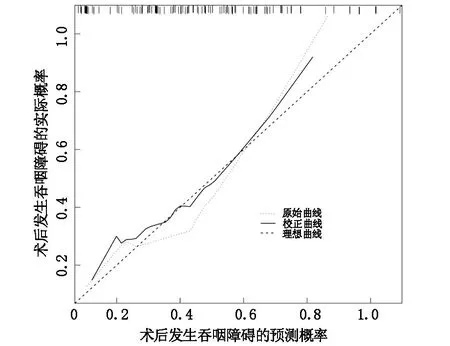
图3 列线图模型预测早期喉癌患者术后发生吞咽障碍的校准曲线
3 讨论
手术为早期喉癌治疗的最有效方式,但术后发现部分患者可发生吞咽障碍,迁延时间长,将影响患者身心及疾病的恢复。本研究154例患者中,术后发生吞咽障碍49例,发生率为31.82%,高于颈前路融合手术[8](16.65%)及心脏手术[9](8.1%)患者术后吞咽障碍发生率。吞咽障碍可限制患者营养摄取,增加肺部感染、术后出血等其他并发症发生的可能性,甚至可提高其死亡风险[10-11]。故及早识别术后吞咽障碍发生的高危患者并施以针对性的事先防控措施具有重要意义。
本研究通过Logistic回归分析确定以下5项影响早期喉癌患者术后吞咽障碍发生的因素:(1)年龄。本研究结果显示,年龄≥60岁者术后吞咽障碍发生的危险性是<60岁者的2.732倍,张娟等[12]研究亦显示,吞咽障碍发生风险可随患者年龄增大而提高。究其原因为年龄大者各项生理机能减退,吞咽功能亦随着减弱,加之术中损伤因素可导致吞咽功能进一步减弱,从而导致吞咽障碍[13]。(2)有咽喉反流史。咽喉反流的直接损伤或继发性损伤均可导致喉部异常,因咽喉黏膜几乎缺乏对胃酸的防御结构,故咽喉反流可能造成咽喉部黏膜充血、糜烂等。倪鑫等[14]对国内声带白斑患者进行术前24 h咽喉及食管pH检测,发现73.3%声带白斑患者伴有病理性的食管内或咽喉反流。提示咽喉反流对喉部黏膜组织具有损伤作用。聂倩等[15]对42例喉接触性肉芽肿患者进行杓状软骨的CT分析,杓状软骨硬化率在病变侧为79.07%(34/43),在健康侧为7.32%(3/41),发现喉接触性肉芽肿侧杓状软骨钙化率较高,以上嗓音病与咽喉反流的关系可能为:咽喉黏膜由于缺乏对胃酸的防御结构,咽喉反流的直接损伤或继发性损伤都能导致喉部异常,从而导致喉部黏膜损伤,声带上皮细胞受损、炎性浸润、任克间隙干燥及上皮增厚[16-18]。故推测咽喉反流未得到纠正是导致术后杓区黏膜水肿、吞咽障碍的原因之一。(3)手术方式。手术方式为常规喉裂开术者更易发生吞咽障碍,与上述术式对喉结构的破坏较大有关。而等离子消融术或激光切除术在支撑喉镜直视下开展,可确保视野清晰,提高手术的精准度。同时能最大程度保护喉结构免受破坏,从而可减少吞咽障碍的发生。(4)张口受限程度。对于张口受限程度重者而言,术中病变暴露难度大,易出现术中舌根压迫时间长等情况,造成缺血,手术时间延长,致神经功能受到影响,从而增加吞咽障碍的风险[19]。(5)术后1周疼痛程度。疼痛度为重度者术后吞咽障碍的风险为轻中度者的2.641倍,推测其原因是吞咽活动受大脑皮质中枢控制,而术后创口疼痛可使皮质中枢受到影响,从而可引起吞咽障碍[20]。
为实现对早期喉癌患者术后吞咽障碍发生风险的个体化预测,本研究基于4项预测变量构建相关列线图模型,在该模型中各变量均给予相应的权重分,用来反映该变量对吞咽障碍发生的影响大小。4项变量权重分相加之和为总分,总分在发生概率一栏对应的点即为患者术后吞咽障碍发生的风险[21-22]。对模型予以内部验证,显示AUC 0.759(95%CI=0.674~0.844),预测吞咽障碍的概率和实际概率趋于一致,提示构建的模型具有较好的区分度和一致性。医护人员以上述模型为评判标准,筛查出高危患者并做好事先防控,如慎重选择手术方式,结合患者术后疼痛情况采取科学的镇痛策略,引导患者及早开展术后吞咽功能锻炼等,可将术后吞咽障碍风险降至最低。
综上所述,基于年龄、咽喉反流病史、手术方式、张口受限程度、术后1周疼痛程度等5项因素构建的列线图模型预测早期喉癌患者术后吞咽障碍发生风险的效果较好,对于有效甄别高风险者及制定妥善的干预策略降低术后吞咽障碍发生风险具有重要意义。
