超声、DSA 和手术在治疗自体动静脉内瘘狭窄或闭塞中的对比研究
2024-04-24刘书玉孙龙马苏亚
刘书玉,孙龙,马苏亚
维持性血液透析是终末期肾病的主要治疗方式,通过清除血液中多余代谢废物、水分,维持机体的酸碱平衡,可有效延长患者生存期。自体动静脉内瘘(arteriovenous fistula,AVF)为血液透析的主要血管通路,相较于其他血管通路,该通路具有对生活影响小、并发症少、使用寿命长等优点,利于维持透析过程中血流通畅,以确保血液透析能够顺利进行[1]。动静脉内瘘可因长期、反复的血管穿刺或局部受压出现狭窄或闭塞。目前临床治疗AVF 狭窄或闭塞主要有超声引导下经皮腔内血管成形术(perctuaneous transluminal angioplasty,PTA)术、DSA 引导下PTA 术及外科开放重建术3 种方法[2-4]。本研究探讨不同手术方式治疗AVF 狭窄或闭塞的临床价值,现报道如下。
1 资料与方法
1.1 一般资料 回顾性选取2021 年1 月至2022 年8 月到宁波市鄞州区第二医院进行自体动静脉内瘘狭窄治疗的139 例慢性肾功能衰竭患者为研究对象。结合患者的健康状态、合并的基础疾病及临床医生的专业知识和手术经验,综合选择治疗方案。按不同手术方式分为超声引导下PTA 术组(超声组,65例),DSA 引导下PTA 术组(DSA 组,34 例),外科手术内瘘重建组(手术组,40 例)。本研究获得医院伦理委员会批准,所有研究对象均同意参加本研究并签署书面知情同意书。
纳入标准:(1)内瘘成熟;(2)满足AVF 狭窄的诊断标准[5];(3)血流量差,不能行透析治疗;(4)无法触诊到内瘘震颤或震颤减弱,无法听诊到血管杂音;(5)内瘘吻合方式为桡动脉与头静脉吻合。排除标准:(1)心、肺等主要脏器功能较差;(2)有恶性肿瘤疾病者;(3)瘘管感染患者;(4)妊娠或哺乳期妇女;(5)对比剂过敏者;(6)因死亡或其他原因失访者。
1.2 方法
1.2.1 超声组 术前行超声检查(意大利百胜超声仪,探头为血管探头LA523,探头频率4 ~12 MHz)确定AVF 狭窄情况。患者取平卧位,对皮肤进行消毒,2%利多卡因行局部麻醉,选择合适的头静脉/桡动脉入路,以改良Seldinger 技术穿刺,逐层进入血管,进入超硬导丝(日本Terumo),拔出穿刺针,置入5F/6F穿刺鞘,拔出超硬导丝,静脉注射0.5 mg/kg 肝素,沿穿刺鞘进置入超滑导丝(日本Terumo),通过狭窄部位;根据实时超声显示的狭窄情况,进而选择合适的球囊[3 ~8 mm 直径Mustang 球囊(美国Boston Scientific)],沿导丝送入球囊并推至狭窄远端部位,缓慢加压至目标值(一般达到20 个大气压左右)后保持1 min 左右,然后释放压力,反复操作2 ~3次,至球囊切迹完全消失;再次测量原狭窄管径,血流通畅后依次取出球囊导管、血管鞘,5-0 血管缝合线对穿刺口进行荷包缝合并用弹力绷带加压包扎。术后观察穿刺部位有无出血,询问患者有无不适症状。
1.2.2 DSA 组 在DSA 引导下(SIEMENS ArtisZe ego III系统),注入对比剂(注射速度为2 ml/s),明确狭窄部位。患者取仰卧位,患侧肢体暴露良好,消毒皮肤,铺巾,取2%利多卡因局部浸润麻醉,找到合适的穿刺点,穿刺针逐层进入血管,进入超硬导丝,拔出穿刺针,置入5F/6F 穿刺鞘,拔出超硬导丝,静脉注射0.5 mg/kg 肝素,沿穿刺鞘进入超滑导丝,通过狭窄部位,沿导丝进入球囊,根据狭窄部位具体情况选择合适的球囊[3 ~8 mm 直径Mustang 球囊(美国Boston Scientific)],通过狭窄部位,然后开始缓慢增压直至工作压而小于爆破压,在1 min 后开始缓慢减压,2 min后对以上操作进行重复,退出球囊,进行2 ~3 次的扩张,结束后造影显示狭窄段改善,血流良好,可触及内瘘震颤,将穿刺鞘拔出,5-0 血管缝合线荷包缝合,无活动性出血,使用敷料进行包扎,返回病房。术后观察穿刺部位有无出血,询问患者有无不适症状。
1.2.3 手术组 术前明确AVF 通路情况及狭窄部位并标记,使用1%利多卡因臂丛神经麻醉后,于腕关节动静脉内瘘吻合口上方纵行切开皮肤,逐层分离皮下组织,显露原动静脉内瘘吻合口并向近心端分离出头静脉及桡动脉,于严重狭窄或钙化的头静脉上方进行横断,结扎近吻合口头静脉断端。修剪近心端头静脉,并在相应位置切开桡动脉侧壁,与头静脉行端侧吻合。血管吻合口处无渗血,桡动脉和头静脉无血管扭转,内瘘可扪及震颤,确认血流通畅后,依次缝合皮下组织、皮肤。
1.3 观察指标(1)收集患者基本资料及手术相关资料(患者术前及术后狭窄处内径、肱动脉流速、肱动脉平均血流量)。(2)随访患者术后1、3、6、9、12个月AVF 的通畅情况。
1.4 统计方法 采用SPSS 25.0统计软件处理数据,正态分布计量资料以均数±标准差表示,两组比较采用t 检验,多组间比较采用方差分析;非正态分布的计量资料以中位数(四分位间距)表示,两组比较采用采用秩和检验,多组间比较采用Kruskal-WallisH检验;计数资料以例(%)表示,组间比较采用2检验或Fisher 精确检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 3 组基本资料比较 3 组患者性别、年龄、内瘘部位、透析龄、内瘘使用时长及原发病差异均无统计学意义(均P >0.05),见表1。
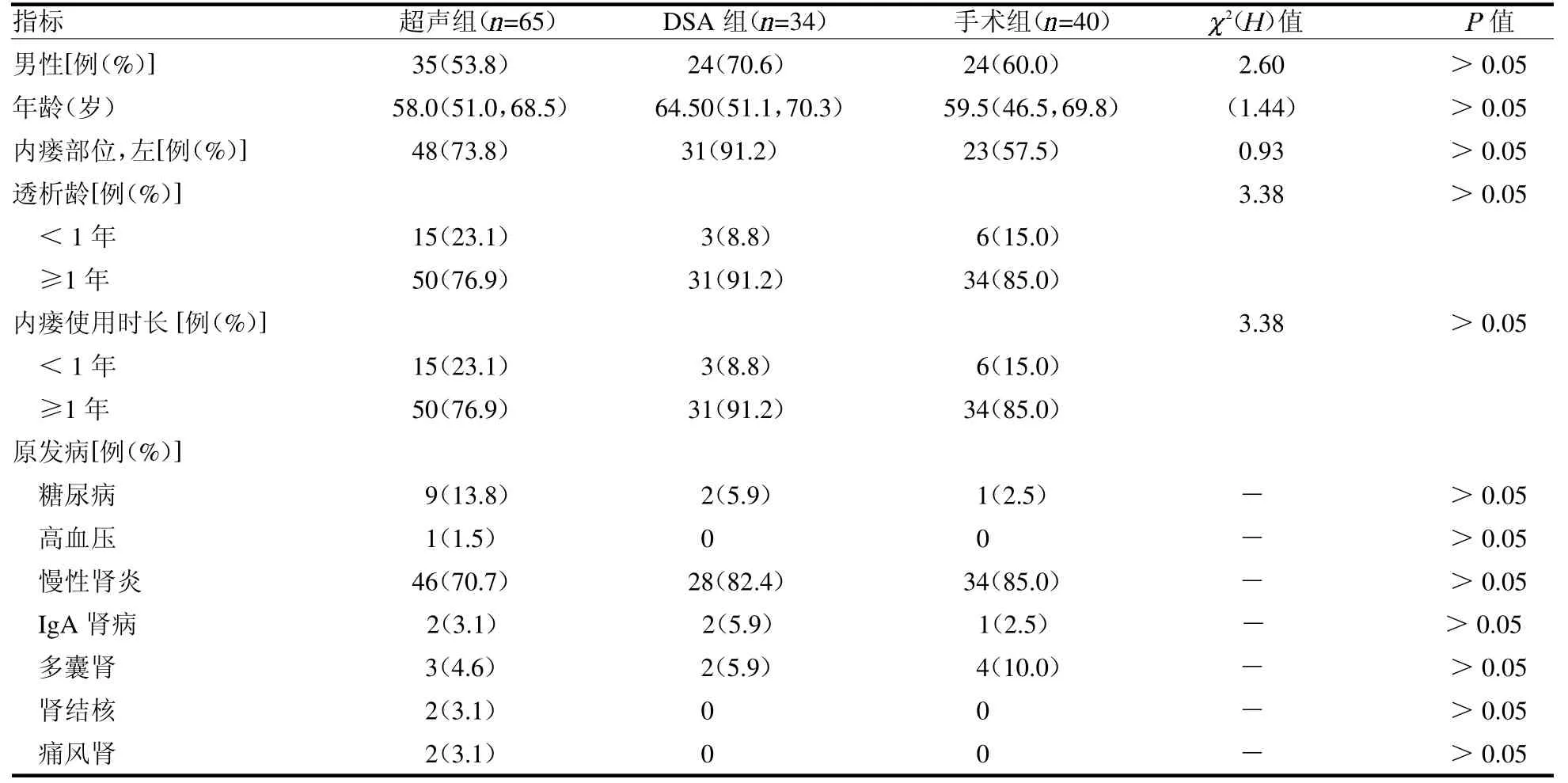
表1 不同手术方式患者基本资料比较
2.2 3 组手术时长、出血量及一次手术成功率比较超声组手术时长、出血量均低于DSA组和手术组(均P <0.05):3 组一次手术成功率差异无统计学意义(P >0.05),见表2。

表2 不同手术方式患者手术时长、出血量及一次手术成功率比较
2.3 3 组疗效比较
2.3.1 超声组PTA 术前后参数比较 与术前相比,术后AVF 狭窄处血管内径明显增大,狭窄处流速降低,肱动脉平均血流量明显增加(均P<0.05),见表3。

表3 超声组PTA 术前后参数比较
2.3.2 DSA 组PTA 术前后参数比较 与术前相比,术后AVF 狭窄处血管内径明显增大,狭窄处和肱动脉流速下降,肱动脉平均血流量明显增加(均P <0.05),见表4。

表4 DSA 组PTA 术前后参数比较
2.3.3 超声组与DSA组治疗前后参数比较 超声组与DSA 组术后狭窄处内径增加值,肱动脉平均血流量增加值,差异均无统计学意义(均P>0.05),见表5。

表5 超声组与DSA 组治疗前后效果比较
2.3.4 手术组术前后参数比较 内瘘重建术后肱动脉平均血流量值[(622.32±127.56)ml/min]高于术前[(213.02±137.88)ml/min],差异有统计学意义(t=25.89,P <0.05)。
2.3.5 3 组术后通畅率比较 3 组术后1、3、6 个月通畅率差异均无统计学意义(均P >0.05);手术组术后9 个月通畅率高于DSA 组(P <0.05);手术组术后12 个月通畅率高于DSA 组和超声组(均P <0.05),见表6。

表6 不同手术方式患者通畅率比较 例(%)
3 讨论
终末期肾病患者的首选治疗方案为血液透析,血管通路是血液透析患者的“生命线”。AVF 狭窄是造成血管通路功能丧失的主要原因,占AVF 患者的一半以上[6]。PTA 术具有简单易行、治疗效果确切、可反复进行等特点,可以最大限度地保留内瘘血管和透析穿刺点[7]。此外,其可在放射介入或超声引导下进行。随着超声设备及技术的飞速发展,越来越多的国内外学者采用超声引导下PTA 术治疗血液透析患者AVF 狭窄[8]。
本研究回顾性分析超声、DSA 和手术在治疗AVF狭窄中的差异,结果显示超声组在手术时长、手术出血量方面优于DSA 组和手术组(均<0.05)。这提示超声具有更大的优势。超声引导下能够实时观察到血管情况,且无辐射,提升了手术的安全性。
超声组与DSA 组治疗后狭窄处内径均明显增大,狭窄处流速均下降,肱动脉血流量均明显增加(均<0.05)。超声组与DSA 组治疗后狭窄处内径增加值,肱动脉平均血流量增加值差异均无统计学意义(均>0.05)。由于外科手术是将狭窄部分的血管切除修剪后重新吻合,因此手术组无法比较治疗前后狭窄处内径值、狭窄处流速等值,但内瘘重建术后肱动脉平均血流量值高于术前(<0.05)。本研究结果与文献[9-10]的治疗研究结果相似。这提示超声、DSA、手术3 种方法对于AVF 狭窄的治疗均有较好的疗效。
本研究结果显示,3 组术后1、3、6 个月AVF 通畅率差异无统计学意义(均>0.05);超声组、手术组通术后9 个月畅率高于DSA 组(均<0.05);手术组术后12 个月通畅率高于DSA 组和超声组(均<0.05)。外科手术治疗AVF 狭窄远期通畅率较高,却不能节约血管资源,手术适应证相对受限,且存在手术禁忌,若病变的狭窄静脉距离原内瘘吻合口较远,则手术很难进行,也不能解决狭窄问题。DSA 引导下PTA 术在成像上更具整体观,但存在一定辐射安全性问题,对比剂会加重代谢负担。超声引导下PTA 术不需要注射对比剂,减轻了患者肾脏负担。
本研究的局限性为患者病例数较少,且是回顾性研究,观察时间较短,有待于今后更多的前瞻性研究及多中心多样本量的研究随访。
利益冲突 所有作者声明无利益冲突
