小麦赤霉病生防菌XH-1的鉴定及防治效果
2024-04-24王婷婷魏淑红董润鑫许有嫔
王婷婷,魏淑红,宋 波,董润鑫,许有嫔
(西华师范大学生命科学学院,四川 南充 637000)
【研究意义】小麦(TriticumaestivumL.)是全球重要粮食作物,其可持续发展是关乎国计民生的大事[1]。然而,小麦生产过程中常常会受到非生物(如干旱、高温、盐度、寒冷等)和生物胁迫(病毒、细菌、真菌、昆虫等),导致各种病害发生[2]。其中由禾谷镰刀菌(Fusariumgraminearum)引起的小麦赤霉病(Fusarium head blight,FHB)被称为小麦的“癌症”,近年来该病害在我国各地频繁发生[3],据统计,2012—2018年,每年有超过4×106hm2的小麦发生赤霉病,约占小麦产区总面积的23%,给农民带来了巨大的经济损失,对粮食生产安全构成了严重威胁[4]。为防治赤霉病,人们长期使用杀菌剂,使得菌株对杀菌剂的敏感性逐渐降低,因此,迫切需要寻找一种新颖有效的赤霉病防治措施。生物防治成本低、环境友好且具有可持续防治的特点[5],弥补了化学防治带来的环境污染和抗药性产生等问题,目前备受关注。因此,分离出1株对赤霉病具有高效防治效果的生防菌以防控赤霉病害具有很好的科研及应用价值。【前人研究进展】生防菌可来源于植物体内、昆虫共生以及与生物相关的其他各种环境[6]。目前能够防治小麦赤霉病的生防菌涵盖了细菌、真菌等多个种属,如芽孢杆菌、霉菌和放线菌等[7]。当前研究认为,生防菌主要通过竞争性作用、产生生物活性物质、诱导植物防御等机制来发挥生防作用[8]。芽胞杆菌作为生防菌的一大类别,具有抗逆性强和抑菌谱广等特点,被广泛应用于植物病虫害防治[9]。目前国内外已分离出一些对小麦赤霉病有防治效果的芽孢杆菌,如枯草芽孢杆菌(Bacillussubtilis)XG-7对赤霉病有良好的抑菌性[10];D1/2[11]、DZSG23[12]能够抑制菌丝生长,减缓孢子萌发、使孢子畸形;Z54[13]、AF0907[14]、B-30210[15]、RC218[16]等能降低赤霉病发病;SG6抑制菌丝生长、产孢量及DON生产[17]。解淀粉芽孢杆菌(B.amyloliquefaciens)YN201732[18]、XS-2[19]和AX-3[20]等对小麦赤霉病具有明显的防治效果。多粘类芽孢杆菌(Paenibacilluspolymyxa)AFR0406[21]、DY04[22]和7F1[23]等也对禾谷镰刀菌抑制效果明显。【本研究切入点】尽管国内外对生防菌相关研究已取得较大进展,但在应用方面尚处于起步阶段,且可开发利用的生防菌资源匮乏,因此有必要挖掘新的生防菌资源。【拟解决的关键问题】XH-1是否可作为赤霉病防治的有效生防菌资源?筛选禾谷镰刀菌的高效生防菌株是小麦赤霉病生物防治的关键,但目前可利用的生防菌资源十分匮乏。因此,迫切需要挖掘出高效防治赤霉病的生防菌资源。为此,本研究从健康小麦周围土壤中分离纯化出常用生理小种XH-1菌株,通过鉴定其种属分类,分析其对常用生理小种PH-1生长发育及致病力的拮抗作用,探究XH-1可否作为小麦赤霉病的有效生防菌资源这一关键科学问题。
1 材料与方法
1.1 试验材料培养
禾谷镰刀菌菌株选用常用生理小种PH-1,由西华师范大学植物遗传与发育生物学课题组保存,将其培养于PDA平板,于28 ℃恒温培养3 d后,保存于4 ℃备用。小麦材料选用南麦660,由南充市农科院小麦所赠送。枯草芽孢杆菌菌株XH-1,分离自四川南充市西华师范大学小麦试验田。
1.2 生防菌的分离与筛选
挖取小麦赤霉病病区中健康小麦植株周围深5~15 cm的土样,将其于无菌水中混匀,静置10 min后吸取100 μL上清液进行稀释涂布于PDA培养基,于30 ℃培养1~2 d,挑取形态各异的菌落划线纯化培养,将纯化后的单菌落连续纯化培养3次后保存备用。挑取纯化的细菌接种于PDA培养基的1/3处,正中间接种PH-1菌株,28 ℃培养3~4 d后观察细菌周围是否产生抑菌带,将有抑菌带菌株作为生防菌资源并保存。本研究后续选用XH-1开展试验。
1.3 菌株XH-1的鉴定
本研究采用16S rDNA序列分析法鉴定该菌株,利用细菌通用引物27F(5’-AGAGTTTGATCTGGCTCG-3’)和1492R(5’-GGTTACCTTGTTACGACT T-3’)扩增XH-1菌株的16S rDNA基因序列。并将PCR产物送至生工生物工程(上海)股份有限公司进行测序,对测序结果进行BLAST比对,使用MEGA 5.0软件将获得的同源序列进行系统发育分析。
1.4 XH-1菌液与PH-1菌株的平板对峙分析
为分析XH-1菌液对禾谷镰刀菌PH-1菌落生长的影响,采用平板对峙法进行试验。每个平板滴3滴1 μL的菌液形成等边三角形的3个顶点(图1),平板中央接种约2 mm×2 mm的PH-1菌丝块,于28 ℃培养3 d后测量计算抑菌率,以添加PDB培养基作为对照。每个处理接种3个平板,设置3次生物学重复。抑菌率=[(R平均值-r平均值)/R平均值]×100%。

图1 平板对峙试验Fig.1 Experimental illustration of flat plate confrontation
1.5 菌液和孢悬液的制备
XH-1菌液:挑取XH-1菌株于3 mL PDB培养基中28 ℃,180 r/min摇培8~12 h作为种子液,按1∶100(种子液∶培养基)的比例取种子液到新的PDB
培养基中摇培24 h后进行后续试验。
PH-1的孢子悬浮液:将PH-1于PDA平板培养3 d,用黄色枪头戳取6个菌丝块置于50 mL 的CMC产孢培养基中,于28 ℃、180 r/min 条件下摇培5 d后收集分生孢子,并将孢子浓度调至1×106个/mL备用。
1.6 菌株XH-1对禾谷镰刀菌孢子萌发的影响
将XH-1菌液与1×106个/mL的PH-1孢子悬浮液按1∶1(体积比)混合,再向各混合液中加入等量的YEPD培养基,以无菌水与PH-1孢子悬浮液混合为对照,28 ℃、180 r/min摇培,分别在2、4、8、12和24 h时取培养液观察分生孢子的萌发情况。
1.7 菌株XH-1对禾谷镰刀菌侵染力的影响
接种前配制3份接种液,A液:PH-1孢子悬浮液与XH-1菌液按1∶1(体积比)混合;B液:PH-1孢子悬浮液与PDB液体培养基混合;C液:无菌水。
叶片戳伤接种:选取生长4周龄大小的小麦叶片,进行戳伤处理,在戳伤处分别接种6 μL的A、B、C液对接种后的叶片进行保湿处理,于27 ℃下暗培养24 h,之后进行光暗交替培养3~4 d后观察叶片发病情况,每个处理接种15个伤口,设置3次生物学重复。
麦穗单花滴注接种:选取处于扬花期的小麦麦穗,分别在小穗中部小花接种A、B、C液,每个小花接种体积10 μL,每个处理接种3个小穗,并进行套袋保湿,1周观察麦穗发病情况。
2 结果与分析
2.1 菌株XH-1的分离与鉴定
前期通过采集健康的南麦660植株附近根际土壤,通过梯度稀释后涂布于平板,对获得的菌落进行分离纯化(图2-A),将纯化后的菌株接与禾谷镰刀菌共培养,观察PH-1的菌落生长情况。发现其中XH-1对PH-1的菌落生长具有抑菌作用。经革兰氏染色观察,菌株XH-1为革兰氏阳性菌,菌体为杆状(图2-B)。通过16S rDNA序列分析并构建系统发育树,将XH-1鉴定为枯草芽孢杆菌(图3)。

图2 XH-1菌株形态Fig.2 Morphology of strain XH-1
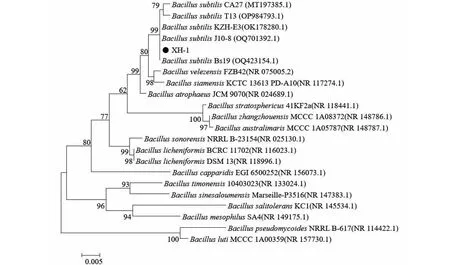
图3 XH-1系统发育分析Fig.3 Phylogenetic analysis of XH-1
2.2 菌株XH-1影响禾谷镰刀菌生长
为探究枯草芽孢杆菌XH-1对禾谷镰刀菌营养生长的影响,进行平板对峙试验,结果发现,相比于对照组,接种有XH-1的PDA培养基中PH-1菌落生长受到抑制(图4),其抑制率为45.6%。表明枯草芽孢杆菌XH-1能抑制禾谷镰刀菌的营养生长,对禾谷镰刀菌具有拮抗作用。

图4 XH-1菌株对禾谷镰刀菌的平板对峙分析Fig.4 Plate confrontation analysis of strain XH-1 against F. graminearum
2.3 菌株XH-1抑制禾谷镰刀菌的产孢
为探究枯草芽孢杆菌XH-1对禾谷镰刀菌孢子产量的影响,利用CMC产孢法,将XH-1加入CMC产孢培养基中,同时加入PH-1菌丝块,产孢 5 d后统计产孢量,以加入与XH-1等体积的PDA培养基为对照,每个处理设置3个技术重复,并进行3次生物重复。结果显示,对照组平均产孢量为12.1×105个/mL,加入XH-1后PH-1的产孢量为0(图5)。表明枯草芽孢杆菌XH-1能够抑制禾谷镰刀菌的产孢过程。

图5 XH-1对禾谷镰刀菌产孢量的影响Fig.5 Effect of XH-1 on the spore production of F. graminearum
2.4 菌株XH-1抑制禾谷镰刀菌孢子萌发过程
为探究枯草芽孢杆菌XH-1菌液对禾谷镰刀菌孢子萌发的影响,将XH-1菌液加入PH-1孢子萌发诱导培养基YEPD中,以添加与XH-1菌液等体积的PDA培养基为对照,分别于培养2、4、8、12和24 h后观察孢子萌发情况。通过显微观察,发现对照组的PH-1分生孢子从培养2 h后开始萌发产生液生菌丝(图6-A),培养8 h后孢子的萌发率趋于稳定(图6-B)。而加入XH-1后,分生孢子的萌发被显著抑制,且孢子出现异常膨大现象(图6-A),直到24 h都没有萌发产生液生菌丝。表明,添加XH-1菌液后能够抑制禾谷镰刀菌孢子萌发过程。

A:各时间段孢子萌发情况;B:孢子萌发率变化情况。A: Conidia germination at different time; B: The change of conidia germination rate.图6 XH-1对孢子萌发的抑制作用Fig.6 Inhibitory effect of XH-1 on germination of conidia
2.5 菌株XH-1影响禾谷镰刀菌的侵染力
为分析XH-1对禾谷镰刀菌致病性的影响,对小麦叶片进行戳伤接种,分别接种PH-1与XH-1的混合液、PH-1、 ddH2O于小麦叶片上,接种4 d后观察并统计发病情况。结果发现,接种XH-1与 PH-1混合液的小麦叶片病斑较小(图7-A),且不会向接种点外扩展,而接种PH-1的小麦叶片发病严重,接种无菌水的小麦叶片不发病。进一步通过对小麦麦穗进行单花滴注实验,结果与叶片接菌结果一致,加入XH-1后PH-1的致病力显著减弱(图7-B)。结果表明,枯草芽孢杆菌XH-1菌液能够抑制禾谷镰刀菌的致病力。

A:XH-1对PH-1侵染小麦叶片的影响;B:XH-1对PH-1侵染小麦穗部的影响。A: Effect of XH-1 on PH-1 infection of wheat leaves; B: Effect of XH-1 on PH-1 infection of wheat spike.图7 XH-1对禾谷镰刀菌侵染力的影响Fig.7 Effect of XH-1 on wheat leaves and ears infected by F. graminearum
3 讨 论
小麦赤霉病的普遍发生给农民带来了巨大的经济损失[24],而禾谷镰刀菌作为引发赤霉病的主要病原体,被列为第四大植物病原真菌[25]。一直以来,人们通常采用杀菌剂(如多菌灵等)对赤霉病进行化学防控,但这对环境也造成了一定的污染[26-27]。相比化学防治,生物防治具有无公害、无残留、对人和动物安全等优点,因此具有广泛的应用前景[20]。生物防治是指利用生物有机体或其天然产物控制病虫害的方法[28-29],芽孢杆菌是生物防治中使用最广泛的微生物[30]。已有研究表明,芽孢杆菌可以产生表面活性素、丰原素和伊枯草菌素等脂肽抗菌物质,包括聚酮、氨基糖和磷脂在内的非肽类抗菌化合物,细菌素等蛋白类活性物以及其他的能够抑制病原菌生长的产物[31-35]。一些研究表明芽孢杆菌对小麦赤霉病有明显的抑制作用,如抑制菌丝营养生长[17]、降低孢子萌发率或致畸[11-13]以及削弱病原菌的致病力[36]等。此外,已有研究表明芽孢杆菌被广泛应用于作物土传病害的防治中,如尖孢镰刀菌引起的人参根腐病[37]和草莓镰刀菌枯萎病[38]、致病疫霉引起的马铃薯晚疫病[39]等,因此芽孢杆菌具有良好的应用前景。本研究从小麦根部土壤中分离出1株对禾谷镰刀菌具有明显抑制作用的拮抗菌株XH-1,经过对该菌株的形态特征观察、16S rDNA序列的系统发育分析,将其鉴定为枯草芽孢杆菌。
生防菌XH-1与禾谷镰刀菌一起培养时,可以抑制禾谷镰刀菌的生长,使其菌丝无法向外自由延伸,并且XH-1还能抑制禾谷镰刀菌分生孢子的产孢及萌发,降低孢子萌发率,同时使孢子膨胀和畸形。已有研究表明,大部分枯草芽孢杆菌产生的抗菌物质都能造成病原菌的细胞壁或细胞膜裂解,继而使原生质外泄,菌丝体崩解,这些抑菌物质大多也都能抑制孢子萌发或者使已经萌发的孢子变形[31, 40],这一结论与本研究结果相符。可见,在生防菌XH-1的作用下,禾谷镰刀菌无法正常生长和繁殖。但是XH-1菌株具体产生了哪些抑菌物质来影响禾谷镰刀菌的生长目前尚不明确,后续可对其抑菌物质的组成和作用机理进行深入探究。此外,本研究还通过叶片及麦穗的接菌实验发现,XH-1能够显著削弱禾谷镰刀菌对小麦的侵染能力,因此XH-1在小麦赤霉病的防治中,甚至在其他植物真菌病害的防治中可能会有广泛的应用前景。但其具体的作用机制尚不明确,后续可深入探究其在禾谷镰刀菌侵染进程中的作用机理以及对产毒的影响。
4 结 论
本研究从健康小麦周围土壤中分离到对禾谷镰刀菌具有拮抗作用的菌株XH-1,经测序比对及系统发育分析将其鉴定为枯草芽孢杆菌,该菌株对禾谷镰刀菌的生长、产孢、孢子萌发、侵染力等过程均具有明显抑制作用,因此该菌株具有良好的应用前景,可为小麦赤霉病的生物防治提供资源。
