基于STIR-MRI的影像组学模型评估原发性下肢淋巴水肿的临床分期
2024-04-23刘梦珂张怡梦张妍李兴鹏郝琪张晓杰徐井旭黄陈翠王仁贵
刘梦珂,张怡梦,张妍,李兴鹏,郝琪,张晓杰,徐井旭,黄陈翠, 王仁贵
下肢淋巴水肿是由于淋巴回流中断或受损,肢体皮下软组织内淋巴液过度积聚,脂肪肥大及纤维结缔组织增生,导致肢体慢性进行性肿胀的疾病[1]。国际淋巴协会(International Society of Lymphology,ISL)将其分为原发性及继发性,继发性淋巴水肿常发生在手术、外伤、丝虫病和感染等因素后;原发性下肢淋巴水肿(primary lower extremity lymphedema,PLEL)是一种较为罕见的遗传性疾病,与淋巴管功能异常有关[2-3]。PLEL患者常表现为无明显诱因出现的慢性进行性下肢肿胀,严重者可发生象皮肿畸形,给患者带来极大的痛苦。早期诊断并准确评估PLEL严重程度对患者及时诊治及预防并发症极为重要[4]。以往PLEL影像学诊断主要依赖于核素淋巴显像,但其无法定量评估淋巴水肿的严重程度[5-6]。MR具有高软组织分辨率,能够敏感地显示肢体水肿的形态及分布,可评估PLEL的严重程度[7-9]。但传统的MRI影像特征分析大多依赖于视觉观察的形态学和部分功能性特征,无法反映病灶区域的微观异质性信息。因此,我们探讨能否通过影像组学方法获取更多的影像诊断信息来评估PLEL的严重程度,本研究中通过构建基于MRI的影像组学模型,并评价其在鉴别PLEL临床分期中的作用,旨在进一步提高对PLEL的影像诊断水平,更好地指导临床实现个体化精准治疗。
材料与方法
1.研究对象
回顾性搜集2018年1月-2019年12月就诊于本院淋巴外科的单侧PLEL患者的病例资料。纳入标准:①由淋巴核素显像诊断为单侧下肢淋巴水肿;②行下肢MRI检查。排除标准:①因手术、丝虫病、创伤和感染等因素导致的继发性下肢淋巴水肿;②临床资料不全,无法准确分期;③MR图像质量差,无法准确勾画感兴趣区。
参照2020年ISL临床分期标准将患者分为Ⅰ~Ⅲ期:病变肢体柔软,按压可轻度凹陷,抬高患肢24 h后肿胀完全缓解者为Ⅰ期;肢体明显肿胀,按压出现明显凹陷,皮肤弹性减低,抬高患肢24 h后肿胀消退不明显者为Ⅱ期;按压肢体水肿处无明显凹陷,肢体皮肤发生改变(如色素沉着、棘皮病、疣状增生、象皮肿)为Ⅲ期[2]。最终纳入132例单侧PLEL患者,包括ISL-Ⅰ期45例、ISL-Ⅱ期51例、ISL-Ⅲ期36例。
2.MR检查
使用Phillips Intera Ingenia 1.5T磁共振扫描仪。患者取仰卧位、足先进,扫描范围自双足至盆腔,分别在足((第一站)、小腿(第二站)和大腿(第三站)连续进行3次扫描。采用短时反转恢复(short time inversion recovery,STIR)序列,扫描参数:TR 8549 ms,TE 165 ms,层厚7.0 mm,层间距0.4 mm,视野400 mm×400 mm,矩阵240×200,IR 160 ms,层数32。
3.影像组学分析
使用深睿多模态科研平台(https://keyan.deepwise.com/)进行影像组学分析,主要包括图像分割、特征提取和筛选及模型构建等步骤。
将横轴面及冠状面STIR序列图像以原始DICOM格式上传至后处理工作站。由一位具有10年MR诊断经验的医师在原始横轴面图像上勾画ROI。勾画前先在冠状面图像上观察患侧肢体肿胀最严重的水平,然后基于此水平连续选择10层横轴面图像上,在每层图像上选取皮下软组织区域的水肿区,即在STIR图像上呈高信号的区域,勾画全部水肿区,将10个层面的ROI融合生成3D-VOI(图1~3)。为了评估分割的有效性,由另一位有20年MR淋巴水肿诊断经验的影像科医师检查了图像分割的情况。如果提出质疑,则由两位医师进行商议,达成一致后重新进行ROI的勾画。
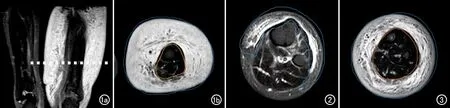
图1 29岁男性,原发性下肢淋巴水肿Ⅲ期。a)冠状面STIR图像,显示左大腿显著肿胀、增粗,皮下软组织内广泛水肿呈显著高信号,确定患肢肿胀程度最大水平(虚线);b)然后在相应的横轴面图像中选取该水平及相邻的上下共10个层面,逐层在皮下软组织水肿区,沿着其边缘勾画ROI,即图中蓝线与黄线之间的区域。 图2 23岁女性,原发性下肢淋巴水肿Ⅰ期,勾画的蓝线内的区域即为ROI。 图3 69岁男性,原发性下肢淋巴水肿ISL-Ⅱ期,蓝线与黄线之间区域为勾画的ROI。
最终提取了VOI的1743个影像组学特征,包括一阶特征342个、形态特征14个及纹理特征1387个,纹理特征包括灰度共生矩阵、灰度级区域矩阵、灰度行程矩阵、灰度相依矩阵特征和邻域灰度差分矩阵的特征。特征筛选时首先剔除方差为0的特征;然后根据特征间的皮尔逊相关性分析,当训练集中任意两个特征(自变量)之间的线性相关系数值大于0.9时,将优先保留与因变量的线性相关系数值较高的特征,并剔除另外一个特征,以减少特征之间的冗余性;其次,采用F-Test算法(基于方差分析的特征筛选)用于特征筛选,找出组间有差异的特征引入逻辑斯特回归(logistic regression,LR)建立影像组学模型。对构建的模型使用五折交叉验证法进行模型训练,即把数据分成五等份,每次实验拿一份做测试,其余用作训练,实验5次求平均值。故训练集与测试集例数相同。
4.统计学分析
使用SPSS 23.0软件进行基本资料的统计分析。符合正态的计量资料以均数±标准差来表示,否则采用中位数±四分位数间距来表示。对于定量资料,若两组数据均呈正态分布,组间比较采用独立样本t检验,反之则采用Mann-WhitneyU检验;对于分类变量,组间比较采用卡方检验。使用Scikit学习软件包建立ISL-Ⅰ期与ISL-Ⅱ期及ISL-Ⅱ期与ISL-Ⅲ期的分类模型。基于ROC曲线分析,采用AUC、敏感度、特异度和符合率等指标评价模型对ISL分期的预测效能。采用决策曲线分析(decision curve analysis,DCA)评估模型的临床价值。以P<0.05为差异具有统计学意义。
结 果
1.一般临床资料
纳入的132例患者中,男50例,女82例,年龄2~76岁,中位年龄29岁。各期患者之间临床资料的比较结果见表1。
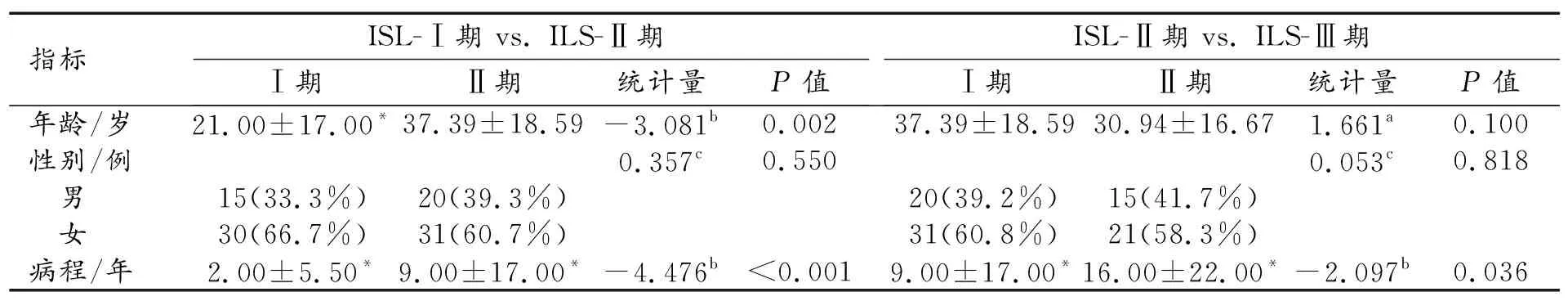
表1 原发性下肢淋巴水肿各分期之间临床资料的比较
ISL-Ⅰ期与ILS-Ⅱ期比较:两期患者均以女性居多,两组之间性别构成的差异无统计学意义(P>0.05);而在年龄和病程方面,两组之间的差异有统计学意义(P<0.05)。
ISL-Ⅱ期与ILS-Ⅲ期比较:Ⅱ期和Ⅲ期患者均以女性居多,两组之间性别构成及年龄的差异均无统计学意义(P>0.05);Ⅱ期的病程短于Ⅲ期,差异有统计学意义(P<0.05)。
2.组学特征筛选及组学模型建立
ISL-Ⅰ期与ILS-Ⅱ期:训练集96例,验证集96例。提取的1743个特征中,剔除349个方差为0的特征,然后进行特征间的相关性分析,基于线性相关系数阈值为0.9,剔除了1243个特征后,对剩余的151个特征采用F-Test算法进行特征筛选,最终共筛选出10个特征作为鉴别Ⅰ、Ⅱ期淋巴水肿的特征子集(表2)。
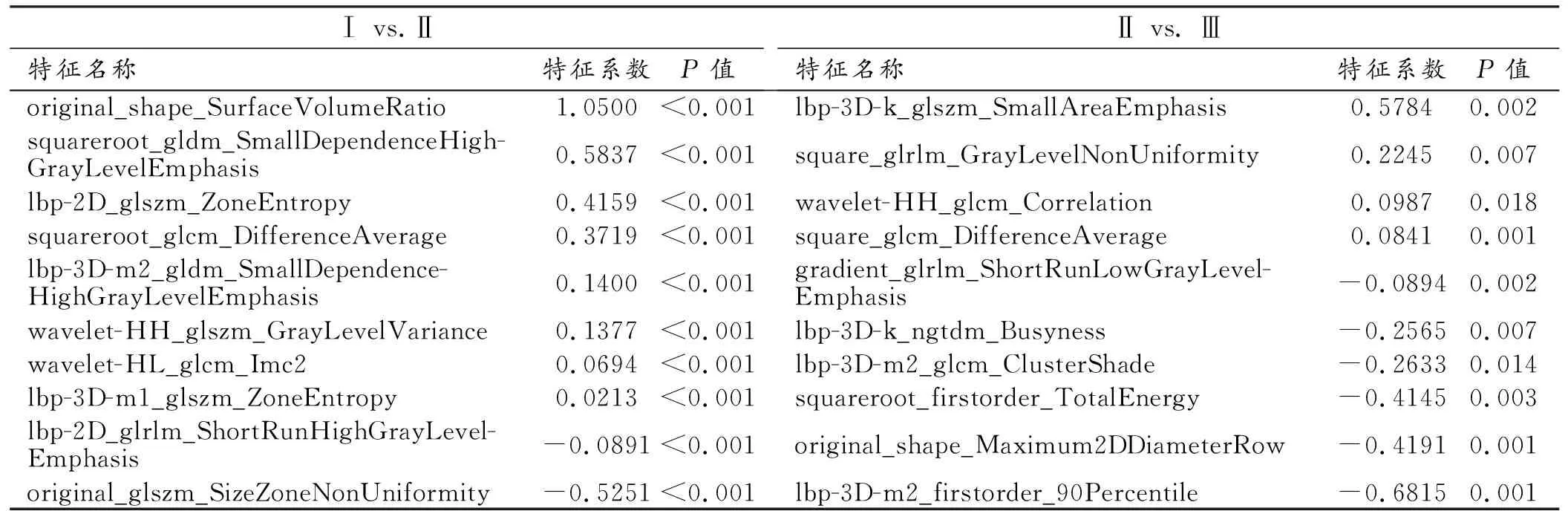
表2 筛选得到的用于构建Ⅰ期与Ⅱ期及Ⅱ期与Ⅲ期鉴别模型的影像组学特征
ISL-Ⅱ期与ILS-Ⅲ期:训练集87例,验证集87例。提取的1743个特征中,移除352个方差为0的特征,然后进行特征间的相关性分析,基于r的阈值0.9,移除1211个特征后,对剩余的180个特征采用F-Test算法进行特征筛选,共筛选出10个特征作为鉴别Ⅱ、Ⅲ期淋巴水肿的特征子集(表2)。
构建的影像组学模型的ROC曲线分析结果见表3及图4~5。影像组学模型在训练集中具有较高的鉴别价值,在验证集中具有良好的预测效能。鉴别ISL-Ⅰ期与ILS-Ⅱ期及ISL-Ⅱ期与ILS-Ⅲ期的影像组学模型的决策曲线见图6,显示影像组学模型对鉴别PLEL Ⅰ期与Ⅱ期及Ⅱ期与Ⅲ期均能够获得较高的临床收益。

表3 原发性下肢淋巴水肿不同临床分期的ROC曲线分析
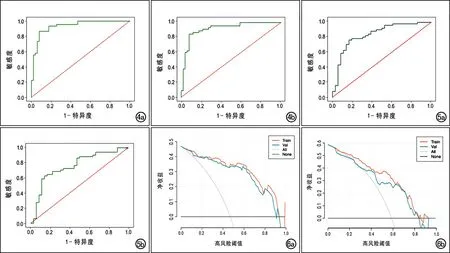
图4 影像组学模型鉴别原发性下肢淋巴水肿ISL-Ⅰ期与ILS-Ⅱ期的ROC曲线。a)训练集;b)验证集。 图5 影像组学模型鉴别原发性下肢淋巴水肿ISL-Ⅱ期与ISL-Ⅲ期的ROC曲线。a)训练集;b)验证集。 图6 决策曲线。a)基于影像组学模型鉴别原发性下肢淋巴水肿ISL-Ⅰ与ILS-Ⅱ期,灰线表示假设所有患者都是Ⅰ期水肿的决策曲线,黑线表示假设没有患者是Ⅰ期水肿的决策曲线,红线表示训练集,绿线表示验证集,DCA显示在训练集及验证集中影像组学模型对于Ⅰ期与Ⅱ期PLEL的鉴别均具临床优势。b)基于影像组学模型鉴别原发性下肢淋巴水肿Ⅱ、Ⅲ期,灰线表示假设所有患者都是Ⅱ期水肿的决策曲线,黑线表示假设没有患者是Ⅱ期水肿的决策曲线,红线表示训练集,绿线表示验证集,DCA显示在训练集及验证集中影像组学模型对于鉴别Ⅱ期与Ⅲ期PLEL均具临床优势。
讨 论
PLEL是慢性进行性淋巴回流障碍性疾病,疾病初期患者肢体肿胀程度较轻,随时间发展程度逐渐加重[10]。目前ISL临床分期是目前世界上公认的从临床角度评估下肢淋巴水肿严重程度的可靠方法。Ⅰ期水肿时,随肢体抬高肢体肿胀可消退,这是由于淋巴管运输的大分子蛋白质在肢体皮下间质中积聚,无纤维化以及脂肪增生,此期采用综合减充血疗法(complex decongestive therapy,CDT)能够很好地减轻症状;当患者进入Ⅱ期,按压肢体出现明显凹陷,仅抬高肢体并不能完全减轻组织肿胀,这是由于长时间的淋巴滞留会引起炎症反应,促使局部组织纤维化和脂肪组织增生肥大,此期仅采用CDT往往效果不佳,需要联合手术治疗;当患者到达Ⅲ期,皮肤及皮下纤维组织及肥大的脂肪组织进一步增生、沉积,皮肤明显纤维化而丧失弹性,肢体在肿胀基础上逐渐出现皮肤变化,甚至在晚期出现象皮病,此期患者多采用直接切除手术,对肢体的损害较大,患者的预后差[11]。因此,下肢淋巴水肿的临床ISL分期与治疗密切相关,准确评估患者分期,在早期给予准确诊断和及时干预,对改善患者症状及延缓疾病进展极为重要。
近年来,MRI由于其无创性、高软组织分辨率以及能够显示整个下肢内液体浸润的能力,使其成为评估PLEL严重程度的最佳影像学方法,其中STIR序列能够消除脂肪组织的高信号,从而可较敏感和准确地识别水肿的范围及严重程度[12-14]。Wang等[15]通过测量脂肪抑制MRI图像上小腿水肿区的面积,发现其对下肢淋巴水肿的诊断及分期均具有较高的效能。在前期研究中,我们发现基于MRI的厚度等定量指标和影像学表现对PLEL的临床分期均具有一定的预测价值[16-17],但传统的MRI影像分析无法提取病灶区域异质性等微观信息,而且部分影像征象在疾病晚期才能够观测到,对于早期PLEL的诊断价值有限。
影像组学通过自动或者半自动方法从影像图像中可重复提取肉眼无法识别的海量的微观影像特征,如异质性、形状、纹理和密度等,随后进行特征筛选及模型的建立[18-19]。目前有关淋巴水肿的影像组学研究较少[20-22]:Son等[20]建立了一种基于机器学习自动识别下肢淋巴水肿患者CT图像中纤维化的算法;Wu等[21]开发和验证一系列基于机器学习算法的模型预测中国女性乳腺癌相关性淋巴水肿的发生风险。基于这些研究,本研究中尝试基于STIR序列构建影像组学模型,用于预测PLEL的临床分期。在本研究中,影像组学模型在训练集中具有较高的鉴别价值,在验证队列中具有良好的预测效能。本研究中用来构建鉴别PLEL Ⅰ期与Ⅱ期放射组学模型的10个特征中,有1个是一阶特征,9个是纹理特征;在构建鉴别PLEL Ⅱ期与Ⅲ期的放射组学模型中有10个组学特征,其中有2个是一阶特征,1个是形态特征,7个是纹理特征。其中,表面积与体积比(Surface Volume Ratio)对鉴别Ⅰ期与Ⅱ期的价值最大;小区域重点(Small Area Emphasis)及一阶特征中第90百分位数(90Percentile)对鉴别Ⅱ期与Ⅲ期的价值最大,因为他们均具有较高的特征系数。这些细微的纹理差异反映了不同分期的PLEL患者水肿区的异质性特征方面存在差异,而这种差异很难通过对MRI图像的肉眼观察来识别。此外,DCA结果表明影像组学模型对鉴别PLEL Ⅰ期与Ⅱ期及Ⅱ期与Ⅲ期均能够获得较高的临床收益。本研究中构建的PLEL不同临床分期的分类诊断模型,有望成为辅助临床医师进行准确诊断的工具,可促进对不同程度PLEL患者进行个体化精准治疗。
本研究存在一定的局限性:①ROI为人工勾画,可能存在一定的误差;②没有建立包括病程、性别和年龄等一般临床资料在内的临床模型和综合模型,在今后的研究中将进一步增加临床资料进行更全面和深入地研究。③本研究是回顾性研究,病例数有限,未来会纳入更多的病例进行验证,以提高该模型的特异性和敏感性。④本研究中选择10个病变范围最大的横轴面图像进行分析,而不是对全下肢的病变区域提取影像组学特征,因为整个下肢病变的三维分割非常复杂和耗时。⑤本研究中未进行组学特征的测量稳定性的评估。
总之,基于下肢STIR-MRI的影像组学模型能够鉴别PLEL的临床分期,可以作为一种有效的工具辅助影像及临床医师更准确地评估疾病的严重程度,在早期给予准确诊断和及时干预,有助于改善患者的症状、延缓疾病进展。
