凋落物真菌Neocucurbitaria salicis-albae及其代谢产物的抗细菌活性
2024-04-23刘瑶赵吴超杨骁寇雨心都婷婷陈秀青秦梦飞徐利剑
刘瑶,赵吴超,杨骁,寇雨心,都婷婷,陈秀青,秦梦飞,徐利剑
(黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
真菌作为自然界重要的自然资源,分布范围极其广泛,其物种的多样性十分丰富,而且在生态系统中也扮演了分解者等重要作用。随着自然条件的变化和生物种群的繁衍,真菌作为自然界不可缺少的一部分,真菌的多样性及组成也在不断变化,从而使得真菌物种丰富,功能多样。真菌物种数量非常庞大,目前估计有220 万至380 万种真菌,而已经命名的真菌仅20 万种左右,其中多数真菌的活性与用途未被深入研究,所以真菌被认为是重要的未被深入开发的自然资源[1]。
真菌的次生代谢物作为天然产物,已经在工业、医药、食品等诸多方面表现了很好的应用潜力,因此,森林凋落物真菌资源逐渐受到重视[2-4]。2019—2022年,在大兴安岭森林凋落物中共报道真菌334 株,其中91株为尚未被描述的真菌[5-7],张哲栋等[4]在2株凋落物真菌中分离出4个单体化合物,其中有3个单体化合物具有抗菌活性,有2 个化合物为首次从真菌的提取物中分离得到。SI等[8]在1株真菌中得到5个单体化合物,且都具有抗菌活性,其中3 个单体化合物为新结构化合物。甄锦程等[9]在3株凋落物真菌中,共分离8个化合物,其中2个表现了抗菌活性,并且含有2个新化合物。以上研究表明大兴安岭真菌资源丰富,可以产生具有抗菌活性的化合物,但研究不够广泛与深入,目前尚有大量真菌资源未被尝试开发利用。
为了获得大兴安岭森林凋落物中未开发的真菌及其抗菌化合物,为防治植物病害提供备选菌株及其抗菌化合物,本研究从大兴安岭森林凋落物中分离鉴定了一株Neocucurbitaria属真菌SGSF801,并从其发酵物中分离、纯化并鉴定了一个具有抗植物病原菌活性的抗菌化合物,为大兴安岭森林凋落物真菌资源的利用,提供了理论依据。
1 材料与方法
1.1 供试材料
1.1.1 样品采集本研究的凋落物样品采自于大兴安岭地区[2]。该地区主要的植物为樟子松(Pinussylvestris),兴安落叶松(Larixgmelinii),水曲柳(Fraxinus mandshurica)白桦(Betulaplatyphylla)等。以每层4 cm至8 cm 的深度采集凋落物的样品,共采集A、B、C 三层。将所采集的样品分别装入已经灭菌过的信封袋里,对其进行自然风干,然后放入箱中保存。
1.1.2 供试微生物植物病原细菌:水稻黄单胞菌水稻致病变种(Xanthomonasoryzaepv.oryzae),丁香假单胞杆菌(Pseudomonassyringae),青枯劳尔氏菌(Ralstonia solanacearum),植物病原真菌:细交链格孢菌(Alternariatenuis),立枯丝核菌(Rhizoctoniasolani),用于抗菌活性测试。供试培养基MEA、OA、PD、PDA、SM、SMAY、YMA 与大米培养基等,培养基配方参考邱天艺等[10]的研究。
1.2 试验方法
1.2.1 凋落物真菌的分离运用颗粒涂布平板法[11]对凋落物真菌进行分离。将所采集到的森林凋落物样品充分研磨至小颗粒状,随后将其配置成悬浮液,按照一定梯度稀释涂布在1/4 PDA培养基上,放置在25℃培养箱中进行培养,隔12 h观察一次,在无菌操作台中挑出刚萌发的菌落至PDA培养基上,进行真菌的培养纯化。
1.2.2 凋落物真菌的鉴定运用CTAB法[12]获取真菌的DNA,采用引物ITS1 及ITS4 扩增其内部转录间隔区序列(Internal Transcribed Spacer,ITS),选用引物LR0R和LR5 扩增其核糖体大亚基基因序列(nuclear large subunit rDNA, LSU),选用引物Bt2a 和Bt2b 扩增其β-微管蛋白基因序列(β-tubulin,TUB2)。其中PCR 扩增的体系和及引物序列等信息参见GAO 等[13]的方法。经过测序,运用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行真菌基因序列比对分析,确定该凋落物真菌的分类学地位。在形态学观察方面,通过观察在不同培养基上菌落颜色、质地和分泌物,以及观察产孢结构和孢子的形状、大小等特征,和相近真菌文献进行比较,进行形态学鉴定。
1.2.3 菌株发酵及提取物制备 首先把菌碟接种在SMAY培养基中,放置于摇床里在180 r/min,25℃条件下振荡培养3 d,然后分别吸取200µL菌液,接种到20 mL体系的SM、PD、PDA 及大米培养基中进行菌株发酵。SM、PD发酵置于摇床180 r/min,25℃条件下培养14 d,PDA及大米培养基发酵置于25℃静置培养21 d。真菌发酵结束后,加入20 mL 的乙酸乙酯,充分混匀,然后静置24 h,通过减压浓缩得到发酵提取物,使用1 mL的10%的二甲基亚砜(Dimethyl sulfoxide,DMSO)作为溶剂,得到真菌发酵物的提取物溶液。
1.2.4 粗提物的抗菌活性测定运用打孔药剂扩散法[14]测定真菌的抗菌活性。抗植物病原细菌:将摇好的菌液加入到温度在50℃的LBA培养基中,倒平板后静置4 h,待其凝固后用打孔器均匀打6 个孔。取10µL 发酵提取物溶液,加入孔中。抗植物病原真菌:用打孔器在PDA平板上均匀的打6个孔,中间接种植物病原真菌菌碟,其余同上。
1.2.5 化合物的分离与鉴定利用大米培养基进行扩大发酵,利用乙酸乙酯进行提取。将浓缩粗提物与等量的100~200 目硅胶混合均匀。风干上样进行柱层析,使用二氯甲烷与甲醇溶液梯度洗脱,每个梯度洗脱2 L溶液,得到洗脱样品S1~S30。利用薄层层析(TLC)法合并相似组分[15],采用葡聚糖凝胶Sephadex LH20 层析柱,二氯甲烷与甲醇1:1比例配置洗脱溶液,洗脱流速约为8 s一滴。利用半制备液相(C18反向硅胶柱)甲醇-水系统进行制备,HPLC 进行化合物纯度检测,获得高纯度的单体化合物。随后进行核磁共振氢谱(1HNMR)分析与碳谱(13C-NMR)分析,查阅文献,鉴定其结构。
1.2.6 单体化合物测定最低抑菌浓度参照张哲栋等[4]研究方法。使用96 孔板对化合物最低抑菌浓度(Minimum Inhibitory Concentration,MIC)进行测定,首先将单体化合物溶于5%的DMSO 溶液中溶解,然后倍半稀释至不同浓度,添加至96孔板,3次重复,5%的DMSO 与金霉素分别作为对照。密封于25℃的培养箱中,进行黑暗培养,24 h后开始观察结果。
2 结果与分析
2.1 凋落物真菌的分离与鉴定
从森林凋落物中分离出真菌SGSF801,经多序列相似性分析,其最相近菌种为Neocucurbitariasalicisalbae(表1)。真菌SGSF801 在PDA 培养基上呈现橄榄绿色,YMA上呈白棕色,可产生厚垣孢子,与报道的形态学特征[16]存在一定的差异。真菌形态学观察结果如图1 所示,结合分子鉴定结果,初步将其鉴定为N.salicis-albae的新株系。
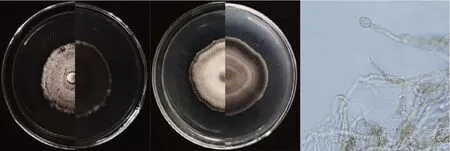
图1 形态学观察

表1 多序列相似性分析结果
2.2 凋落物真菌的生长速率分析
通过比较4 种培养基不同温度下的生长速率,发现SGSF801 在OA 培养基上菌落生长速度最快,其最适生长温度为20℃至25℃。不同培养基及不同温度的生长直径如表2所示。

表2 不同培养基及不同温度的生长直径 mm
2.3 粗提物的抗菌活性测定
SGSF801菌株粗提物的抗菌活性测定结果如表3所示。在抗植物病原细菌活性方面,4 种培养基发酵的粗提物都表现了不同程度的抗丁香假单胞菌和青枯劳尔氏菌的活性,在抗真菌方面,大米培养基粗提物表现了抗立枯丝核菌的活性,综合比较选择大米培养基作为扩大发酵培养基。

表3 抗菌活性测定
2.4 单体化合物的结构
对SGSF801菌株进行大米培养基发酵,得到16.8 g粗提物。通过对粗提物抗菌活性追踪分离得到1个单体化合物。该化合物的13C-NMR(101 MHz,CDCl3)共有16 个峰,化学位移值为δ 201.68、197.57、191.61、178.15、169.38、166.05、158.07、154.99、105.46、103.77、101.50、99.21、93.81、58.73、31.91、27.69。经文献查询,该化合物的13C-NMR与1H-NMR波谱数据与化合物尾孢酰胺(Cercosporamide)的数据一致[17],其分子式为C16H13NO7,其结构式如图2所示。

图2 单体化合物化学结构
2.5 单体化合物的MIC值测定结果
利用植物病原细菌青枯劳尔氏菌和丁香假单胞菌,对单体化合物进行了MIC的测定,结果显示该单体化合物对青枯劳尔氏菌的MIC值为31.25~62.5 μg/mL,对丁香假单胞菌的MIC值为125~250 μg/mL。
3 结论与讨论
大兴安岭森林凋落物中具有大量未开发利用的真菌资源[5-7],本研究在大兴安岭森林凋落物中,分离鉴定了 一 株 真 菌N.salicis-albaeSGSF801。Neocucurbitaria菌属隶属于Cucurbitariaceae 菌科,该属由WANASINGHE 等[18]建立于2017年,目前包括22个物种,可以腐生在灌木与乔木上。N.salicis-albae是由CROUS 等[16]基于其ITS、LSU 及TUB2 等序列分析结果,建立于2019 年,最初该物种发现于乌克兰的白柳(Salixalba)树枝上,形态学观察发现该菌可以产生棕色球形分生孢子器,分生孢子为近圆柱形至梭形。菌株SGSF801虽然未见产生分生孢子器与分生孢子,但经ITS、LSU 及TUB2 多序列分析发现SGSF801 的最相近菌种为N.salicis-albae,ITS与LSU的相似性都超过了99%,但是TUB2 其相似的相似性为97.54%与已知株系存在差异,由此将其鉴定为N.salicis-albae的新株系。关于Neocucurbitaria菌属的天然产物化学方面,HU 等[19-20]在N.unguis-hominis提取物中分离到15个二萜类新化合物,但未见这些化合物具有明显的抗菌活性,尚未见关于N.salicis-albae天然产物的报道。本研究首次尝试分离N.salicis-albae的天然产物,在其大米发酵提取物中鉴定了一个抗菌化合物尾孢酰胺,该研究丰富了Neocucurbitaria菌属的次生代谢物数据。尾孢酰胺最初分离于Cercosporidium henningsii[21],后来也发现于真菌Verruculinaenalia中[17],尾孢酰胺曾被发现可以选择性地作用于Pkc1激酶,具有开发成广谱型抗真菌药物的潜力[22],但尚未见尾孢酰胺抗植物病原细菌丁香假单胞菌与青枯劳尔氏菌的报道,本研究为首次在Cucurbitariaceae 菌科真菌中发现尾孢酰胺,并且还证明了尾孢酰胺在离体情况下具有抗植物病原细菌的活性,但是否能在活体植株上表现出相同活性还有待进一步验证。在对SGSF801的次生代谢物分离过程中,还发现了两个类似萜类的化合物,且在预试验中表现出了抗菌活性和抗线虫活性,由于条件有限未能纯化出单体化合物,关于凋落物真菌SGSF801 的次生代谢产物的研究还有待深入。
综上所述,本研究在森林凋落物上分离、培养、鉴定了N.salicis-albae的一个新株系,在它的大米发酵物中分离鉴定了1 个抗菌化合物——尾孢酰胺,并首次发现该化合物具有抗丁香假单胞菌与青枯劳尔氏菌的活性,其MIC为31.25~250 μg/mL。本研究结果,丰富了关于Cucurbitariaceae菌科尤其是Neocucurbitaria属真菌抗菌次生代谢物的研究,为进一步开发利用大兴安岭凋落物真菌资源奠定了基础。
