氟喹诺酮类药物免疫分析方法的研究进展
2024-04-22王雪晴陈秀金李兆周王耀安彪白玉冰代明慧陈佳琪
王雪晴,陈秀金,2,3*,李兆周,2,3*,王耀,2,3,安彪,白玉冰,代明慧,陈佳琪
1(河南科技大学 食品与生物工程学院,河南 洛阳,471000)2(河南省食品绿色加工与质量安全控制国际联合实验室,河南 洛阳,471000)3(食品加工与安全国家级实验教学示范中心,河南 洛阳,471000)
氟喹诺酮类药物(fluoroquinolones,FQs)是一类人工合成的抗菌药物,抗菌谱广,对革兰氏阴性菌和革兰氏阳性菌均有抗菌活性[1],被认为是目前最有效的抗感染药物之一,广泛用于家畜、水产养殖动物和宠物病菌感染的防治。目前市场上广泛使用的氟喹诺酮类药物有二氟沙星(difloxacin,DIF)、沙拉沙星(sarafloxacin,SAR)、培氟沙星(pefloxacin,PFL)、环丙沙星(ciprofloxacin,CIP)、诺氟沙星(norfloxacin,NOR)、恩诺沙星(enrofloxacin,ENR)、洛美沙星(lomefloxacin,LMX)、达氟沙星(danofloxacin,DAN)等20多种。长期以来,FQs在动物饲养过程中的过度使用,造成了食品中的FQs残留超标,若经常摄入这种食物,会导致体内耐药病原菌的产生,增加耐药性的风险[2]。为了保障消费者的利益,国家标准GB 31650—2019 《食品安全国家标准 食品中兽药最大残留限量》中规定了各种FQs在食品中的最大残留限量(maximum residue limits,MRLs),其中达氟沙星在牛、羊、家禽肌肉中的MRLs为200 μg/kg;二氟沙星在牛、羊、猪肌肉中的MRLs为400 μg/kg;恩诺沙星在猪、兔、家禽肌肉中的MRLs为100 μg/kg;沙拉沙星在鸡、火鸡肌肉中的MRLs为10 μg/kg。另外中华人民共和国农业农村部公告[第2292号]发布,禁止在动物养殖中使用洛美沙星、培氟沙星、氧氟沙星、诺氟沙星等兽药。
迄今为止,用于检测FQs的方法有高效液相色谱法[3]、超高效液相色谱-质谱法[4]、毛细管电泳法[5]、微生物检测法等[6]。仪器检测法的灵敏度高、准确性好,但存在样品前处理步骤复杂、设备昂贵的缺点。微生物检测法具有操作简便、仪器投入少、重复性好的优点,但易出现假阳性现象,耗时长,且无法准确定量,因此只适于对大批量样品进行粗筛,难以满足食品安全快速检测的需求。免疫分析法具有特异性强、灵敏度高、快速简便等特点,广泛用于喹诺酮类药物残留的检测。近年来,PAN等[7]对食品和环境样品中喹诺酮类药物的免疫分析方法的研究进展进行了报道。蔡新发等[8]发表了FQs免疫分析方法的研究进展,文章总结了2018年以前国内的相关研究概况。本文主要对近5年来国内外FQs免疫分析法的研究进展进行综述,以期为FQs免疫检测技术的开发和应用提供理论支撑。
1 FQs的抗体制备
FQs分子质量<1 000 Da,只有反应原性而无免疫原性,这类小分子物质在免疫学上被称为半抗原,与载体蛋白偶联后得到完全抗原。完全抗原诱导机体产生免疫应答可获得相应的抗体。抗体制备是建立FQs免疫分析方法的关键,抗体类型包括多克隆抗体、单克隆抗体和单链抗体等。
1.1 多克隆抗体的制备
多克隆抗体是一种受多种抗原决定簇刺激而产生的多种抗体混合物,具有制备简单、生产成本低的特点。刘向辉等[9]采用碳二亚胺法将洛美沙星半抗原与牛血清白蛋白偶联制备免疫原,免疫新西兰大白兔,获得一种至少能识别11种FQs的抗体,检测限低于10 ng/mL。李彬彬等[10]用氧氟沙星制备的免疫原,免疫BALB/c小鼠,获得氧氟沙星多克隆抗体,其半数抑制浓度(fifty percent inhibitory concentration,IC50)为19.97 ng/mL。汝晓飞等[11]合成了马波沙星人工抗原,免疫BALB/c小鼠,制备马波沙星的多克隆抗体,其IC50为90.2 ng/mL。韩振宇[12]将诺氟沙星与载体蛋白偶联获得人工抗原,通过免疫,制备诺氟沙星多克隆抗体。李源珍[13]用诺氟沙星、环丙沙星、沙拉沙星和氧氟沙星通过活性酯法与牛血清白蛋白偶联,制备免疫原,通过免疫,获得了同时识别诺氟沙星和氧氟沙星的抗体,诺氟沙星的IC50为0.73 ng/mL,氧氟沙星的IC50为0.2 ng/mL。GALVIDIS等[14]以沙拉沙星偶联蛋白质作为人工抗原,制备沙拉沙星多克隆抗体,测得抗体的IC50为0.25 ng/mL。
1.2 单克隆抗体的制备
单克隆抗体是由单一B细胞克隆产生的高度均一、仅针对某一特定抗原决定簇的抗体。刘劲涛[15]采用氧氟沙星人工抗原免疫小鼠,选择检测效价高、抑制好的小鼠进行细胞融合,通过筛选,获得了3株分泌氧氟沙星单克隆抗体的细胞株,命名为C9、B2和A10,其IC50分别为3.85、6.25、6.96 ng/mL。王雅洁[16]将氟罗沙星与载体蛋白偶联制备人工抗原,免疫小鼠,纯化腹水得到氟罗沙星的单克隆抗体,其IC50为1.28 ng/mL。TOCHI等[17]合成氧氟沙星人工抗原,免疫小鼠,并采用体内诱生法制备腹水,产生抗氧氟沙星的单克隆抗体,其IC50为1.17 ng/mL。汝晓飞[18]以洛美沙星为半抗原,用碳二亚胺法和混合酸酐法制备人工抗原,获得洛美沙星单克隆抗体,IC50为1.10 ng/mL。ZHANG等[19]制备了培氟沙星的单克隆抗体,测得其IC50为0.902 ng/mL。黄美[20]制备了诺氟沙星人工抗原,免疫小鼠,制备了诺氟沙星的单克隆抗体,其IC50为0.45 ng/mL。
1.3 单链抗体的制备
单链抗体属于第三代抗体,是通过短肽拼接抗体重链可变区和轻链可变区片段而获得的,由于其具有分子小、免疫原性低、可体外大批生产的优点,逐渐在免疫分析法中广泛应用。WANG等[21]利用分子对接方法在虚拟突变结果的基础上,将重组抗沙拉沙星单链抗体的接触氨基酸Tyr99定向突变为His,进化出沙拉沙星单链抗体。该抗体对12种氟喹诺酮类药物的亲和力显著提高,灵敏度比突变前提高了7倍。康牧旭等[22]将环丙沙星和恩诺沙星的单克隆抗体通过聚合酶链式反应获得相应的单链抗体,其亲和常数达到了108,说明所制备的环丙沙星和恩诺沙星单链抗体亲和力比较理想。张运尚等[23]采用噬菌体展示技术构建免疫小鼠噬菌体库,经过筛选后将分离出的阳性抗体转入大肠杆菌BL21中进行表达。采用分子对接的方法对单链抗体进行虚拟突变,根据虚拟突变的结果,将单链抗体与氧氟沙星结合的关键氨基酸残基(甲硫氨酸209)突变为谷氨酰胺后,降低了抗原抗体的总结合能,提高了单链抗体突变体的结合能力。
2 氟喹诺酮类药物免疫分析法
2.1 酶联免疫吸附法
酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)是将抗原-抗体反应的特异性和酶的高效性相结合而开发的一种方法。MUKUNZI等[24]借助2,2′-乙烯二氧双乙胺将培氟沙星与牛血清白蛋白偶联,免疫小鼠,制备抗体,建立了检测鸡肌肉样品中FQs残留的间接竞争ELISA。在优化条件下,对培氟沙星的半数抑制浓度IC50为0.2 ng/mL,检测限为0.082 ng/mL。该方法还能同时检测鸡肌肉中其他9种FQs靶标物质,检测范围为0.2~4 ng/mL。LI等[25]用司帕沙星偶联载体蛋白制备免疫原,免疫动物,筛选抗血清,建立了检测蜂蜜中司帕沙星的间接竞争ELISA。在最佳条件下,测得司帕沙星的IC50为0.12 ng/mL,检测限为0.02 ng/mL。WANG等[26]通过噬菌体文库的构建和定向进化,获得了一种抗环丙沙星单链抗体(single chain antibody fragment,scFv)突变体。基于亲本scFv和突变scFv分别建立了环丙沙星的间接竞争-ELISA,结果表明,基于突变scFv建立的ELISA比用亲本scFv建立ELISA灵敏度提高了16.6倍,且突变体scFv的亲和力也得到显著提高,得出该方法可用于动物源性食品中环丙沙星的超灵敏测定。
2.2 免疫层析法
免疫层析法(immunochromatography assay,ICA)是一种以毛细管吸附作用力为动力,通过目标物与检测线(test line,T线)和控制线(control line,C线)上的生物受体发生特异性反应,检测结果以线条的形式显示出来的方法。目前,用于免疫层析法的信号标记物有金纳米粒子(gold nanoparticles,AuNPs)[27]、金-银纳米粒子(Au-Ag nanoparticles,Au-AgNPs)[28]、碳纳米材料[29]、量子点(quantum dots,QDs)[30]、磁纳米粒子(magnetic nanoparticles,MNPs)[31]、上转化纳米粒子(upconversion nanoparticles,UCNPs)[32]等。
2.2.1 金标免疫层析法
金标免疫层析法(gold immunochromatography assay,GICA)是一种以金纳米颗粒为标记物的免疫层析法。PENG等[33]开发了一种能够快速检测牛奶中FQs残留的胶体金免疫层析试纸条。试验用诺氟沙星衍生物和沙氟沙星衍生物的混合物作为半抗原制备了一种可识别32种FQs的广谱性单克隆抗体,然后用羊抗鼠抗体和包被原(沙氟沙星偶联卵清蛋白)分别喷膜形成C线和T线,试验表明所研制试纸条可在10 min内同时对32种FQs进行检测,该方法的消线值为1.0~100 ng/mL,检测限为0.1~10 ng/mL,为现场筛选牛奶中FQs残留提供了一种有用的方法。HENDRICKSON等[34]以金纳米粒子作为标记物,建立了一种同时检测乳制品中环丙沙星和氯霉素的免疫层析法。该方法可在15 min内完成检测,其仪器检测限分别为20 pg/mL和0.5 ng/mL,可视消线值均为0.5 ng/mL。乳制品中环丙沙星和氯霉素的回收率为83%~120%。YANG等[35]建立了一种快速检测牛奶中达氟沙星的金标免疫层析法,该方法的检测限为0.092 ng/mL,与HPLC法的验证结果无显著差异。
2.2.2 荧光免疫层析法
荧光免疫层析法(fluorescence immunochromatography assay,FICA)是一种将荧光检测体系与抗原抗体反应相结合建立起来的新型膜条层析法。LIU等[36]研制了一种以量子点微球为标记物的荧光免疫层析法,用于检测环丙沙星,检测限为0.05 ng/mL,检测范围为0.1~100 ng/mL。YANG等[37]用碳二亚胺法将单克隆抗体和羧基化的CdSe/ZnS量子点偶联制成荧光探针,建立了检测氟罗沙星的荧光免疫层析法,用于检测猪肉中氟罗沙星的残留,其消线值为2.5 ng/mL。陈俊珺[38]将含有稀土元素铕的荧光微球分别与二甲基嘧啶和诺氟沙星的单克隆抗体偶联得到荧光免疫标记物,建立了可同时检测二甲基嘧啶和诺氟沙星的时间分辨荧光免疫层析法,研究得出,诺氟沙星在猪肉样中的检测范围为2.74~18.70 μg/kg、在虾肉样中检测范围为2.37~85.22 μg/kg和在鸡蛋检测范围为4.68~16.54 μg/kg。由于荧光微球具有时间分辨和波长分辨优势,不受背景荧光干扰,故大大提高了免疫层析法的灵敏度。
2.2.3 表面增强拉曼光谱免疫层析法
表面增强拉曼光谱(surface enhanced raman spectroscopy,SERS)免疫层析法是借助SERS的高灵敏度和光谱选择性,结合抗原抗体的特异性识别作用和金属纳米粒子的表面增强特性,发展起来的一种新型免疫分析方法。现已用于食品中FQs的残留检测。SHI等[39]利用所建立的SERS免疫层析法对诺氟沙星(norfloxacin,NOR)和新霉素(neomycin,NEO)进行了超灵敏检测。如图1所示,试验在AuNPs的表面连接拉曼信号分子4-氨基苯硫酚(4-aminothiophenol,PATP),分别制备拉曼免疫探针NOR mAb-AuNPs-PATP和NEO mAb-AuNPs-PATP,组装试纸条,同时对诺氟沙星和新霉素进行检测。该法测得诺氟沙星的检测限为0.55 pg/mL,借助SERS对免疫层析试纸条进行检测,能大幅提高免疫层析法检测的灵敏度,也为其他小分子残留物的高灵敏检测提供新思路。

a-SERS多联试纸检测示意图;b-T1、T2、C线的反应示意图图1 基于AuNPs-PATP标记的免疫层析原理图[39]Fig.1 Schematic representation of AuNPs-PATP tags-based immunochromatography[39]
2.3 化学发光酶免疫分析法
化学发光酶免疫分析法(chemiluminescence enzyme immunoassay,CLEIA)是将化学发光测定技术和酶免疫分析技术相结合的检测方法,其灵敏度和可靠性更高。ZENG等[40]通过帕珠沙星衍生的免疫半抗原,制备广谱性抗体,建立了检测牛奶中FQs残留的间接竞争化学发光酶免疫法,对FQs的检测限为0.10~33.83 ng/mL。曹敬政等[41]建立了一种能够检测动物源性食品中多种氟喹诺酮类药物残留的直接竞争化学发光酶免疫法,对诺氟沙星、培氟沙星、环丙沙星、恩诺沙星、洛美沙星、那氟沙星、达氟沙星、依诺沙星、氧氟沙星和麻保沙星共10种FQs的IC50为1.46~11.57 ng/mL,检测限为0.07~0.27 ng/mL,实现了对上述10种FQs残留的同时检测。PEI等[42]建立了一种以氢氧化钴纳米片为过氧化物纳米酶取代HRP发挥催化放大信号作用的流动注射化学发光免疫法,并成功应用于家禽及水产品中恩诺沙星的高灵敏检测,线性范围0.000 1~1 000 ng/mL,检测限为0.041 pg/mL。
2.4 荧光免疫分析法
荧光免疫分析法(fluoroimmunoassay,FIA)是一种将免疫反应的特异性和荧光标记的高灵敏性相结合的检测方法。目前,用于荧光免疫分析的标记物有荧光素、量子点[43]、上转换荧光纳米粒子[44]、镧系元素螯合物铽[45]、铕[46]等。根据检测原理不同,FIA被分为时间分辨荧光免疫分析法(time-resolved fluoroimmunoassay,TRFIA)和荧光偏振免疫分析法(fluorescence polarization immunoassay,FPIA)等。
2.4.1 时间分辨荧光免疫分析法
时间分辨荧光免疫分析法是一种对镧系元素螯合物发出的荧光信号进行检测的免疫分析方法。ZHANG等[47]利用牛血清白蛋白与环丙沙星偶联合成免疫原,免疫动物,制备了一种能识别12种FQs的群选性单克隆抗体。以诺氟沙星与卵清蛋白偶联物为包被原,建立了测定环境水体中12种FQs的时间分辨荧光免疫分析法。该方法对12种FQs的检测限为0.051~0.10 ng/mL,测得的总FQs浓度与液相色谱-串联质谱法测得的结果一致,可用于直接评估案例区地表水中FQs的存在和环境风险,在环境风险评价中具有巨大潜力。
2.4.2 荧光偏振免疫分析法
荧光偏振免疫分析法(fluorescence polarization immunoassay,FPIA)是一种通过荧光素标记抗原,并与游离抗原竞争性地与抗体结合,引起2种免疫标记物旋转运动差异,从而造成其荧光偏振度发生变化的新型免疫分析法。CHEN等[48]将帕珠沙星(pazufloxacin,PAZ)和异硫氰酸荧光素异构体(fluorescein isothiocyanate isomer,FITC)合成异源示踪剂(PAZ-FITC),该示踪剂和克林沙星竞争性地与抗克林沙星抗体结合,首次建立了一种检测羊奶中克林沙星残留的异源FPIA,该方法的IC50为29.3 ng/mL,比同源荧光偏振免疫法的IC50值低了6倍。SHEN等[49]开发了一种检测水中恩诺沙星的FPIA。研究合成了3种具有不同间隔基的荧光素(氨基荧光素、硫氨基乙二胺荧光素和硫氨基己二胺荧光素)标记恩诺沙星,得到标记物A、B和C,通过比较,手臂最长标记物C显示出最好的灵敏度。在此条件下,恩诺沙星的检测限为1.68 ng/mL,交叉反应性小于2%,对猪肝和鸡肉样品的添加回收率分别为91.3%和112.9%。该方法不需要样品预处理,免疫测定过程只需8 min,比ELISA的检测时间短得多。另外FPIA将免疫反应过程从异质(固液相)转变为均质(液相),无分离步骤,提高了反应效率。
2.4.3 其他荧光免疫分析法
此外,有研究者建立了其他荧光标记物(如荧光素)的免疫分析法。如YU等[50]开发了一种直接竞争性双荧光素酶生物发光免疫测定法(dual-luciferases competitive direct bioluminescent immunoassay,DBL-dcELISA),实现了只需添加底物一步反应,便可同时检测出20种FQs和21种磺胺类药物2类小分子,对FQs的检测限为0.178~41.428 ng/mL。DBL-dcELISA不仅简化了信号产生和收集程序,而且能够以简单的程序快速同时检测各种小分子,这对于开发多残留免疫分析方法具有重要意义。KERGARAVAT等[51]建立了一种间接竞争磁荧光酶免疫分析法,用于筛选牛奶中的FQs。阳性奶样中的FQs与磁珠固定的FQs将竞争性地与抗体结合,然后加入酶标二抗及其相应底物,通过酶催化底物反应,产生荧光信号。该方法能对7种FQs进行定量检测,其中环丙沙星和马波沙星检测限分别为10 ng/mL,恩诺沙星和达氟沙星检测限分别为13 ng/mL,诺氟沙星检测限为22 ng/mL,沙拉沙星检测限为29 ng/mL,氧氟沙星检测限为30 ng/mL,表明该方法可用于牛奶中FQs的常规检测。
2.5 免疫传感器
免疫传感器是利用抗原-抗体的特异性反应导致传递信号发生变化所建立的生物传感器。根据检测原理不同,将免疫传感器分为电化学免疫传感器、光学免疫传感器、表面等离子体共振免疫传感器等。
2.5.1 电化学免疫传感器
电化学免疫传感器是将免疫反应与电化学检测相结合所建立起来的传感器,通过使用安培、电势、阻抗或电导换能器来量化目标分析物。电化学传感器的分析速度快、灵敏度高、响应时间短、微型化和自动化能力强,因此被广泛用于FQs残留的检测。电化学免疫传感器近年来在FQs残留检测中的应用,具体见表1。

表1 电化学免疫传感器在FQs残留检测中的应用Table 1 Application of electrochemical immunosensor for the detection of FQs residues
由表1可知,电化学免疫传感器已用于牛奶、猪肉、鸡肉、鸭肉、水等样品中的FQs残留检测。现用于检测FQs残留的电化学免疫传感器的纳米材料有AuNPs[52-53]、石墨烯[54]、氧化钒纳米粒子[58]等。其中,AuNPs有很大的比表面积,有利于增大识别分子的吸附面积;石墨烯具有高导电性和高比表面积的优势,可用于修饰电极,提高电极的电子传递速度;氧化钒的介孔结构和大表面积可促进电解液离子扩散和电荷转移;综上可见,纳米材料用于检测FQs的电化学免疫传感器将会提高传感器的灵敏度和实用性。
2.5.2 表面等离子体共振免疫传感器
表面等离子体共振(surface plasmon resonance,SPR)免疫传感器是一种通过抗原抗体在金属表面结合引起光学反射率发生变化而产生SPR信号的检测方法。SPR免疫传感器已用于恩诺沙星残留的检测,试验原理见图2。
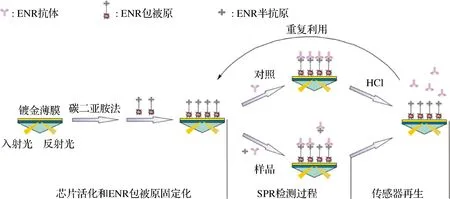
图2 检测ENR的SPR免疫传感器原理图[61]Fig.2 Schematic diagram of the SPR immunosensor for ENR detection[61]
当恩诺沙星与SPR传感器芯片上的抗体结合时,会引起镀金薄膜表面的反射率发生变化,使金属表面等离子体共振,引起入射角发生改变,有效地检测结合到金属介质表面上的恩诺沙星,从而实现对恩诺沙星的检测。该方法的IC50为3.8 ng/mL,检测限1.2 ng/mL,检测时间6 min[61]。SARI等[62]以甲基丙烯酸为功能单体,采用微乳液聚合技术合成分子印迹纳米颗粒,对SPR芯片表面进行修饰,建立了检测环丙沙星的SPR仿生免疫传感器,该传感器对环丙沙星的检测限为7.1 ppb。李树莹等[63]研制了一种新型平面波导免疫传感器,建立了恩诺沙星和诺氟沙星的同时快速检测方法。待测样品溶液和荧光染料标记抗体溶液通过传感器预反应槽,流向免疫芯片,待测样品中的抗原与芯片表面的抗原竞争结合荧光染料标记抗体,采用倏逝波激发荧光染料产生荧光,测量荧光强度定量检测FQs。该方法测得恩诺沙星检测限为0.34 ng/mL,诺氟沙星的检测限为0.14 ng/mL,检测周期仅需15 min。SPR免疫传感器结合了SPR技术和免疫分析技术的优点,无需标记直接感知抗体捕获目标物时信号的变化,为食品中FQs的残留检测提供了一种准确、灵敏、稳定、自动化的方法。
2.5.3 其他免疫传感器
此外,还有免疫传感器用于氟喹诺酮类药物的检测。如YUAN等[64]建立了一种基于氧化蚀刻银纳米棱镜(silver nanoprisms,AgNPRs)的等离子体间接竞争ELISA免疫传感器,实现了对食品中达氟沙星(danofloxacin,DAN)的定量和定性检测(检测原理见图3)。当样品中不存在DAN时,生物素-葡萄糖氧化酶通过链霉亲和素被生物素-抗DAN单克隆抗体复合物捕获,与葡萄糖反应生成H2O2,使AgNPRs被蚀刻,颜色从深蓝色变为无色。反之,当样品中存在DAN时,DAN竞争性地与生物素-抗DAN单克隆抗体结合,阻止其与包被原结合,溶液中就不会生成H2O2,AgNPRs就不会被氧化,则保持原来的形态和蓝色。该方法对DAN定量检测限为0.24 ng/mL,定性检测限为0.32 ng/mL,该方法与传统的间接竞争ELISA相比,定量检测限和定性检测限分别降低3倍和32倍。

图3 用于DAN定量和定性检测的AgNPRs蚀刻免疫传感器原理图[64]Fig.3 Schematic of the proposed AgNPRs etching immunosensor for the quantitative and qualitative detection of DAN[64]
3 结论与讨论
由于FQs的化学结构相似,例如沙拉沙星、二氟沙星、环丙沙星、恩诺沙星、诺氟沙星等都含有一个六元杂环芳香环、一个羧酸基、一个酮基、一个氟基和一个哌嗪环。因此,制备抗体时,有可能产生与这些FQs具有交叉反应性的广谱特异性抗体。基于广谱性抗体建立的免疫学检测方法,实现同时对几种甚至十几种FQs的快速检测。当样品的检测结果为阳性时,表明样品中可能含有与抗体具有交叉反应性的FQs中一种或者多种,所以该方法往往只用于初筛。因此,免疫分析法测出的阳性样品,通常需要用其他方法进行验证。
ELISA方法具有高通量、高灵敏和低成本的优点,但也存在重现性差,易受复杂基质影响的缺点[65]。免疫层析法具有简便、快速和价廉的优点,尤其适用于现场检测。其中,胶体金在免疫层析方法中得到了广泛的应用,但也存在较多的缺陷,如易受基质干扰而导致检测结果准确性较差,检测灵敏度低等[66]。荧光免疫层析法的灵敏度高,但标记抗体的有机染料标记物在光照下易分解并发生光漂白现象,影响了分析结果的准确性和可靠性[67]。SERS免疫层析法因需要SERS仪,提高了检测成本。采用荧光素或荧光纳米材料标记抗体,会降低抗体活性。另外,食品基质中部分有机物存在荧光效应,会对FQs荧光检测造成背景干扰。而时间分辨荧光纳米材料能够避免基质中背景荧光的干扰,具有更高的灵敏度,一直是研究的热点[68]。免疫传感器具有微型化、自动化、可再生和易商业化的优点已被证明,然而纳米材料修饰电极的重现性和稳定性不足,受食品基质干扰大。因此,提高信号放大的再现性和基于纳米材料的信号放大是未来研究的重点[69]。总之,在FQs免疫分析中引入纳米酶、纳米膜、金属纳米簇等新型纳米材料,有望解决食品复杂基质干扰问题和提高方法的灵敏度。同时将FQs免疫分析法与微流控芯片技术(或智能检测系统)相结合,促使其向高通量、智能化、高灵敏和多重检测的方向发展。