曲妥珠单抗与帕妥珠单抗在人表皮生长因子受体2 阳性乳腺癌患者中的应用分析
2024-04-22王敏
王敏
(淄博市第四人民医院(淄博市传染病医院)肿瘤四科,山东淄博 255000)
乳腺癌是乳腺上皮细胞在多种致癌因子作用下出现的增殖失控现象,严重危及了女性的健康与生命安全[1]。 有调查显示,15%~20%的乳腺癌患者存在人表皮生长因子受体2(HER2)过表达或基因扩增的情况,此类患者恶性程度、复发与转移的可能性相对较高,预后较差[2]。 目前,抗HER2 药物是治疗HER2 阳性乳腺癌的新型药物。 曲妥珠单抗属于单克隆抗体,不仅可以与HER2 结合, 抑制细胞信号传递, 下调HER2 受体表达,阻断癌细胞的生长,还可以促进免疫细胞对抗并杀灭肿瘤细胞[3]。 帕妥珠单抗属于第2代抗HER2 药物,通过与HER2 结合,阻滞了HER2与其它HER 受体的杂二聚,减缓肿瘤生长[4]。基于此,选取该院2020 年5 月—2023 年4 月收治的80 例乳腺癌HER2 阳性患者为对象,探讨曲妥珠单抗与帕妥珠单抗在此类患者中的联合应用效果。 现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的80 例乳腺癌HER2 阳性患者为研究对象。纳入标准:参照《人表皮生长因子受体2 阳性乳腺癌临床诊疗专家共识》[5]中HER2 阳性乳腺癌的诊断标准确诊;具有可以测量的病灶;Karnofsky 功能状态评分>70 分;预计生存时间>6 个月;患者及其家属对于本次研究知情同意。 排除标准:存在凝血功能异常;合并其他恶性肿瘤;存在肝、肾功能不全;存在自身免疫性疾病; 患有急性或慢性感染性疾病;患者精神异常。 本研究已获院医学伦理委员会审批。 按照随机数字表法将研究对象分为对照组与研究组,各40 例。 对照组患者均为女性;年龄37~69 岁,平均年龄(51.30±5.80)岁;美国癌症联合委员会(AJCC)第8版[6]乳腺癌临床分期为Ⅰ期13 例,Ⅱ期17 例,Ⅲ期10 例。 研究组患者均为女性;年龄36~69 岁,平均年龄(51.35±5.70)岁;临床分期为Ⅰ期15 例,Ⅱ期15例,Ⅲ期10 例。 两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
两组患者均接受常规新辅助化疗,即155 mg/m2紫杉醇(江苏恒瑞医药股份有限公司,国药准字H20183378)联合0.9%氯化钠注射液500 mL,静脉滴注,1 h 内完成滴注,1 次/d;卡铂(齐鲁制药有限公司,国药准字H20020181)0.3 g/m2联合0.9%氯化钠注射液或5%葡萄糖注射液250 mL,静脉滴注,0.5~1 h 内完成滴注,1 次/d。 1 个化疗周期为21 d,共治疗4个周期。
对照组采用曲妥珠单抗(美国Genentech Inc.,国药准字J20180073)治疗,初次用药量为8 mg/kg,静脉滴注,1.5 h 内完成滴注,1 次/d,1 个疗程为21 d,第3 个疗程开始将药物用量调整为6 mg/kg,共治疗4 个疗程。
研究组在对照组的基础上联用帕妥珠单抗(德国Roche Diagnostics GmbH,注册证号S20180029)治疗,初次用药量840 mg,静脉滴注,1 次/d,1 个疗程为21 d, 从第2 个疗程开始将药物用量调整为420 mg,共治疗4 个疗程。
1.3 观察指标
(1)客观缓解率:根据实体瘤疗效标准(RECIST)1.1[7]标准进行评价,其中病灶增加≥20%或见新病灶为进展;病灶缩小≥30%且维持4 周及以上为部分缓解;病灶增大<20%,缩小<30%为稳定;病灶全部消失,未见新病灶,血清肿瘤标志物检测正常,维持时间在4 周及以上为完全缓解。 客观缓解率=(部分缓解+完全缓解)/总例数×100%。
(2)血清肿瘤标志物:分别在治疗前与治疗后采集患者的静脉血样本5 mL,高速离心3 500 r/min,时间10 min,半径8 cm,分离血清后以双抗体夹心化学发光法对血清肿瘤标志物糖类抗原153 (CA153)、癌胚抗原(CEA)进行检测。
(3)不良反应:包括血液系统异常、心脏毒性、胃肠道反应、过敏反应、肝肾损伤。
1.4 统计方法
采用SPSS 26.0 统计学软件进行数据分析。 计量资料以(±s)表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验;计数资料以[n(%)]表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组客观缓解率对比
研究组客观缓解率高于对照组,差异有统计学意义(P<0.05)。 见表1。

表1 两组乳腺癌HER2 阳性患者客观缓解率对比[n(%)]
2.2 两组血清肿瘤标志物对比
治疗前,两组CEA、CA153 水平对比,组间差异无统计学意义(P>0.05);治疗后,两组CEA、CA153 水平均低于治疗前,且研究组低于对照组,差异有统计学意义(P<0.05)。 见表2。
表2 两组乳腺癌HER2 阳性患者血清肿瘤标志物对比(±s)

表2 两组乳腺癌HER2 阳性患者血清肿瘤标志物对比(±s)
注:与同组治疗前对比,aP<0.05。
组别CEA(μg/L)治疗前 治疗后CA153(U/mL)治疗前 治疗后研究组(n=40)对照组(n=40)t 值P 值55.82±5.20 55.79±4.98 0.290 0.773 15.82±2.65a 20.08±2.55a 7.326 0.000 39.50±4.58 39.65±4.40 0.149 0.882 13.02±2.52a 18.10±2.08a 9.833 0.000
2.3 两组不良反应对比
两组过敏反应、胃肠道反应、血液系统异常、心脏毒性、肝肾损伤发生率对比,组间差异无统计学意义(P>0.05)。 见表3。
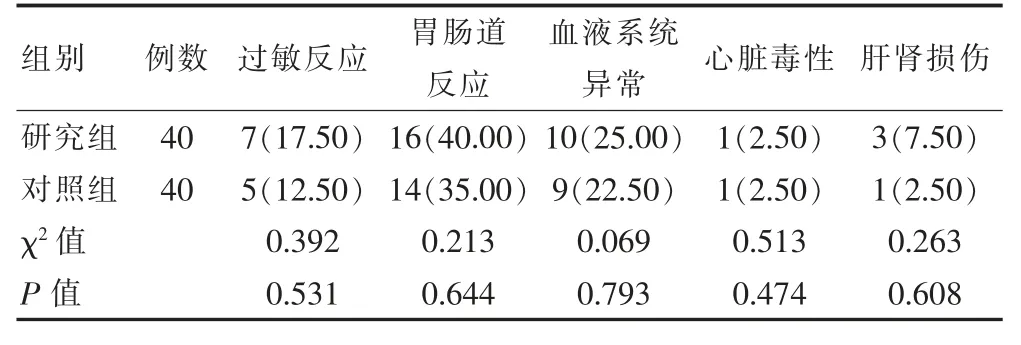
表3 两组乳腺癌HER2 阳性患者不良反应对比[n(%)]
3 讨 论
目前,靶向药物已在HER2 阳性乳腺癌患者中得到了广泛的应用。 曲妥珠单抗是一种单克隆抗体,其能够识别P185 糖蛋白并选择性地与其结合, 靶向性作用于HER2 受体过度表达的细胞,抑制HER2 阳性肿瘤细胞生长,以及肿瘤细胞的相互作用[8]。有研究发现,曲妥珠单抗能够限制肿瘤细胞的生长,使肿瘤细胞发生退缩或完全退化[9]。帕妥珠单抗是一种HER 二聚化抑制剂, 与HER2 结合后可以阻滞配体依赖的HER 异源二聚体形成,减少HER2 胞内信号传导,抑制肿瘤的侵袭与增殖[10]。 同时,帕妥珠单抗可以与不同于曲妥珠单抗的HER2 表位结合,进一步提高抗肿瘤活性[11]。
学者刘恒等[12]采用帕妥珠单抗与曲妥珠单抗联合新辅助化疗对41 例乳腺癌HER2 阳性患者进行治疗,本组临床总缓解率高达90.2%。本研究结果显示,研究组客观缓解率高于对照组(P<0.05),且治疗后CEA、CA153 水平均低于对照组(P<0.05)。 研究结果说明,曲妥珠单抗能够在HER2 细胞外部发挥出特异性的作用, 抑制HER2 过度表达导致的肿瘤细胞增殖, 而帕妥珠单抗结合于HER2 二聚化结构域后,能够靶向阻断HER2 与其他相关受体的异二聚化途径,且与曲妥珠单抗联合应用后可以在无竞争状态下与HER2 结合, 从不同机制对HER2 信号进行双重抑制,全面阻断了HER2 下游信号的传导效应,继而发挥出协同抗肿瘤的功效, 进一步抑制血清肿瘤标志物,提高HER2 阳性乳腺癌患者的客观缓解率[13-14]。从安全性来看,张凤龙等[15]采用曲妥珠单抗联合帕妥珠单抗方案治疗15 例HER2 阳性乳腺癌患者, 结果发现联合用药的不良反应发生率与单纯曲妥珠单抗治疗组结果相当。本研究结果还显示,两组过敏反应、胃肠道反应、血液系统异常、神经毒性、肝肾损伤发生率对比,组间差异无统计学意义(P>0.05)。 这说明曲妥珠单抗与帕妥珠单抗联合应用并未增加用药风险,安全性较为满意。 需要注意的是,心脏毒性是曲妥珠单抗已知的不良反应表现,临床用药过程中应尽量避免使用具有心脏毒性的药物, 以免药物不良反应叠加,增加治疗风险[16]。
综上所述,曲妥珠单抗与帕妥珠单抗联合应用能够提高HER2 阳性乳腺癌患者的客观缓解率,抑制血清肿瘤标志物。 本次研究未进行随访,所以关于曲妥珠单抗与帕妥珠单抗联合治疗对于HER2 阳性乳腺癌患者远期生存率的影响仍需要进一步论证。
