迷迭香酸抑制荷瘤小鼠H22肝癌移植瘤生长的作用机制
2024-04-21曹雯莫凯潘金凤韦斯军王振宁尹园
曹雯,莫凯,潘金凤,韦斯军,王振宁,尹园
肝癌是世界上癌症相关发病率和病死率最高的恶性肿瘤之一,尽管目前有许多化疗方法可用于肝癌的治疗,但其在发挥抗肿瘤作用同时会对机体产生一定的毒性作用[1]。迷迭香酸是一种天然多酚类化合物,是迷迭香、肿节风等中药的有效活性成分,具有抗炎、抗氧化、调节免疫等多种药理学活性[2]。近年研究表明,迷迭香酸在乳腺癌、结直肠癌、肝癌等疾病中能发挥良好抗肿瘤作用[3-5]。本研究通过建立H22肝癌荷瘤小鼠模型,观察迷迭香酸对荷瘤小鼠肿瘤的抑制作用及其对肿瘤免疫微环境的影响。
1 实验对象、试药与仪器
1.1 实验动物及细胞 昆明小鼠,雄性,6~8周龄,体质量(20±2)g,购自湖南斯莱克景达实验动物有限公司(动物许可证号:SCXK-2019-0004)。动物饲养环境温度(25±2)℃,湿度40%~70%,在12 h黑暗/12 h光照同期动物设施中适应性喂养1周后开始实验。动物实验经广西中医药大学实验动物福利伦理委员会批准(批准号SYXK-2019-0001)。小鼠H22肝癌腹水细胞购自上海吉凯基因医学科技股份有限公司。
1.2 药物与试剂 迷迭香酸(纯度>97%,上海麦克林生化科技有限公司,批号C11552095);注射用环磷酰胺(江苏恒瑞医药股份有限公司,批号21102825);流式凋亡试剂盒(碧云天生物技术有限公司,批号C1062);小鼠CD3e APC-Cy7抗体(批号557596)、CD4 APC抗体(批号553051)、CD8a PerCP-Cy5.5抗体(批号551162)均购自BD Pharmingen公司;小鼠干扰素-γ(IFN-γ)(批号20220910)、肿瘤坏死因子-α(TNF-α)(批号20220910)、白介素-10(IL-10)(批号20221010)ELISA试剂盒均购自Bioswamp公司。
1.3 主要仪器 本研究所用主要仪器包括CytoFLEX型流式细胞仪(BECKMAN COULTER公司),AMR-100型酶标分析仪(杭州奥盛仪器有限公司),TD4离心机(上海卢湘仪离心机仪器有限公司),BX-53光学显微镜(日本奥林巴斯)等。
2 方 法
2.1 荷瘤小鼠模型的建立、分组及给药 在无菌条件下抽取腹水传至3代的H22细胞,加入0.9%氯化钠注射液调整细胞浓度为1.5×107/ml用于小鼠皮下移植瘤接种,每只小鼠右侧腋部皮下接种0.2 ml细胞悬液(3×106/只),建立荷瘤小鼠模型。将接种小鼠随机分为模型组、环磷酰胺组(CTX)、迷迭香酸组,每组5只。CTX组予注射用环磷酰胺20 mg/kg腹腔注射,隔天1次;迷迭香酸组灌胃给予迷迭香酸500 mg/kg,模型组灌胃给予等体积0.9%氯化钠注射液,每天1次,3组均连续给药14 d。
2.2 检测肿瘤体积、重量及免疫器官指数 末次给药24 h后称量体质量,颈椎脱臼处死小鼠,剥离肿瘤、胸腺、脾脏组织并称重,计算免疫器官指数;游标卡尺测量肿瘤长径(a)和短径(b),计算肿瘤体积。脏器指数=器官重量(mg)/体质量(g);肿瘤体积=(a×b2)/2。
2.3 苏木精—伊红染色法(HE)观察肿瘤组织病理变化 肿瘤组织在4%多聚甲醛中固定48 h后,脱水,常规蜡块包埋,切片,HE染色,于显微镜下观察肿瘤组织病理变化。
2.4 流式细胞术检测脾脏T细胞百分数及凋亡率 取小鼠脾脏,将脾脏剪成小块后磨碎,制备单细胞悬液,向细胞悬液中加入红细胞裂解液混匀,4 ℃放置5 min,10 000 r/min,4 ℃离心1 min,吸去红色上清液;再用PBS洗2次,1 000 r/min离心5 min后,收集白色细胞沉淀。孵育FCR阻断剂后,加入CD4 APC、CD8a PerCP-Cy5.5和 CD3e APC-Cy7抗体,室温避光孵育30 min。上机前,加入5 μl Annexin V-FITC和10 μl碘化丙啶染色液,轻轻混匀,室温避光孵育15 min。将处理好的样品进行流式细胞仪检测,并使用FlowJo V10软件分析。
2.5 ELISA法检测肿瘤组织中免疫细胞因子水平 取适量肿瘤组织制备10%肿瘤组织匀浆,离心后取上清液。ELISA法检测肿瘤组织中IFN-γ、TNF-α和IL-10水平,实验步骤根据试剂盒说明书操作,在450 nm波长下用酶标仪测定吸光度。
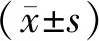
3 结 果
3.1 肿瘤生长情况、免疫器官指数比较 给药14 d后,CTX组和迷迭香酸组的肿瘤重量和体积低于模型组(P均<0.01);迷迭香酸组小鼠体质量、胸腺指数和脾脏指数与模型组比较差异无统计学意义(P>0.05);CTX组小鼠体质量和胸腺指数低于模型组(P均<0.01),脾脏指数与模型组比较差异无统计学意义(P>0.05),见表1。

表1 3组荷瘤小鼠肿瘤生长情况、免疫器官指数比较
3.2 肿瘤组织病理变化比较 HE切片染色结果显示,模型组小鼠肿瘤组织中肿瘤细胞分布密集且数目丰富,坏死细胞较少;CTX组肿瘤细胞数明显减少,细胞排列稀疏,肿瘤细胞坏死较多;迷迭香酸组出现肿瘤细胞凋亡和坏死,肿瘤细胞数目减少。
3.3 脾脏中T淋巴细胞比较 CTX组脾脏组织中CD3+、CD4+水平高于模型组(P均<0.05),CD8+水平、CD4+/CD8+与模型组比较差异无统计学意义(P>0.05);迷迭香酸组CD4+水平、CD4+/CD8+高于模型组,CD8+水平低于模型组(P<0.05或P<0.01),CD3+水平与模型组比较差异无统计学意义(P>0.05),见表2。

表2 3组荷瘤小鼠脾脏中T淋巴细胞比较
3.4 脾脏中CD3+、CD4+凋亡率比较 CTX组荷瘤小鼠脾脏组织中CD4+、CD8+凋亡率高于模型组,迷迭香酸组CD4+凋亡率低于模型组,CD8+凋亡率高于模型组(P<0.05或P<0.01),见表3。

表3 3组荷瘤小鼠脾脏CD3+、CD4+凋亡率比较
3.5 肿瘤组织中免疫细胞因子水平比较 CTX组与迷迭香酸组肿瘤组织中IFN-γ水平高于模型组,TNF-α、IL-10水平低于模型组(P<0.05或P<0.01),见表4。

表4 3组荷瘤小鼠肿瘤组织中免疫细胞因子水平比较
4 讨 论
肝癌是恶性肿瘤最常见的死亡原因之一,其发展过程通常会伴随体内免疫系统的异常,肿瘤免疫抑制微环境在肝癌发展进程中发挥重要作用[6]。迷迭香酸是一种具有广泛药理学作用的多酚羟基酸,前期研究表明,迷迭香酸对肝癌移植瘤的生长有抑制作用,但其在肿瘤免疫微环境方面的作用机制尚未完全阐明[7]。本实验结果发现迷迭香酸能有效抑制荷瘤小鼠移植瘤生长,减轻肿瘤重量,减少肿瘤组织细胞数,提示迷迭香酸具有抗肿瘤作用。胸腺和脾脏是免疫细胞增殖分化的场所,是重要的免疫器官,其发育状态会直接影响机体免疫功能[8]。本研究结果显示迷迭香酸组小鼠的体质量以及免疫器官指数与模型组相比无显著差异,提示迷迭香酸对机体免疫器官无明显影响。
在肝癌发展过程中,肝癌细胞可通过抑制免疫细胞功能及免疫细胞因子分泌等多种途径形成肿瘤免疫抑制微环境,使肿瘤细胞逃避机体的抗肿瘤免疫应答,促进其免疫逃逸[6]。抗肿瘤免疫应答以细胞免疫为主,T淋巴细胞是特异性免疫反应的重要细胞,主要包括CD4+T细胞和CD8+T细胞,两者动态平衡是维持免疫系统稳定的关键。CD4+主要代表辅助性T细胞(Th),可分为Th1和Th2细胞,Th1细胞在体内主要分泌免疫促进因子,可直接杀伤肿瘤细胞,增强抗肿瘤免疫反应[9]。CD8+可分化为免疫抑制性细胞,起到负调控作用。CD4+/CD8+比值的下降提示机体免疫功能受到抑制,加速肿瘤细胞生长。临床研究表明,肝癌患者通常有明显的CD4+/CD8+比值下降,导致免疫系统功能紊乱,加速肿瘤生长。本实验结果显示迷迭香酸能通过升高CD4+T细胞百分数和降低CD8+T细胞百分数,升高CD4+/CD8+比值;同时,迷迭香酸还可降低CD4+T细胞凋亡率,升高CD8+T细胞凋亡率。提示迷迭香酸可通过调节免疫细胞改善机体免疫系统功能及肿瘤免疫抑制微环境,抑制肿瘤细胞生长。
此外,免疫细胞因子也是肿瘤免疫抑制微环境形成的主要因素。IFN-γ是一种由Th1细胞分泌的免疫促进因子,能直接抑制肿瘤细胞生长,增强免疫细胞的抗肿瘤免疫反应[10]。而IL-10则是Th2细胞分泌的免疫抑制因子,其分泌量增加会抑制Th1细胞增殖和IFN-γ分泌,体内Th1/Th2比例失衡会加速机体免疫抑制状态,诱导肿瘤细胞的免疫逃逸。肿瘤细胞还可通过增加TNF-α表达水平,促进炎性递质释放,抑制免疫细胞的抗肿瘤活性,促进肿瘤细胞免疫逃逸和转移[11]。本研究结果显示,迷迭香酸可使肿瘤组织中IFN-γ水平升高,同时降低IL-10和TNF-α水平,提示迷迭香酸可通过调节免疫细胞因子的分泌,改善机体免疫抑制微环境。
综上所述,迷迭香酸可抑制H22肝癌移植瘤的生长,其机制可能为通过调节免疫细胞功能和免疫细胞因子合成与释放,改善机体肿瘤免疫抑制微环境,减少肿瘤细胞免疫逃逸,发挥抗肿瘤作用。
利益冲突所有作者声明无利益冲突
