QoI类杀菌剂抗药性机制和治理研究进展
2024-04-19周辰炎刘庆李金丽
周辰炎 刘庆 李金丽
(天津农学院园艺园林学院,天津 300392)
Quinone outside inhibitors(QoI)类杀菌剂作用于线粒体呼吸链复合物III,可以结合在内膜外壁的氧化位点Qo上,阻止复合物III中电子从细胞色素b(Cytochromeb,Cyt b)到细胞色素c1(Cyt c1)的传递,从而抑制病原真菌ATP的产生,使菌体缺乏能量而造成生理生化紊乱致死。QoI类杀菌剂是从天然产物嗜球果伞素A(Strobilurin A)衍生合成而来,是一类广谱、高效、安全、促生的新型仿生型杀菌剂[1]。根据化学基团的不同,杀菌剂抗性行动委员会(FRAC)将QoI类杀菌剂分为9类,常用的有甲氧基丙烯酸酯类(如嘧菌酯Azoxystrobin,啶氧菌酯Picoxystrobin和唑菌酯Pyraoxystrobin)、甲氧基氨基甲酸酯类(如吡唑醚菌酯Pyraclostrobin)和氨基乙酸酯类(如醚菌酯Kresoxim-Methyl和肟菌酯Trifloxystrobin)等。根据是否存在交互抗性,QoI类杀菌剂被分为2个亚组,即代码11组和11A组,目前除了甲萘威(Metyltetraprole)属于11A组,其余均属于11组。甲氧基丙烯酸酯类作为活性成分较高的第1大类,嘧菌酯则是第1代被开发的此类杀菌剂,该药剂自1996年上市以来,截至目前在杀菌剂行业中依旧维持着不可撼动的销量[2]。
尽管QoI类杀菌剂效果显著,被广泛应用于病原真菌,但随之出现的抗药性问题以及后续治理仍是不可避免的。由于其作用靶标位点单一,极易受病原物单基因或寡基因突变的影响,从而使病原物产生抗药性,目前已被FRAC列入高等抗药性风险。自1998年,德国北部报道了首例抗醚菌酯的小麦白粉病菌株,至今在全球范围内已出现了大量QoI类杀菌剂抗药性菌株[3]。早年间,我国杀菌剂不合理使用和抗性治理不完善等现象导致了此类杀菌剂的抗药性风险比国外高[4]。此外,由于QoI类具有特殊的广谱杀菌活性,世界上绝大多数作物或瓜果上的病原菌受到了影响,且对于同类杀菌剂的施用还会产生交互抗性而生成更加耐药群体,故目前对于该靶标位点新药的研发进程是一个巨大挑战。本文重点在于阐述QoI类杀菌剂抗药性机制和提出相应的抗性治理措施,从而为延缓病原菌抗药性的产生,保障和提高农作物的品质和产量,新型药剂的开发提供新思路。
1 QoI类杀菌剂的抗药性机制
根据全球监测数据显示,至今已存在多达36种的植物病原菌对QoI类杀菌剂呈现不同水平的抗药性,由于施用嘧菌酯和吡唑醚菌酯而产生抗药性的病原菌占多数[3]。
大量研究表明,病原菌对QoI类杀菌剂产生抗性的机制主要有3种:靶标位点突变,旁路氧化途径和多重抗药性相关蛋白的过表达,如图1所示。相较于其他2种作用机制,靶标位点的突变具有遗传性,在病原菌长期演化过程中占据主导地位,这也是抗药性监测中最重要的1项依据指标。
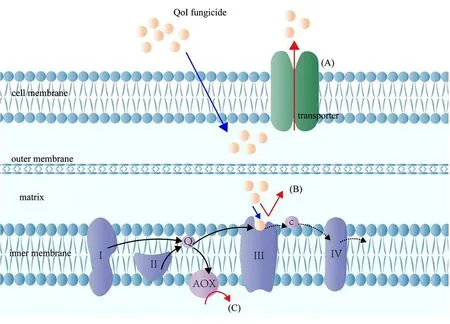
注:(A)为运输体蛋白对QoI杀菌剂分子的外排作用;(B)为靶标位点的突变导致结合位点与QoI类杀菌剂的亲和力降低;(C)为AOX途径。图1 植物病原真菌对QoI类杀菌剂的抗性分子机制
1.1 靶标位点突变
已有报道显示,QoI类杀菌剂的抗药性主要与靶标线粒体复合体Ш细胞色素b基因高度保守区第1个区域(氨基酸位点125~155)的点突变有关,其中单点突变G143A和F129L导致的对应氨基酸的蛋白空间构象变化,从而降低了与药剂的结合性是抗性产生的常见原因。研究表明,G143A突变会使复合体III Qo结合口袋变窄,从而降低与嘧菌酯的结合性,而F129L突变则干扰杀菌剂药效基团与结合位点之间的作用力[6]。G143A是抗性菌株中普遍存在的1个突变位点,研究表明,G143A突变能够赋予多种植物病原真菌高等水平抗性,并且多数情况下的G143A突变株具有遗传稳定性,能够发展为优势种群。如,在田间突变体与敏感参考菌株有性杂交的灰霉(Botrytis cinerea)子囊孢子后代中,G143A类型的抗性基因可以母系稳定遗传[7];Wang等[8]通过连续传代培养黄瓜黑星病菌(Corynespora cassiicola)发现,菌落直径和孢子数量在G143A突变体中并没有发生显著变化。
根据近年来的QoI类杀菌剂的抗药性监测结果显示,多数的抗性突变体在Cyt b上存在多位点突变[9-17],如表1所示。如,对嘧菌酯耐药的稻瘟病菌(Magnaporthe oryzae)突变体中,G143S与G143A的突变比达8∶1;G143S、G137R和M296V 3个点突变赋予了M.oryzae对肟菌酯的抗性;小麦褐斑病(Pyrenophora tritici-repentis)种群中存在G143A、F129L和G137R的不同抗性水平的突变位点,在欧洲等地也监测到了这3种类型的突变位点[10];在曲霉菌(Aspergillus uvarum)分离株监测到含有S108A、F129L和A194V 3个突变位点[13]。由此可见,随着药剂选择压的增加,病原菌产生的适应性变异使靶标位点突变的多样性和可变性的趋势更加明显。

表1 QoI类杀菌剂抗药性菌株在Cyt b上的突变类型
1.2 旁路氧化途径
旁路氧化途径(Alternative oxidase,AOX)也称交替氧化途径,普遍存在于多种高等植物、真菌、藻类和原生动物中。AOX途径是除细胞色素途径外,真菌和高等植物线粒体的另一呼吸电子传递链,以旁路氧化酶AOX为末端氧化酶。AOX途径可直接接受辅酶Q传来的电子传递到氧生成水,而不经过复合物Ⅲ和复合物Ⅳ 2个ATP能量合成位点,因而形成较少的ATP,从而导致真菌对杀菌剂的敏感性降低[5]。已有研究证实,AOX途径编码基因aox的表达水平参与调控真菌对一些杀菌剂的抗药性,在常见病原真菌核盘菌属(Sclerotinia spp.)和核果类褐腐病菌(Monilinia fructicola)中,田间或室内诱导抗性突变体均未发现靶标基因cytb的点突变[18,19],故推测其抗药性机制可能与AOX途经有关。
aox基因在不同植物病原真菌中的表达方式不同,aox过表达突变体一般仅出现在高等抗性水平分离株中[20]。当以cytb介导的呼吸途径受阻或线粒体蛋白合成受抑制时,aox表达方式为诱导表达型,这是病原真菌对QoI类杀菌剂产生抗药性的主要原因。有实验研究表明,aox的诱导表达增强了小麦叶枯病菌(Septoria tritici)对嘧菌酯的抗药性,嘧菌酯抗性突变体与敏感菌株相比具有较高的aox表达水平[21];aox参与调控核盘菌(S.sclerotiorum)对啶氧菌酯的敏感性[18];在稻瘟病菌(Magnaporthe grisea)和灰葡萄孢(B.cinerea)中aox基因敲除突变体降低了对嘧菌酯的抗药性[22,23]。此外,AOX途径对Cyt途径抑制剂氰化物不敏感,但对氧肟酸化合物敏感[5],水杨羟肟酸(Salicylhydroxamic acid,SHAM)就是常用的一种AOX抑制剂,所以,SHAM在阻断病原菌的AOX途径,协同增强以复合物III为靶标杀菌剂的防治效果中起重要作用。
1.3 多重抗药性
多重抗药性(Multipledrug resistance,MDR)是指病原物在药剂选择作用下,产生了对多种类型作用机制药剂具有抗性的群体,导致对许多药剂产生敏感性下降的系列问题。细胞内药物外排活性的增强导致了多重抗药性的产生,该活动的载体蛋白主要为ABC运输体蛋白(ATP-binding cassette)和MFS运输体蛋白(Major facilitator superfamily)。ABC蛋白和MFS蛋白普遍存在于所有生物体中,ABC运输体蛋白是真菌细胞膜上的膜转运蛋白,通过结合并水解ATP产生的能量将药物分子外排出胞内,与ABC蛋白不同的是MFS蛋白通过质子驱动力将药物外排出真菌体内[24]。
关于多重抗药性的报道常见于灰霉菌株(B. cinerea)中,灰霉病是我国作物常见真菌病害,因常年受到多种药剂施加处理从而产生多重抗药性。灰霉菌具有3个ABC运输体蛋白(BcatrB、BcatrD、BcatrK)和2个MFS运输体蛋白(Bcmfs1、BcmfsM2),这些运输体蛋白已被证明,是室内或野外突变体中产生MDR的决定因素。Pierre等[25]从法国和德国葡萄园中采集到的MDR灰霉菌菌株中检测到了BcatrB和BcmfsM2的表达,并发现MDR灰霉菌株对大多数杀菌剂均具有一定抗药性,如BcatrB过表达菌株对醚菌胺、吡唑醚菌酯和肟菌酯具有抗性,而BcmfsM2过表达菌株对吡唑醚菌酯和肟菌酯具有抗性,并推测种群内频繁的基因重组可能是产生多重抗药性的主要原因之一。
2 QoI杀菌剂抗药性治理
杀菌剂抗药性治理的实质是以科学的手段最大限度地阻止或延缓抗性群体的形成与发展。基本原则以预防为主,在综合防治中轮换或交替用药。目的是使具有抗药性风险的杀菌剂使用寿命延长,降低抗性种群出现的风险,使敏感种群在病原菌群体中一直处于优势地位,当下一个种植循环中再次使用具有抗药性风险的杀菌剂时,这些杀菌剂仍然具有较好的防治效果。本文结合QoI类杀菌剂的特点,主要介绍3种抗性治理方法降低该类杀菌剂的抗药性风险。
2.1 抗药性快速监测方法
关注病原菌对QoI类杀菌剂的敏感性动态,加强杀菌剂抗药性菌株的田间监测力度,以便于进一步掌握抗性菌株适合度变化程度,解析其抗药性机制,从而对植物病害的合理防控,延缓该类杀菌剂使用寿命及新型药剂创制具有重要基础意义。
基于QoI类杀菌剂的抗药性机制,目前针对靶标位点的突变类型已建立了快速、高效、灵敏的检测方法,可有效验证cytb基因的单核苷酸多态性(Single nucleotide polymorphism,SNPs),如数字液滴法PCR(Digital Droplet PCR)可用于快速检验的常规定量突变,该方法具灵敏性和准确性,对于早期田间抗性菌株的监测十分重要。根据cytb基因突变转换或颠换类型的不同而建立精准高效的监测体系,快速环介导等温扩增(LAMP)技术能够快速检测从而识别突变类型。分子对接(Molecular docking)也是一种快速检测QoI类杀菌剂抗性的方法,该方法可用于判定cytb亚基中蛋白构象改变程度和结合模式[10],如在稻瘟病菌(M.grisea)抗性突变体中,预测到G143S突变减弱了氢键的相互作用,而G137R和M296V改变了肟菌酯分子在Cyt b结合口袋中的构象[12]。在未来,高通量测序或分子检测技术是抗药性快速检测的主要发展方向之一。
2.2 QoI类杀菌剂的合理使用
要关注作物在病害发生前后的概况,做好预测预报,制定综合防治策略,一般推荐在病害发生前使用保护性杀菌剂,在病害发生后使用治疗性杀菌剂,从而减少化学用药过程中病害抗性突变体的产生。针对农作物的种类和杀菌剂的不同类型,做出相应治理措施。有关杀菌剂的合理使用,提出2点建议。
2.2.1 使用多位点杀菌剂的共制剂或交替施用不同类型杀菌剂
虽然药剂混用无法从根本上阻止杀菌剂抗药性的产生,但是可以降低杀菌剂抗药性选择的压力,从而延长杀菌剂的使用寿命。同时,由于QoI类杀菌剂易产生抗药性,因而复配制剂中另一成分应选用不易产生抗性的药物来延长QoI类农药的生命期,或者选取不存在交互抗性的药剂交替使用,从而延缓抗药性的产生。
2.2.2 杀菌剂与助剂或生物制剂的复配,可优化杀菌剂剂型、构型和效果
目前许多研究用于开发农药助剂,这类助剂大多基于缓释剂或控释剂构造,能够有效协助杀菌剂进入病原真菌细胞内,从而从原药总量上减少药物分子的施用,同时能够提供植物所需的微量元素营养。Shan的研究中,铁基多孔金属有机框架(Metal-organic frameworks,MOFs)作为控制杀菌剂释放的载体,搭载了嘧菌酯的MOFs对小麦赤霉病(Fusarium graminearum)和番茄晚疫病(Phytophthora infestans)表现出良好的杀菌活性[26];CuZn和ZnO无机纳米颗粒(Inorganic nanoparticles,INPs)可加工为纳米杀菌剂用来防治灰霉菌(B.cinerea)和核盘菌(S.sclerotiorum),对施药后的植物保护作用和药剂易位有显著影响[27]。使用天然化合物对植物病原真菌进行化学增敏是降低杀菌剂抗性风险和杀菌剂其他负面影响的最具前景的手段之一,近年来研究较多的生防菌有青霉属(Penicillium spp.)、拟青霉属(Purpureocillium spp.)、木霉属(Trichoderma spp.)、枯草芽孢杆菌(Bacillus subtilis)等。毕秋艳等研究显示,枯草芽孢杆菌HMB20428与嘧菌酯有协同增效作用,增强了葡萄霜霉病(Plasmopara viticola)的防治效果[28];橘青霉(Penicillium citrinum)的次生代谢产物能够增强白粉病菌(Parastagonospora nodorum)对嘧菌酯的敏感性[29]。此外,为提高杀菌剂利用率和防效,应当优化药剂剂型和构型,针对不同作物在不同环境条件下选用对应的农药剂型,如粉剂(DP)、可湿性粉剂(WP)、悬浮剂(SC)等,且对施药器材应进行科学校正,防止大面积喷施时产生的药剂漂移等情况。
2.3 发展抗性治理新策略
由于不同作用机制的杀菌剂资源十分有限,近年来新靶标杀菌剂的开发和上市率逐渐下降等问题[5],进一步加剧了现有杀菌剂的使用寿命和抗性治理方面的挑战。因此,新药的开发与选择,及延缓现有杀菌剂的使用寿命仍是抗性治理的关键。
丁香菌酯(Coumoxystrobin)和氯啶菌酯(Triclopyricarb)由我国沈阳化工研究院研发,于2016年在我国登记使用,是近年来取得显著效果的新型QoI类杀菌剂,都位于代码11组。根据FRAC评定的相同组别中的杀菌剂具有直接的交互抗性的特点,丁香菌酯和氯啶菌酯在拥有良好杀菌活性的同时,仍具有中、高抗药性风险,需合理使用。由于QoI类杀菌剂的另一亚组11A与11组之间无交互抗性,这是一个重要的抗药性治理依据,为新构型化合物的筛选提供了有力思路。四唑啉酮类的甲萘威正是目前独属于11A的新型杀菌剂,其关键结构对于QoI类抗性突变体仍然具有高的抑制活性,并且尚未增加G143A抗性分离株的比例[30],未来可根据甲萘威的活性结构和制备路线,研发筛选出其他具有良好杀菌活性且无交互抗性的QoI类杀菌剂。
研发与利用具有负交互抗性的杀菌剂也是抗性治理的新策略。当前对QoI类产生负交互抗性的特殊杀菌剂有醌外Qi位点抑制剂(QiIs)。吡啶酰胺类化合物Fenpicoxamid和Florylpicoxamid是近年来研发的新型QiI类杀菌剂,这类杀菌剂以线粒体呼吸链复合物III的醌还原位点Qi位点为靶标,同样可阻止复合物III中电子从Cyt b传递到Cyt c1,使用该类杀菌剂可以延缓病原体对QoI类抗药性的出现。因此,探索其他杀菌剂与QoI类之间的负交互抗性,以弥补QoI类杀菌剂在抗性菌株中的良好防治作用,也是一个有力的抗性治理思路。
此外,针对不同病原菌和植株的相互作用,加快培育抗病、耐病植株进程仍是可持续农业生产与发展的必要策略。
3 结论与展望
QoI类杀菌剂是防治植物真菌性病害中常用的杀菌剂,目前多种作物或瓜果蔬菜上的病原菌已对其产生抗药性,因此,了解病原真菌对杀菌剂的抗性机制是做好抗药性监测和抗药性治理的前提。相关研究发现,植物病原真菌对QoI类杀菌剂产生抗性的机制主要是靶标位点突变、旁路氧化酶作用和多重抗药性蛋白过表达。抗性突变菌株在靶标位点即细胞色素b基因的Qo位点上常具有G143A、F129L以及其他基因突变类型,现已向多位点突变和突变多样性的趋势发展;旁路氧化酶是抗性菌株绕开细胞色素b途径而进行呼吸链中能量传递的重要酶,表达方式常为诱导表达;多重抗药性的产生一般是指在多种类型杀菌剂的选择压下,病原真菌将过表达产生相应的运输体蛋白,从而将药剂排出细胞内使其免受大部分杀菌剂的干扰。基于近年来抗性种群发展速率的不断提升,提前做好病虫害的预测预报分析,施用高效安全绿色的药剂仍是农作物病害大规模发生的阻断环节。采取综合防治措施,科学合理精准用药,培育抗性植株和持续开发新型靶标药物是当前抗药性治理的根本策略。结合绿色智慧农业,拓宽田间抗性监测技术,建立健全种植体系,带动高素质农户进行科普实践也是发展农业现代化的关键一环。
