安罗替尼联合一线化疗治疗晚期非小细胞肺癌的效果
2024-04-17张红巧索丹风王亚楠
张红巧,索丹风,王亚楠
(郑州大学第五附属医院 肿瘤内科,河南 郑州 450052)
肺癌是全球高发恶性肿瘤,非小细胞肺癌(non-small cell lung cancer,NSCLC)患者确诊时多发展至晚期,常根据指南并结合患者病情开展一线化疗[1]。基于遗传特征的分子分型使晚期肺癌的诊治步入了个体化分子靶向治疗时代。这一进步主要归功于现代生物技术和基因测序技术的快速发展,使我们能够更深入地了解肺癌的遗传基础和分子机制。肺癌的分子分型主要是根据肺癌组织中遗传物质的差异来划分不同的亚型。这些差异不仅体现在基因的突变、重排或表达水平上,还包括与肿瘤生长、转移和耐药性等相关的信号通路和调控机制。通过对肺癌进行分子分型可以更准确地预测患者的疾病进展、预后和治疗效果,从而为个体化的治疗策略提供依据。但将近一半的晚期患者是驱动基因阴性。靶向治疗联合含铂双药化疗方案成为晚期NSCLC一线推荐方案[2]。盐酸安罗替尼可以抑制血管内皮生长因子受体、血小板衍生生长因子受体等激酶,这些激酶在肿瘤血管生成和肿瘤细胞增殖过程中起到重要作用。通过抑制这些激酶的活性,盐酸安罗替尼可以减少肿瘤细胞的血液供应,抑制肿瘤细胞的生长和扩散,且该药现已被证实在晚期NSCLC中的应用安全性良好[3-4]。本研究回顾分析晚期NSCLC患者资料,分析安罗替尼联合化疗一线治疗晚期NSCLC的价值。
1 资料与方法
1.1 一般资料
回顾分析2018年3月至2022年5月郑州大学第五附属医院收治的90例晚期NSCLC患者资料,其中45例接受单纯一线化疗的患者纳入对照组,45例联合安罗替尼治疗的患者纳入观察组。对照组男29例,女16例;年龄45~69(58.47±6.11)岁;体重指数17.5~25.1(19.24±1.36)kg·m-2;腺癌25例,鳞癌20例。观察组男24例,女21例;年龄43~72(59.71±6.66)岁;体重指数17.3~24.8(18.89±1.23)kg·m-2;腺癌22例,鳞癌23例。两组一般资料均衡可比(P>0.05)。
1.2 选取标准
(1)纳入标准:符合NSCLC的诊断标准[5];病历资料完整。(2)排除标准:伴有其他恶性肿瘤;伴有肺栓塞;患有精神疾病或认知障碍;近3个月有手术史;伴无法控制的胸腔积液;失访。
1.3 治疗方法
(1)对照组患者接受化疗一线治疗,即每个化疗周期的第1天静脉滴注多西他赛注射液,剂量为75 mg·m-2(江苏恒瑞医药股份有限公司,国药准字H20020543)与顺铂注射液(剂量为75 mg·m-2)(齐鲁制药有限公司,国药准字H20023460)。(2)观察组在化疗一线基础上口服安罗替尼(正大天晴药业集团股份有限公司,国药准字H20180004),每日服用12 mg,进食早餐前服用,连续用药2周的时候停药1周(若出现漏服时,先确认距下次用药的时间,若<12 h,则不需补服;>12 h,则需补服)。21 d为1个化疗周期,两组均连续治疗4个周期。
1.4 观察指标
(1)治疗效果[6]:完全缓解为目标病灶完全消失;部分缓解为目标病灶缩小>30%;疾病稳定为目标病灶缩小<30%或增大<20%;疾病进展为目标病灶增大>20%或出现新的病灶。(2)肿瘤标志物:采集患者肘部静脉血3 mL,离心10 min(转速3 000 r·min-1),取上层血清,低温保存。通过电化学发光法测定细胞角蛋白19片段抗原21-1(cytokeratin 19 fragment antigen,CYFRA21-1)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)、癌胚抗原(carcinoembryonic antigen,CEA)水平。(3)生存分析:于患者完成第1个化疗周期时开始为期1 a的随访,每月1次电话随访,每3个月1次来院复查随访,随访终点事件为病死。行生存分析后比较两组生存率。(4)不良反应:记录患者自首次用药到化疗结束后30 d内不良反应发生情况,包括胃肠道反应、脱发、肝肾损伤、高血压、乏力、食欲减退等。
1.5 统计学方法

2 结果
2.1 治疗效果
观察组治疗总有效率高于对照组(P<0.05)。见表1。
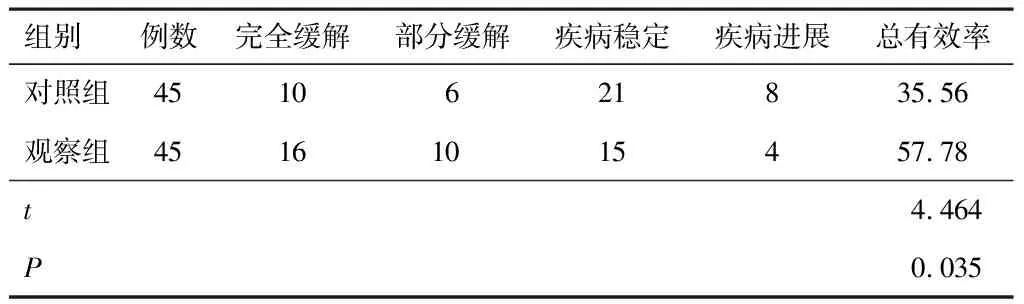
表1 两组患者治疗效果对比(n,%)
2.2 肿瘤标志物
治疗4个周期,两组CYFRA21-1、NSE、CEA均降低,且观察组低于对照组(P<0.05)。见表2。
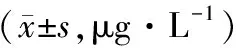
表2 两组肿瘤标志物水平对比
2.3 生存情况
对照组随访生存时间为3~12个月,中位生存时间为8个月;观察组随访生存时间为3~12个月,中位生存时间为12个月,观察组1 a生存率高于对照组(χ2=12.901,P<0.001)。见表3和图1。
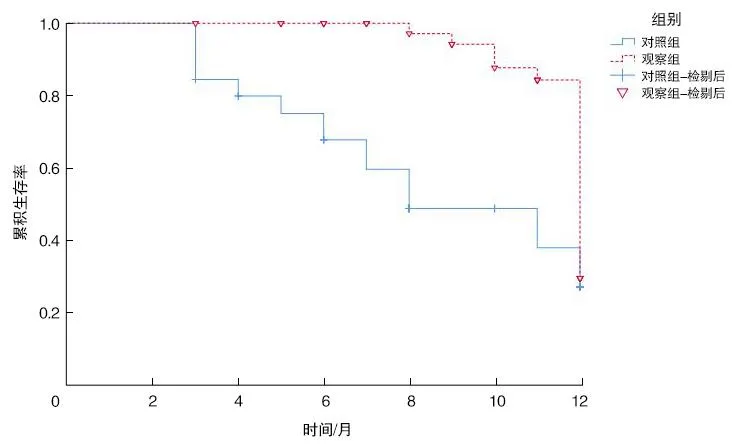
图1 两组晚期NSCLC患者治疗后的

表3 两组患者生存情况对比
生存时间对比
2.4 不良反应
治疗期间,两组化疗药物相关不良反应发生率差异无统计学意义(P>0.05)。见表4。
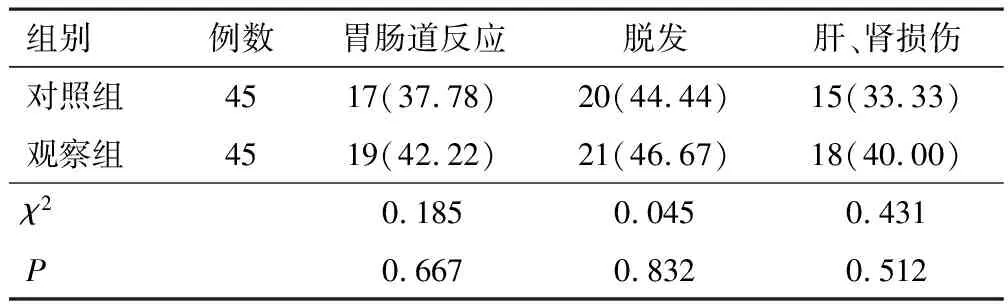
表4 两组患者不良反应对比[n(%)]
3 讨论
多西他赛联合顺铂是目前治疗晚期驱动基因阴性NSCLC常用化疗一线方案,多西他赛是一种紫杉醇类药物,可以通过与肿瘤细胞中微管结合,阻断细胞分裂过程中的微管动力学,抑制肿瘤细胞的增殖和扩散。顺铂是铂类化合物,属于细胞毒性药物,可以与脱氧核糖核酸链交叉连接,形成细胞毒作用,使脱氧核糖核酸链断裂,并干扰其复制和修复过程,诱导肿瘤细胞凋亡[7]。多西他赛与顺铂双药化疗方案能杀灭肿瘤细胞,使晚期NSCLC患者近期获益。然各类靶向治疗药物问世,使晚期无手术机会的恶性肿瘤患者治疗有了新的突破[8]。
相较于传统治疗方式,分子靶向治疗能够延长患者生存时间、改善健康状况,在晚期NSCLC一线化疗中的应用价值已被证实。安罗替尼是一种靶向治疗药物,可以通过抑制酪氨酸激酶融合蛋白的激酶活性,阻断异常信号通路的传导,抑制血管内皮生长因子诱导的血管生成,阻止肿瘤的生长和扩散[9]。本研究发现安罗替尼联合化疗一线治疗晚期NSCLC,可提高整体治疗效果。这可能是因为,在晚期NSCLC患者中,肿瘤通常具有较高的血管密度,可以为肿瘤提供足够的氧气和营养物质,同时也为肿瘤细胞提供更多的途径来扩散到其他部位,而安罗替尼可以抑制血管内皮细胞增殖和血管生成,抑制肿瘤的生长[10-11];联合一线化疗,可直接杀死肿瘤细胞来抑制肿瘤生长,达到相互补充的目的,进而提高治疗效果[12]。
CYFRA21-1、NSE、CEA是由肿瘤细胞释放到血液中的产物,高水平表达表示细胞恶性程度较高。本研究结果显示,治疗4个周期后,观察组CYFRA21-1、NSE、CEA水平低于对照组,说明在化疗一线治疗晚期NSCLC的基础上,加用安罗替尼,可以进一步降低肿瘤标志物水平。分析其原因,安罗替尼具备靶向治疗作用,并与一线化疗方案发挥协同作用,在不同的靶点上互补或协同的抗肿瘤,能更好的缩小肿瘤大小并减少肿瘤负荷,从而减少肿瘤细胞释放各类标志物,继而患者CYFRA21-1、NSE和CEA等标志物水平下降[13]。此外,安罗替尼的应用还会通过影响肿瘤细胞的代谢和分泌过程,来抑制肿瘤细胞内相关信号通路活性,减少标志物的分泌和释放,使其血内表达水平大大降低。
研究还发现,观察组生存时间长于对照组,1 a生存率高于对照组,说明安罗替尼联合化疗一线治疗晚期NSCLC,能延长生存时间,减少病死。原因在于,化疗一线是通过对所有快速增殖的细胞产生毒性效应,来抑制肿瘤的生长,长此以往肿瘤细胞具有一定适应性和变异性,对化疗药物产生耐药性,逐渐失去对化疗药物的敏感性,导致治疗效果下降和肿瘤的再次增长与进展。而观察组患者在联合安罗替尼应用后,可针对性发挥作用,辅助提高化疗方案的治疗效果,从而延长生存时间[14]。因靶向药物的应用也有安全性风险,本研究结果显示,对照组与观察组不良反应发生率差异无统计学意义,且观察组在应用安罗替尼期间虽有诸如高血压、乏力等常见不良反应发生,但程度均轻微,且经处理后缓解并消失,说明在化疗一线治疗晚期NSCLC的基础上加用安罗替尼,安全性较好。
4 结论
在化疗一线治疗驱动基因阴性晚期NSCLC的基础上加用安罗替尼,可以提高整体治疗效果、降低CYFRA21-1、NSE、CEA肿瘤标志物水平,有助于延长患者生存时间,且不会增加不良反应,安全性较好,具有临床推广价值。
