鼻咽癌放射治疗患者放射性脑损伤的危险因素分析及风险预测模型构建
2024-04-17么志军郭振江巴楠郑力豪孙满满李文
么志军,郭振江,巴楠,郑力豪,孙满满,李文
(郑州大学第五附属医院 放疗科,河南 郑州 450003)
鼻咽癌是起源于鼻咽部黏膜上皮细胞的恶性肿瘤[1]。由于鼻咽癌特殊的解剖位置及对射线的高敏感性,临床多采用放射治疗方案来杀灭肿瘤细胞、缩减病灶。调强放射治疗(intensity-modulated radiotherapy,IMRT)已经逐渐成为临床治疗鼻咽癌患者的核心手段[2-3]。但在放射治疗过程中,为使鼻咽癌患者获得更佳的治疗效果,照射区域常需囊括病灶周围正常组织或器官,从而诱发放射性脑损伤,导致患者出现脑白质病变、意识障碍等表现[4]。目前临床对放射性脑损伤并无特异性治疗方案,通常采用神经营养药物、维生素等进行对症治疗,但难以获得满意临床效果。因此研究影响鼻咽癌放射治疗患者放射性脑损伤发生的危险因素,实施针对性预防方案对改善患者预后有重要作用。基于此,本研究回顾性分析鼻咽癌放射治疗患者的临床资料,探讨影响放射性脑损伤发生的危险因素,同期构建风险预测模型,以期为临床优化预防方案提供理论参考。
1 资料与方法
1.1 一般资料
回顾性选取郑州大学第五附属医院2021年1月至2022年1月放射治疗后发生放射性脑损伤的40例鼻咽癌患者作为发生组,另选取同期接受放射治疗后未发生放射性脑损伤的61例鼻咽癌患者作为未发生组。(1)纳入标准:鼻咽癌符合《耳鼻咽喉头颈外科学》(第9版)[5]中诊断标准,且经正电子发射计算机断层显像、实验室指标以及组织活检确诊疾病;首次发病;符合IMRT治疗指征,且完成全程根治性照射;治疗前卡氏功能评分[6]≥70分;美国东部肿瘤协作组评分为0~2分;TNM临床分期Ⅰ~Ⅱ期;患者或(及)家属同意查阅临床资料并签署研究知情同意书;一般资料、临床指标等资料完整。(2)排除标准:合并转移性病灶;治疗前即存在脑血管疾病、脑白质病变等影响颅脑功能疾病;合并其他恶性肿瘤;既往存在颅脑外伤史或手术史;合并颈部淋巴结肿大压迫颈动、静脉;合并多器官功能障碍;无法耐受放射治疗或因放射治疗不敏感等原因未完成治疗。本研究经郑州大学第五附属医院医学伦理委员会审批。
1.2 治疗方法
所有患者均接受IMRT方案治疗:患者取仰卧位、头稍后伸、暴露颈部,热塑面罩固定,采用CT模拟定位机行螺旋平扫与增强扫描,范围为颅顶至锁骨头下方2 cm,层厚为3 mm,层距为3 mm。将平扫与增强图片均上传至工作站中勾画靶区并制定剂量处方。靶区勾画主要包括临床靶区(clinical target volume,CTV)、肿瘤靶区(gross tumor volume,GTV)以及计划靶区(plan target volume,PTV),其中GTV主要包括鼻咽原发病灶(GTVnx),CTV分为临床高危区(CTV1)、临床低危区(CTV2)。依据CT所示图像勾画GTVnx与GTVnd,将GTVnx向外扩展5~10 mm视为CTV1,再将CTV1向外扩张5~10 mm视为CTV2。而各个PTV则为对应区域向外部扩张3~5 mm。照射剂量:PGTVnd为66~70 Gy,PGTVnx为66~76 Gy,PCTV1为60~62 Gy,PCTV2为50~55 Gy。采用同步加量的方式进行治疗,治疗周期为周一至周五每日进行1次,周六与周日休息,共持续治疗6~8周。
1.3 放射性脑损伤判定标准
参照《放射性脑损伤诊治中国专家共识》[7]中标准判定:完成放射治疗后,患者表现出脑部局灶症状、皮层功能障碍、颅内高压症状或下丘脑垂体轴功能异常等临床症状,经头颅MRI检查提示T1WI低信号、T2WI高信号,且随着病情恶化出现坏死时,增强扫描可见病灶形态呈斑片状、斑点状、不规则形强化等;病灶内合并出血或渗血使,MRI平扫提示血肿特异性信号。或经磁共振弥散加权成像提示,表观扩散系数值高于正常脑组织,判定为放射性脑损伤。
1.4 一般资料
由调查人员查阅文献、结合研究目的自制一般资料收集表,统计患者的性别、年龄、体重指数、WHO病理分型、TNM临床分期、美国东部肿瘤协作组评分、卡氏功能评分、放射治疗疗程、双侧颞叶照射剂量、吸烟、肿瘤形态。
1.5 实验室指标
在患者入院时采集空腹静脉血5 mL,常规抗凝、离心(离心半径8 cm,时间15 min,转速3 000 r·min-1)后分离上层清液使用放射免疫法检测患者的血清碱性磷酸酶(alkaline phosphatase,ALP)水平;采用磁微粒化学发光法检测血清胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP);使用酶联免疫吸附法检测血清环氧化酶-2(cycloxygenase-2,COX-2)水平。留取血浆使用全自动凝血分析仪(湖南优迪生物技术有限公司,型号UD-C200)检测患者的血浆Fib水平,采用酶联免疫吸附法测量血浆EBV-DNA表达。
1.6 统计学方法

2 结果
2.1 一般资料及临床指标
两组患者双侧颞叶最高照射剂量、血清GFAP、血清COX-2及血浆Fib水平差异有统计学意义(P<0.05),见表1。
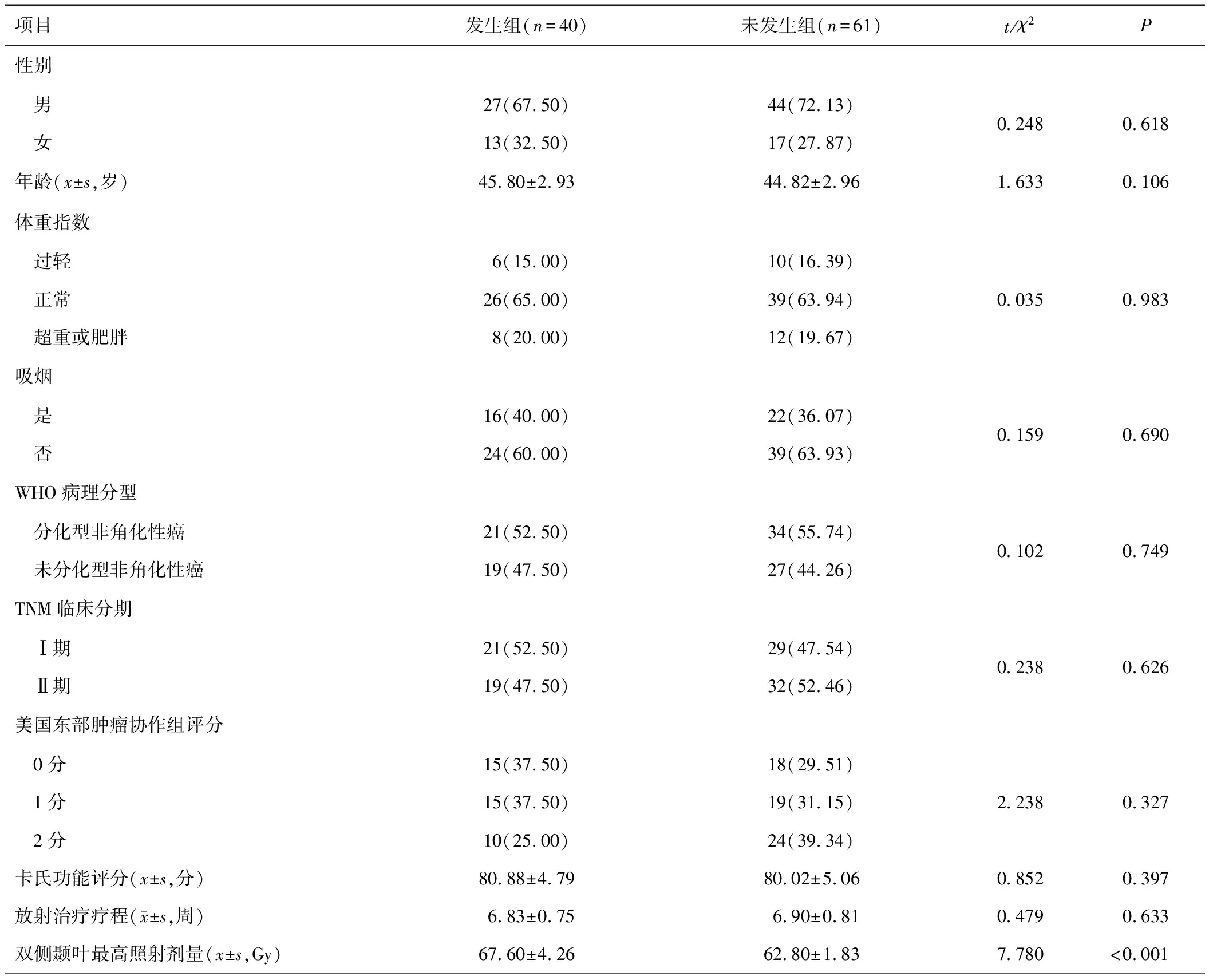
表1 两组患者一般资料及临床指标比较
2.2 影响鼻咽癌放射治疗患者并发放射性脑损伤的logistic回归性分析
将鼻咽癌放射治疗患者是否发生放射性脑损伤作为因变量(并发=1,未并发=0),将表1中差异有统计学意义的相关因子作为自变量,采用logistic回归性分析检验显示双侧颞叶最高照射剂量高、血清GFAP、血清COX-2及血浆Fib水平高是影响鼻咽癌放射治疗患者并发放射性脑损伤的危险因素(P<0.05)。见表2。
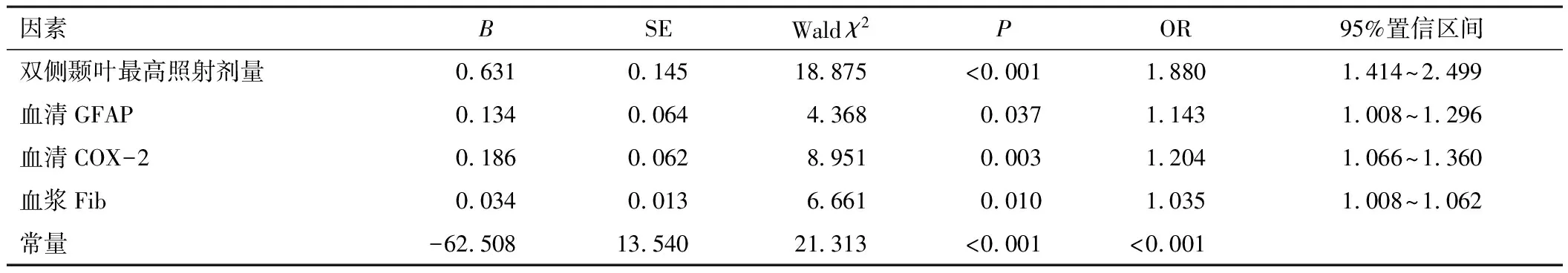
表2 影响鼻咽癌放射治疗患者并发放射性脑损伤的logistic回归性分析
2.3 鼻咽癌放射治疗患者并发放射性脑损伤的风险预测模型构建
根据表2中的回归系数构建影响鼻咽癌放射治疗患者并发放射性脑损伤的风险预测模型,采用Bootstrap内部验证法验证风险预测模型的区分度,如图1,标准曲线和Y-X直线相近,C-index=0.911说明该模型具有良好的区分度。绘制ROC曲线对风险模型进行内部验证,风险预测模型评估鼻咽癌放射治疗患者并发放射性脑损伤的AUC为0.911,AUC的95%CI为0.851~0.972,特异度0.967,敏感度0.775,约登指数0.742,P<0.001,见图2。
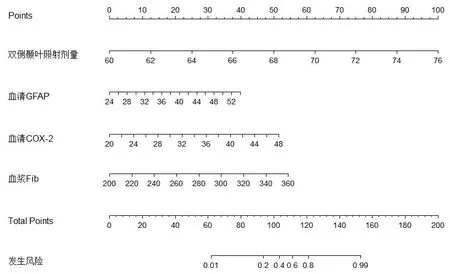
图1 鼻咽癌放射治疗患者并发放射性脑损伤的
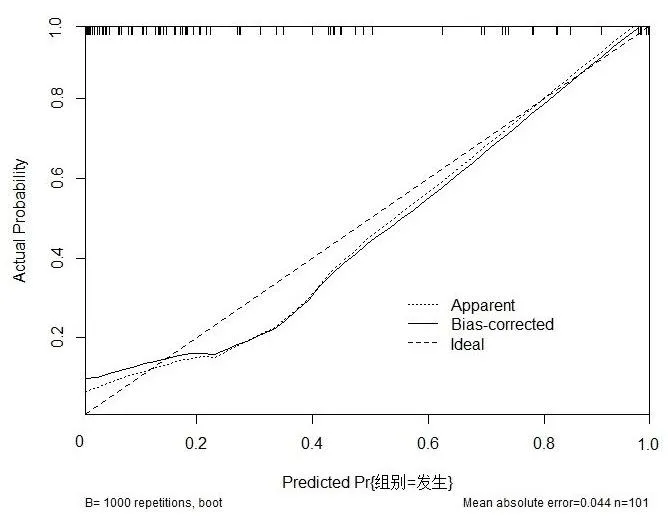
图2 风险预测图校准曲线
3 讨论
IMRT是延长鼻咽癌患者生存期、提高生活质量的重要治疗方案,相较于常规放射治疗技术,IMRT实现了提供病灶靶区高剂量照射的同时还减少毗邻组织及器官损伤[8]。但对于鼻咽癌患者而言,无论采取何种放射治疗方案均无法避免正常脑组织暴露于照射中,以致于出现脑坏死、认知减退等放射性脑损伤症状。目前临床尚无有效治疗方案根治放射性脑损伤,多以电针、糖皮质激素等促进神经修复,但多数患者难以获得满意疗效[9-10]。
本研究结果显示,两组患者在双侧颞叶最高照射剂量、血清GFAP、血清COX-2及血浆Fib方面存在差异,经logistic回归性检验显示双侧颞叶最高照射剂量高、高水平的血清GFAP、血清COX-2及血浆Fib是影响鼻咽癌放射治疗患者并发放射性脑损伤的危险因素。(1)双侧颞叶最高照射剂量。王方正等[11]研究显示高剂量照射与发生放射性脑病有关。本研究进一步分析更是证明双侧颞叶最高照射剂量是影响患者并发放射性脑损伤的危险因素。在放射治疗过程中位于颞叶内侧的海马结构对照射具有高敏感性,高剂量的照射更易损伤海马结构。而海马结构是调控机体学习、记忆等认知功能的重要区域,一旦损伤极易引发认知功能减退、记忆力缺失等放射性脑损伤症状。不仅如此,海马结构在受到高剂量照射时会过度损耗海马齿状回中的祖细胞与神经干细胞,抑制生成神经细胞,影响颅脑神经功能。此外高剂量的照射还会损害脑内微环境,刺激炎症细胞分泌,改变神经前体细胞的分化周期,抑制神经细胞的表达,进而损伤颅脑功能。基于此,临床建议在保证治疗效果的基础上合理控制双侧颞叶区域的照射剂量,以降低射线对正常脑组织的损伤。(2)血清GFAP。张馨月等[12]研究中指出与未经照射的小鼠比较,经射线照射的小鼠脑组织中的GFAP水平更高。本研究中发生组患者血清GFAP明显高于未发生组也能说明GFAP在促成放射性脑损伤中发挥重要作用。血清GFAP是反映机体星形胶质细胞水平的重要指标,血清GFAP升高则提示星形胶质细胞处于增生状态,而过量的星形胶质细胞会与小胶质细胞相互作用,诱导下游通路信号转录、激活丝裂原活化蛋白激酶来刺激释放大量白细胞介素、肿瘤坏死因子-α等炎症因子,形成神经炎症反应,从而损伤颅脑功能[13]。此外在放射治疗过程中大量的星形胶质细胞还会释放血管内皮生长因子,增加血管通透性的同时诱导炎症因子转移浸润,从而加重颅脑损伤程度[14]。基于此建议临床可将GFAP水平作为评估鼻咽癌放射治疗患者预后新指标,为精准判定放射性脑损伤的发生奠定基础。(3)血清COX-2。COX-2是机体中催化花生四烯酸转变为前列腺素的主要限速酶,与多种炎症反应关系密切。高水平的血清COX-2可调节生成大量的前列腺素来诱导小胶质细胞外钙离子内流,提高谷氨酸表达,兴奋谷氨酸相关受体,诱导钙离子浓度进一步升高,进而损伤线粒体,提高氧自由基表达,诱导氧化应激反应,从而损伤颅脑功能[15]。鉴于此,临床可通过应用COX-2抑制剂来减少机体内氧化应激损伤,降低发生放射性脑损伤的可能性。(4)血浆Fib。Fib是调节机体凝血功能的重要因子,高水平的血浆Fib会增加血液循环外周阻力,血液黏稠程度,诱发血管内皮损伤,促进巨噬细胞、单核细胞向内皮下聚集,进而形成颅内微血栓,增加放射性脑损伤的发生风险。此外高水平的血浆Fib还会诱导内皮细胞出现不规则性退缩,提高血管通透性,辅助炎症因子浸润、转移,损伤血脑屏障,影响颅脑功能。在此建议临床可通过关注患者血浆Fib水平变化,对其实施降低血液黏稠程度、提高颅脑血液循环的药物治疗,以达到降低放射性脑损伤发生的目的。
在本研究中,将上述危险因素纳入构建风险预测模型发现,该模型对鼻咽癌放射治疗患者放射性脑损伤的发生有高预测价值。由此可见在临床工作中,可根据风险预测模型筛选出放射性脑损伤的高风险人群,及时给予针对性干预,以达到降低放射性脑损伤发生率、改善患者预后的目的。
4 结论
双侧颞叶最高照射剂量、血清GFAP、血清COX-2及血浆Fib是影响鼻咽癌放射治疗患者放射性脑损伤发生的危险因素,基于上述影响因素构建的风险预测模型对放射性脑损伤的预测价值高。
