CTD-ILD合并肺部感染患者肺部微生物菌群特点及对肺纤维化的影响
2024-04-17王小丽张旭静李英
王小丽,张旭静,李英
(河南省人民医院 a.呼吸与危重症医学科;b.医学影像科,河南 郑州 450003)
结缔组织病(connective tissue disease,CTD)是一种可累及全身各组织器官的自身免疫性疾病,其病理基础是全身血管和结缔组织发生慢性非感染性炎症,当累及肺脏时便引发间质性肺疾病(interstitial lung disease,ILD)[1-2],这种疾病称为结缔组织病相关间质性肺疾病(CTD-ILD),其中,肺间质病变、急性肺损伤及肺动脉高压是其最常见的致死原因[3-4]。CTD-ILD的诱发因素尚不明确[5],免疫、药物、遗传、环境等均可能为引发因素[6],目前认为其发病机制为疾病早期免疫损伤导致的肺部损伤和炎症反应,使多种细胞因子和炎症介质释放出来,作用于成纤维细胞,随病情进展,后期便形成不可逆的肺纤维化[7]。临床上关于CTD-ILD合并肺部感染微生物菌群种类、分布及临床特点研究较多,但病原菌群多样性对肺纤维化的影响尚无相关报道,故本研究纳入CTD-ILD合并肺部感染患者和CTD-ILD未合并肺部感染患者,通过比较两组肺功能、高分辨CT(high resolution CT,HRCT)肺纤维化评分等,分析CTD-ILD合并肺部感染患者病原菌分布情况,探讨CTD-ILD合并肺部感染患者肺部微生物菌群多样性特点及对肺纤维化的影响,为临床诊疗提供有价值的信息。
1 对象与方法
1.1 研究对象
选取2021年2月至2022年5月在医院治疗的45例 CTD-ILD合并肺部感染患者作为观察组,其中CTD类型中类风湿性关节炎(rheumatoid arthritis,RA)25例,多发性肌炎/皮肌炎(polymyositis/dermatomyositis,PM/DM)10例,干燥综合征(Sjögren syndrome,SS)10例。同时选取CTD-ILD未合并肺部感染患者45例作为对照组。诊断标准均采用国际诊断标准,包括美国风湿病学会和欧洲抗风湿病联盟诊断标准[8]、1975年Bohan等[9]提出的PM/DM诊断标准,2002年干燥综合征国际诊断标准[10]、1997年美国风湿病学会修订的系统性红斑狼疮(systemic lupus erythematosus,SLE)分类标准[11],1980年美国风湿病学会系统性硬化症(systemic sclerosis,SSc)分类标准[12]。肺部感染符合第5项加上1~4项中的任意一项:(1)发热;(2)出现咳嗽、咳痰,或原有咳嗽、咳痰等症状加重并出现脓性痰,伴或不伴有胸痛;(3)肺实质体征和(或)肺部闻及湿啰音;(4)血常规出现异常,白细胞计数>10×109L-1,或<10×109L-1,伴或不伴核左移;(5)胸片或胸部CT见片状、斑片状或间质性阴影,伴有或不伴胸腔积液。纳入标准:(1)符合上述诊断标准;(2)年龄>18岁;(3)患者及家属签署知情同意书。排除标准:(1)有急慢性胆囊炎、急慢性肝炎等急慢性感染性疾病;(2)合并有恶性肿瘤、血液系统疾病、肝和肾功能障碍等其他严重疾病;(3)有肺栓塞、肺结核、尘肺等其他肺部疾病。观察组和对照组一般资料差异无统计学意义(P>0.05),见表1。本研究已通过河南省人民医院医学伦理委员会批准。
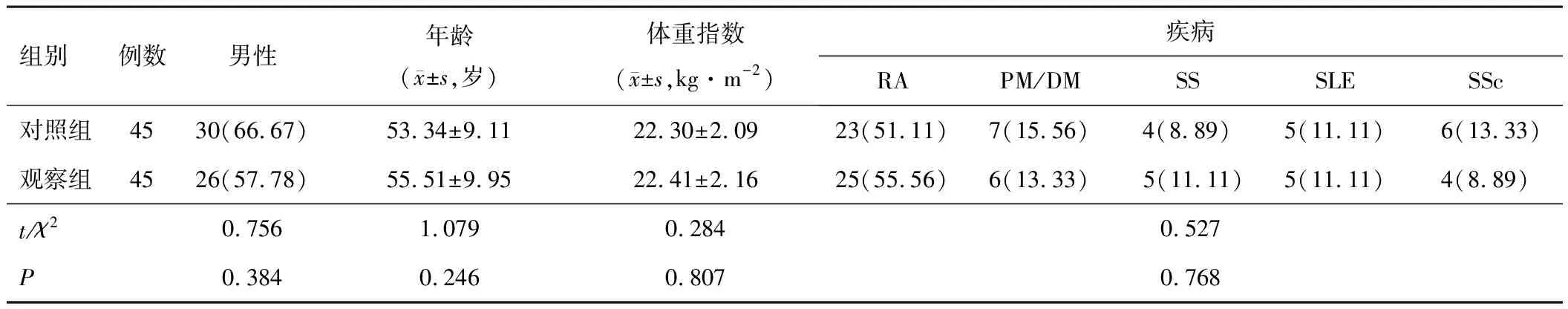
表1 观察组和对照组一般资料比较
1.2 病原微生物检测
患者清水漱口,用力咳痰并将痰液置于一次性痰盒中;若患者痰液较少或者患者身体虚弱,无力咳痰,可用支气管镜行肺泡灌洗获取标本。将痰液和唾液分离开来,并分别放入1.5 mL的EP管中。首先,向每份样本中加入相当于其体积4倍的浓度为1 g·L-1的二硫苏糖醇溶液,接着进行15 s的涡旋震荡处理。随后,添加等量的磷酸盐缓冲液,再将装有混合液的EP管放置在37 ℃的恒温水浴环境中,持续震荡15 min。以离心半径8 cm,以每分钟3 500 r·min-1的速度进行离心处理,时长10 min。离心结束后,收集并保存上清液至-80 ℃冰箱中,预备后续检测使用。检测时首先对痰液进行痰涂片检查,合格痰样本要求每低倍视野中鳞状上皮细胞<10个,并且白细胞>25个,对合格痰样本行进一步培养,若连续两次痰培养为同一优势菌则判定为感染病原菌,最后用德国布鲁克质谱仪进行细菌鉴定。为获取更多明确的病原学,将患者肺泡灌洗液样本送至基因检测公司进行检测,IDseq Ultra是融合杂交捕获技术与微远自研去宿主技术的mNGS2.0时代检测新产品,应用该产品进行探针捕获和基因测序。
1.3 HRCT检查
采用SIEMENS Sensation 64层螺旋CT对患者进行扫描操作,具体扫描参数设定如下:管电压125 kV,管电流时间乘积为160 mA·s,图像重建后的像素矩阵配置为512×512。针对肺部结构,选择适合的窗口级别设置,其中肺窗的窗宽调整至1 400~1 600 Hz,窗位设定在500~600 Hz;而纵隔区域则采用300~500 Hz窗宽。
扫描时要求患者采取仰卧姿势,双臂上举越过头部,并在深吸气后屏住呼吸,确保胸部稳定无运动伪影。扫描范围覆盖自肺尖直至后肋膈角区域,层厚设定为10 mm,螺旋扫描间距为1 mm,以此获取高质量的CT影像数据。为了排除背部组织在重力作用下可能堆积导致的伪磨玻璃病灶影像,在同样条件下对患者俯卧位进行局部扫描,确保对肺部结构的观察更为准确无误。为了避免因急性感染所致肺部影像学,所有观察组均在感染控制1个月后复查胸部CT,再与对照组影像学进行分析。得到的HRCT图像由3位放射科医生进行评分,取平均值作为最后结果。采用Muller等[13]评分体系评估患者肺部CT表现时,会选择特定的解剖断面作为评价基准,包括主动脉弓层面、气管分叉层面以及膈顶上方1 cm层面。在这些层面,依据病灶的不同形态特征,如磨玻璃样变、网格样变和蜂窝样变,独立地对每一类型的病变进行量化评分。无改变,评分0分;病变范围≤5%,计1分;病变>5%~25%计2分;病变>25%~50%计3分;病变>50%~75%计4分;病变>75%~100%计5分。HRCT总分为3种改变评分累加之和。
1.4 观察指标
(1)肺功能指标:用力肺活量(forced vital capacity,FVC)、最大呼气流量(maximum expiratory flow,MEF)和残气容积(residual volume,RV)、用力肺活量占预计值百分比(the percentage of forced vital capacity to the predicted value,FVC%pred)、第1秒用力呼气容积占预计值百分比(the percentage of forced expiratory volume in the first second to the predicted value,FEV1%pred)、一氧化碳弥散量占预计值百分比(the percentage of carbon monoxide diffusion volume to the predicted value,DLCO%pred)。(2)影像学特征:CT纤维化评分、蜂窝影、网格影、条索影、磨玻璃影、斑片状、支气管扩张。(3)病原菌分布情况:细菌(革兰阳性菌,表皮葡萄球菌/金黄色葡萄球菌;革兰阴性菌,铜绿假单胞菌/大肠埃希菌/肺炎克雷伯菌)、病毒(巨细胞病毒/人类疱疹病毒)、真菌(白念珠菌/曲霉菌)。(4)不同临床资料患者的HRCT肺纤维化评分: 性别(男/女)、年龄(<60岁/≥60岁)、体重指数(<22 kg·m-2/≥22 kg·m-2)、基础疾病(RA/其他)、病原学(细菌/其他)。
1.5 统计学处理

2 结果
2.1 肺功能指标
观察组FVC%pred、FEV1%pred、DLCO%pred、FVC、MEF和RV低于对照组(P<0.05)。见表2。

表2 观察组和对照组肺功能指标比较
2.2 HRCT影像学特征
观察组CT纤维化评分、HRCT影像学斑片状、支气管扩张占比高于对照组(P<0.05)。见表3。
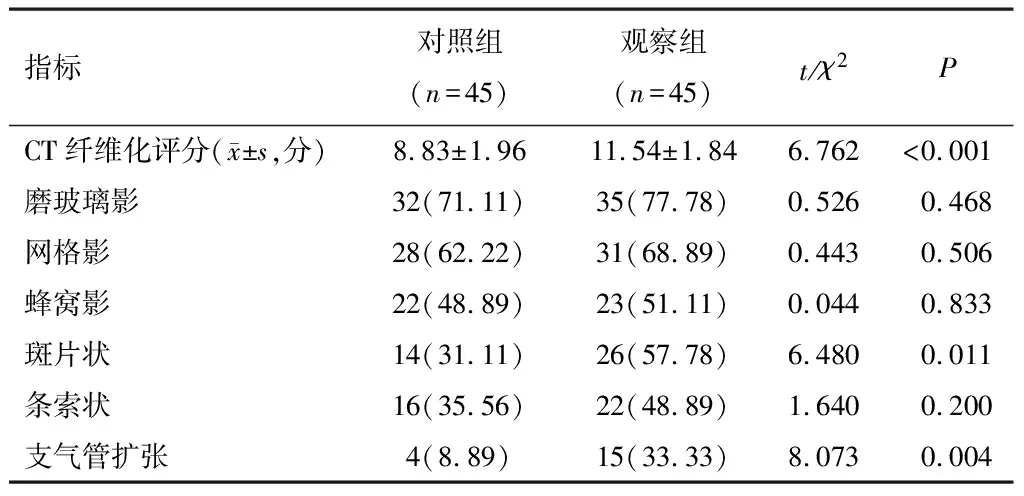
表3 观察组和对照组HRCT影像学特征比较
2.3 观察组病原菌分布情况
观察组病原菌分布:细菌分布中以肺炎克雷伯菌、铜绿假单胞菌为主,分别占24.44%和15.56%,病毒检出巨细胞病毒、人类疱疹病毒,分别占11.11%和6.67%,真菌检出白念珠菌,占11.11%。见表4。
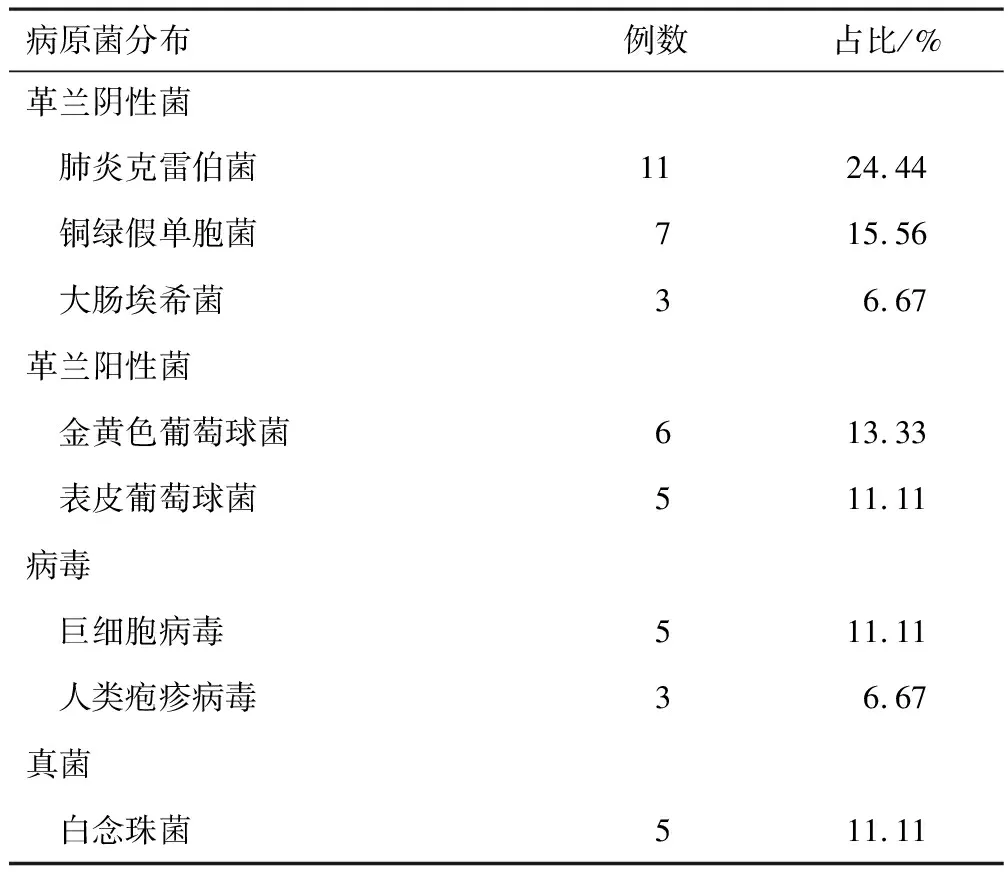
表4 观察组病原菌分布情况
2.4 观察组不同临床资料患者HRCT肺纤维化评分
观察组年龄≥60岁患者CT纤维化评分高于年龄<60岁患者(P<0.05);不同性别、体重指数、疾病和病原菌分布患者的CT纤维化评分差异无统计学意义(P>0.05)。见表5。

表5 观察组HRCT肺纤维化评分比较分)
3 讨论
CTD-ILD发病率高,为12.4%~34%[14],不同CTD中ILD的发生率也不一致[3]。CTD-ILD常见于RA、SS、PM/DM等疾病[5,15-17],各类型的CTD-ILD治疗[3,18-19]和预后[20-21]存在差异。CTD-ILD好发于中年女性[22],主要临床表现有呼吸困难、进行性低氧血症、干咳等,肺部表现为肺通气功能障碍、低氧血症、双肺弥漫性病变等[23],病理特征主要表现为肺间质弥漫性炎症渗出、浸润及间质纤维化[5]。有研究发现,导致CTD-ILD疾病加重的原因中合并肺部感染占30%,且以细菌和真菌感染为主[24]。
FVC%pred、FEV1%pred、DLCO%pred、FVC、MEF等是临床上常见的肺功能指标[25]。本研究结果显示,观察组FVC%pred、FEV1%pred、DLCO%pred、FVC、MEF和RV低于对照组,说明CTD-ILD合并肺部感染患者肺功能较差。有研究发现,特发性间质性肺炎患者FVC%、FEV%和DLCO%低于CTD-ILD患者[26],与本研究结果类似,提示临床上应加强对CTD-ILD合并肺部感染患者肺功能水平的关注。
在CTD-ILD的进展过程中,其疾病早期HRCT表现为双侧肺部呈现磨玻璃样病变以及胸膜下线与小叶间隔的增厚现象。随着疾病的进一步发展,疾病晚期HRCT表现出特征性的变化,如网格状阴影、条索状结构、结节以及类似蜂窝肺的重构变化,同时可能伴有受牵拉影响而导致的支气管扩张现象[25]。本研究结果表明,观察组CT纤维化评分高于对照组。尽管磨玻璃影、网格影、蜂窝影以及条索影在两组间并未显示出统计学意义上的差异,但值得注意的是,观察组中HRCT所见的斑片状病变以及支气管扩张的占比高于对照组。这与已有的研究结果[27]一致。CTD-ILD容易使支气管不可逆性扩张,从而影响痰液排出体外,使菌群一直存在于体内,从而引发感染。这一结果说明,CTD-ILD合并肺部感染患者肺部纤维化情况相比非合并肺部感染患者更严重,且伴随HRCT影像学晚期斑片状、支气管扩张等临床表现,临床应加以重视。
由于CTD-ILD患者自身免疫功能低下,致使感染成为其最常见的合并症[28]。本研究结果显示,观察组病原菌分布中,细菌分布检出革兰阴性菌和革兰阳性菌,革兰阴性菌包括肺炎克雷伯菌、铜绿假单胞菌、大肠埃希菌,分别占24.44%、15.56%和6.67%,革兰阳性菌包括金黄色葡萄球菌和表皮葡萄球菌,分别占13.33%和11.11%;病毒检出巨细胞病毒、人类疱疹病毒,分别占11.11%和6.67%,真菌检出白念珠菌,占11.11%。CTD-ILD合并肺部感染以细菌感染为主,真菌感染也不少见,且患者出现病毒感染时容易出现肺炎克雷伯菌、金黄色葡萄球菌等致病菌的二重感染,故本研究病原菌分布中也检出巨细胞病毒、人类疱疹病毒等,病原菌如此多样复杂,临床实践中,尽早进行病原菌检查对于后续治疗至关重要。
本研究结果显示,不同性别、体重指数、疾病类型、病原菌分布患者的CT纤维化评分比较差异无统计学意义;而不同年龄患者CT纤维化评分有统计学意义。说明CTD-ILD合并肺部感染患者性别、体重指数、疾病类型和病原菌分布对肺纤维化的影响不大,而患者年龄对肺纤维化有一定影响,为临床诊断治疗提供了极为有价值的信息。目前CTD-ILD的影像学研究主要集中于患者的HRCT征象研究[29-30],HRCT分辨率高,能够清晰反映患者肺部纤维化程度,是目前诊断肺纤维化疾病的重要方法[31],不仅可以进行病理分型,还可评估疾病预后[32],其诊断CTD-ILD的敏感性达80%以上,特异性达90%[33]。
4 结论
CTD-ILD患者合并肺部感染可导致肺功能下降,肺纤维进展。在临床工作中,CTD-ILD患者免疫功能紊乱,尤其是长期口服激素或者免疫抑制剂患者,易反复多次合并感染,努力提高免疫力及预防感染才是提高患者生存及生活质量的关键。
