血清白介素-12p70、淀粉样蛋白A水平变化与慢性阻塞性肺疾病患者并发冠心病的关系
2024-04-16王尚宏郑丽琴王耀勇赵建玲
王尚宏,郑丽琴,王耀勇,赵建玲
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)多发于老年群体,随着病情进展,可产生全身炎性反应,引起多系统疾病[1]。冠心病(coronary heart disease,CHD)是常见心血管疾病,其发生与机体炎性反应密切相关。COPD患者因机体释放多种细胞因子和炎性介质,气道处于慢性炎性反应状态会使并发CHD的易感因素增加2~3倍[2]。据统计,41%的COPD患者会出现CHD,且COPD并发CHD不仅会增加患者治疗难度,还会增加病死风险[3]。白介素(interleukin,IL)-12p70是IL-12的主要活性形式,而IL-12是新型促炎性反应介质,可激活炎性级联反应[4]。血清淀粉样蛋白A(serum amyloid A,SAA)可结合高密度脂蛋白胆固醇(HDL-C),参与机体炎性反应[5]。但血清IL-12p70、SAA水平与COPD患者并发CHD的具体关系如何尚缺乏报道,现对其进行研究,报道如下。
1 资料与方法
1.1 临床资料 选取2019年5月—2023年5月山西医科大学附属汾阳医院呼吸与危重症医学科诊治COPD患者150例,其中并发CHD患者58例纳入COPD-CHD组,未并发CHD患者92例纳入COPD组。2组性别、年龄、体质量指数(BMI)、饮酒史、冠心病家族史、合并高血压、合并高脂血症、白细胞计数(WBC)、血小板计数(PLT)比较,差异均无统计学意义(P>0.05)。COPD-CHD组吸烟史比例、糖尿病比例、纤维蛋白原水平高于COPD组(P均<0.05),见表1。本研究已经获得医院伦理委员会批准(190419),患者或家属知情同意并签署知情同意书。

表1 COPD组、COPD-CHD组临床资料比较
1.2 病例选择标准 (1)纳入标准:COPD患者符合《慢性阻塞性肺疾病基层诊疗指南(2018年)》[6]中COPD诊断标准,因急性加重住院治疗;并发CHD患者符合《稳定性冠心病诊断与治疗指南》[7]中冠心病诊断标准。(2)排除标准:①合并哮喘、肺炎等;②脑血管疾病、自身免疫性疾病;③急性冠状动脉综合征;④严重肝肾功能障碍;⑤急慢性感染性疾病。
1.3 观察指标与方法
1.3.1 血清IL-12p70、SAA水平检测:于患者入院时抽取外周静脉血4 ml,采用全自动离心机(济南鑫贝西TD-5M型)离心留取上层血清,采用深圳迈瑞生物医疗电子股份有限公司生产的MR-96A全自动酶标仪以酶联免疫吸附法测定血清IL-12p70、SAA水平,试剂盒由仪器配套提供。
1.3.2 COPD患者病情相关资料搜集:包括COPD病程、改良版英国医学研究委员会呼吸困难问卷(modified medical research council,mMRC)分级、慢性阻塞性肺疾病评估测试(COPD assessment test,CAT)评分、COPD分级、肺功能指标[第一秒用力呼气容积(forced expiratory volume in 1 second,FEV1)、用力肺活量(forced vital capacity,FVC)、FEV1/FVC、FEV1%]、血气指标[动脉血氧分压(arterial oxygen partial pressure,PaO2)、动脉血二氧化碳分压(arterial carbon dioxide partial pressure,PaCO2)、氧合指数(oxygenation index,OI)]。

2 结 果
2.1 2组血清IL-12p70、SAA水平比较 COPD-CHD组血清IL-12p70、SAA水平高于COPD组(P均<0.01),见表2。

表2 COPD组与COPD-CHD组血清IL-12p70、SAA水平比较
2.2 2组病情相关资料比较 2组患者COPD病程、FEV1/FVC比较,差异无统计学意义(P>0.05);COPD-CHD组mMRC分级>2级、CAT高评分、COPD分级极重度、PaCO2大于COPD组,FEV1、FVC、FEV1%、PaO2、OI小于COPD组(P均<0.05),见表3。

表3 COPD组、COPD-CHD组病情相关资料比较
2.3 不同血清IL-12p70、SAA水平COPD患者并发CHD发生率比较 根据IL-12p70[60.32(56.22,65.07)]、SAA[29.56(25.85,32.36)]四分位水平分为4个亚组(Q1、Q2、Q3、Q4)。不同血清IL-12p70、SAA水平COPD患者CHD发生率比较,差异有统计学意义(P<0.05)。随着血清IL-12p70、SAA水平升高,COPD患者并发CHD发生率呈升高趋势(χ2/P=27.864/<0.001、31.346/<0.001),见表4。

表4 不同血清IL-12p70,SAA水平COPD患者并发CHD发生率比较
2.4 血清IL-12p70、SAA与COPD患者并发CHD的独立关系分析 以COPD患者是否并发CHD为因变量(是=1,否=0),以血清IL-12p70、SAA为自变量,经Logsitic回归模型分析发现,血清IL-12p70、SAA升高均是COPD患者并发CHD的独立危险因素(P<0.01),见表5。

表5 血清IL-12p70、SAA与COPD患者并发CHD的Logistic回归分析
2.5 血清IL-12p70、SAA预测COPD患者并发CHD的价值分析 绘制血清IL-12p70、SAA预测COPD患者并发CHD的价值ROC曲线,并计算曲线下面积(AUC),结果显示:血清IL-12p70、SAA及二者联合预测COPD患者并发CHD的AUC分别为0.774、0.759、0.835,二者联合优于各自单独预测效能(Z/P=2.180/0.029,2.244/0.025),见表6。
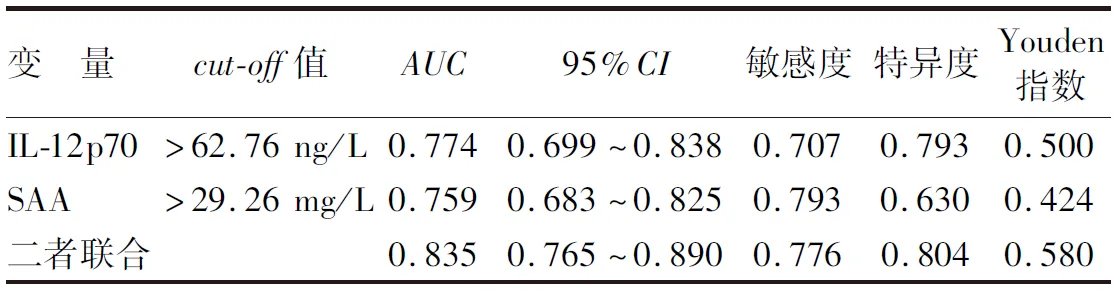
表6 血清IL-12p70、SAA预测COPD患者并发CHD的价值
3 讨 论
COPD患者以气流不完全受限为主要特征,由于患者肺部对有害气体或有害颗粒异常炎性反应致使病情呈进行性发展。肺部炎性细胞释放炎性介质通过全身血液循环或肺循环传递激活全身中性粒细胞、淋巴细胞,从而诱发系统性炎性反应[8]。已有研究显示,炎性细胞因子诱发的血管壁慢性炎性反应与动脉粥样硬化斑块的形成有关,可调节血管功能,影响CHD的发生及发展过程[9-10]。但机体炎性细胞因子众多,关于何种细胞因子更有利于判断COPD患者CHD发生风险临床尚无统一意见。探究COPD患者并发CHD的相关机制,探索有价值的生化标志物对COPD患者并发CHD的防治具有重要意义。
IL-12由活化的巨噬细胞、中性粒细胞、树突状细胞产生,IL-12p70是IL-12的主要活性形式,其引起的慢性炎性反应能促使血管壁发生炎性改变,直接或间接诱发内皮功能紊乱,导致刺激纤溶酶原激活抑制物mRNA和纤溶酶原激活抑制物的表达,并增加其活性,引起纤溶功能及血液凝血功能障碍,增加血管硬化和血栓形成风险[11]。研究显示,COPD大鼠血清IL-12水平显著升高,随病情治疗改善,血清IL-12水平降低[12]。本研究中COPD-CHD组、COPD组血清IL-12p70水平较高,说明COPD患者存在明显的炎性反应,且COPD-CHD组水平升高更明显,随着血清IL-12p70水平升高,COPD患者并发CHD发生率呈升高趋势(P<0.05)。推测血清IL-12p70可能参与COPD患者并发CHD的过程。IL-12p70是重要炎性介质,其水平异常升高可诱发CHD,相关作用机制可能包括:(1)促使内皮细胞分泌多种趋化因子、黏附分子,促使炎性细胞与血小板黏附,同时刺激炎性细胞向内膜下迁移,促进炎性细胞浸润,形成冠状动脉粥样硬化;(2)刺激基质金属蛋白酶产生,促进基质蛋白溶解,同时可诱导平滑肌细胞凋亡,减少基质蛋白的产生,抑制胶原修复,导致纤维帽厚度减少,增加斑块不稳定性;(3)增加血管性血友病因子等分泌,促进肝细胞、脂肪组织、内皮细胞等表达纤溶酶原激活抑制物,导致机体处于高凝状态,增加冠状动脉血栓形成风险。
SAA是一种急性时相蛋白,当机体组织受损或出现炎性反应时,其合成和分泌量增加,能促进心肌细胞黏附因子水平上调,增加心肌细胞黏附能力,造成心肌损伤,在心血管疾病中炎性反应变化比C反应蛋白的敏感度更高[13]。阎兴月等[14]的研究结果指出,COPD患者SAA水平异常升高,经有效治疗后,其水平降低。金勇等[15]在一项老年2型糖尿病伴CHD患者的研究中发现,SAA水平越高,血管细胞黏附分子1、细胞间黏附分子1、高敏C反应蛋白、白介素-6、单核细胞趋化蛋白-1水平越高,高密度脂蛋白胆固醇抗炎能力、抗黏附及血管保护效应越弱。本研究发现,血清SAA水平在COPD组、COPD-CHD组依次升高,且随着SAA水平升高,COPD患者并发CHD发生率呈升高趋势。提示SAA在COPD患者发生及病情进展中均发挥了作用。SAA水平升高可促进脂质沉积,导致机体炎性反应加剧,同时SAA与高密度脂蛋白胆固醇结合后对巨噬细胞有极强的亲和力,快速将胆固醇脂转运至巨噬细胞,减少胆固醇脂流出,造成斑块脂质池内游离胆固醇及胆固醇脂表达激增,增加易损斑块体积[16-17]。此外,SAA能刺激血管平滑肌细胞增殖,导致机体凝血和纤溶功能失衡,并参与氧化应激反应过程,增加自由基的产生量,加速低密度脂蛋白胆固醇氧化,对内皮细胞产生毒性损害,诱发动脉粥样硬化,这也是SAA水平升高增加CHD发生风险的原因之一[18]。
考虑到诸多因素与IL-12p70、SAA一起推动COPD患者CHD的发生,本研究对其一般资料及病情相关资料进行对比,发现吸烟史、糖尿病、纤维蛋白原、mMRC分级、CAT评分、COPD分级、PaCO2、FEV1、FVC、FEV1%、PaO2、OI均存在差异,与既往研究有相似之处[19]。吸烟是COPD和CHD的共同危险因素,烟草燃烧释放的尼古丁可诱发血管内皮功能障碍,致使血管结构及功能改变,可增加COPD患者并发CHD风险[20]。高血糖不仅会导致内皮衍生的一氧化氮减少,损害血管内皮细胞功能,还能造成血小板功能障碍,增加血栓形成风险,增加CHD易感性。纤维蛋白原升高会增加血液黏稠度,诱导红细胞聚集,减缓血流速度,加速动脉粥样硬化[21]。此外,COPD患者肺功能减低、缺氧均会通过炎性反应、氧化应激反应、增加泡沫细胞等增加CHD发生风险。本研究经Logistic回归模型分析发现,血清IL-12p70、SAA升高均是COPD患者并发CHD的独立危险因素,证实IL-12p70、SAA均参与COPD患者并发CHD的过程。进一步经ROC曲线分析显示,血清IL-12p70、SAA联合预测COPD患者并发CHD的AUC为0.835,优于各自单独预测效能,敏感度为0.776,特异度为0.804,提示可通过检测血清IL-12p70、SAA判断COPD患者CHD的发生风险,为临床防治提供指导。
综上所述,血清IL-12p70、SAA均为COPD患者并发CHD的独立危险因素,尤其是当血清IL-12p70水平>62.76 ng/L,SAA水平>29.26 mg/L时,应及时制定科学有效的防治方案。
利益冲突:所有作者声明无利益冲突
作者贡献声明
王尚宏:设计研究方案,实施研究过程,论文撰写;郑丽琴:进行统计学分析,论文指导;王耀勇:提出研究思路,分析试验数据,论文审核;赵建玲:实施研究过程,资料搜集整理,论文修改
