Schimke免疫—骨发育不良1例并文献复习
2024-04-15童桂霞王兴翠潘艳艳王雪张海美张洪霞
童桂霞,王兴翠,潘艳艳,王雪,张海美,张洪霞
患儿,男,8岁,因“发现尿蛋白4 d”于2023年2月6日入院。患儿进食欠佳,偶有恶心、呕吐;尿色淡黄,可见泡沫尿,无肉眼血尿;无其他不适症状。患儿自幼食欲佳,生长发育迟缓,身高、体质量均明显低于同龄儿,智力、语言、运动发育正常;平素体质弱,易患感冒;否认家族遗传史。为进一步诊治入院。体格检查:身高120 cm,体质量22 kg,神志清楚;躯干部皮肤散在直径2~7 mm咖啡牛奶斑,皮肤弹性好,全身无浮肿;心肺查体未见明显异常,腹软,肝脾肋下未触及异常。实验室检查:血肌酐79.2 μmol/L,血白蛋白25.2 g/L,TC 6.67 mmol/L,LDL-C 3.87 mmol/L;尿常规:蛋白(+++),24 h尿蛋白定量4 435.63 mg/24 h(>150 mg/24 h),余正常;T淋巴细胞亚群检测 CD3 25.1%、CD4 12.9%、CD8 9.36%,均偏低,CD4/CD8比值1.38;免疫球蛋白IgG 2.71 g/L,IgA、IgM均正常;血常规、血电解质、肝功能、心肌酶、血脂四项、甲状腺功能五项、尿筛查、血串联质谱检查均无明显异常。影像学检查:脊柱侧位X线片、骨盆正位片、四肢长骨X线片、头颅MR、磁共振血管造影、磁共振静脉成像、胸部CT、心脏彩色超声均无明显异常;泌尿系超声检查结果示双肾形态大小尚可,右肾大小约8.8 cm×4.4 cm,左肾大小8.1 cm×4.0 cm;双肾弥漫性病变,肾皮质回声增强,皮髓质分界不清,双侧集合系统未见明显分离及光团;双侧输尿管无扩张。肾脏穿刺病理检查结果示肾小球形态呈局灶节段性硬化改变,灶性急性肾小管损伤并慢性肾小管—间质炎性反应(图1)。基因学检查:送检样本SMARCAL1基因有1个纯合突变:c.2459G>A(exon16,NM_014140),导致氨基酸改变p.R820H,为错义突变,该突变来自患儿父母双方(图2)。根据患儿相关症状及检查结果,确诊为Schimke免疫—骨发育不良。
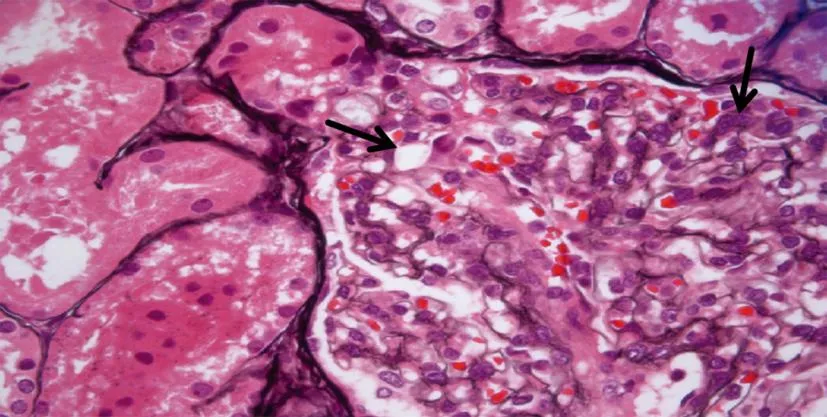
图1 患儿肾脏穿刺病理结果(HE染色,×400)
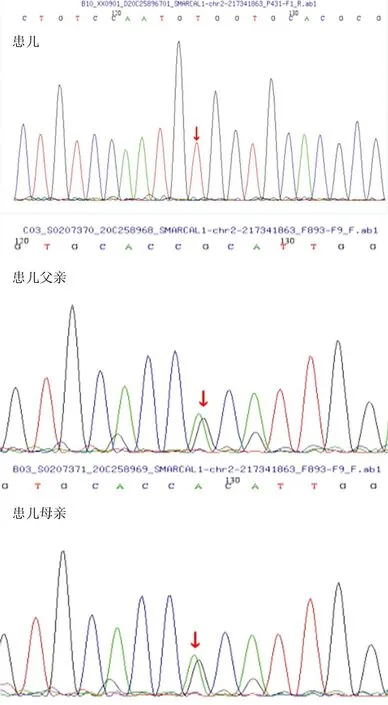
图2 患儿及其父母基因序列
该患儿入院后因主要表现为大量蛋白尿、低白蛋白血症、高胆固醇血症,给予足量激素(2 mg·kg-1·d-1)及其他对症支持治疗,口服足量激素治疗6周后逐渐停用激素,动态监测尿蛋白及肾功能变化,目前随访中。
讨 论Schimke免疫—骨发育不良(Schimke immuno-osseuos dysplasia,SIOD)是一种罕见的常染色体隐性遗传疾病,患病率低于百万分之一[1]。SIOD临床表现为激素耐药型肾病综合征、进行性肾功能不全、反复感染、身材矮小、发作性脑缺血、甲状腺功能减退、脊椎骨骺发育不良、自身免疫性疾病、面部畸形以及皮肤色素沉着等[2]。
SIOD的病因与发病机制尚不完全清楚,但经分子遗传学研究证实SIOD与SMARCAL1基因突变相关[3]。该基因位于染色体2q34-q36,含有18个外显子,编码954个氨基酸,该基因编码蛋白为SNF2亚家族的成员,该家族在基因调控,DNA复制、重组、甲基化和基因修复过程中介导DNA核小体结构重组。SMARCAL1是一种编码未知功能的染色质重塑蛋白基因[4]。其主要有调节软骨细胞、淋巴细胞和维持心脏细胞的作用。本例患儿检测到SMARCAL1基因有1个纯合突变:在2459号核苷酸由鸟嘌呤G变为腺嘌呤A(c.2459G>A)的纯合突变,导致第82号氨基酸由精氨酸变为组氨酸(p.R820H),该突变来自患儿父母双方。
SIOD主要临床表现有:(1)特殊面貌及身材矮小。宽而低的鼻梁,鼻尖呈球状,细或者粗的头发;皮肤色素沉着多见于躯干;眼部异常;不成比例的矮小身材(颈部和躯干短小),腰椎前凸,腹部突出。还可伴有动脉粥样硬化、动脉内弹力层的局灶性增厚及劈裂等,严重时可导致心肌梗死。其中部分SIOD患儿伴有进行性双侧狭窄闭塞性动脉病变,临床表现为儿童复发性脑卒中[5]。该患儿生后即有生长发育迟缓与该病相符合。(2)骨骼发育异常。脊椎通常为卵圆形,股骨头骨骺小而畸形,髋臼窝变浅。(3)进行性加重的肾衰竭。该病主要临床表现为蛋白尿、低白蛋白血症等肾病综合征表现,肾脏病理显示为局灶性节段性肾小球硬化(FSGS)。SIOD患者中的FSGS通常在1~14岁被发现,并在短期内导致终末期肾病[6]。有报道显示 SIOD患儿出现肾脏疾病的中位年龄为4.5岁,而进展到FSGS或肾脏由轻微病变发展到终末期肾病的中位年龄为8.7岁[2]。该患儿以蛋白尿起病,病理结果为FSGS。(4)T淋巴细胞缺乏,通常为CD4和CD8降低。80%的SIOD患者存在T淋巴细胞缺乏,其与胸腺T细胞生成减少一致[7]。该患儿多次查T淋巴细胞亚群,CD4及CD8均偏低,与相关研究一致。
SIOD患者目前仍无有效的治疗方法,最重要的死因包括感染、脑卒中、充血性心力衰竭、肺动脉高压、肾功能衰竭、器官移植并发症、淋巴增生性疾病、胃肠并发症、呼吸衰竭、骨髓衰竭、非霍奇金淋巴瘤、胰腺炎等[8]。随着肾移植和透析技术的发展,该疾病患儿的生存时间也得到了一定时间的延长。有证据表明,肾功能衰竭发生的时间也可以预测疾病的预后[9]。
综上所述,对于一些临床表现不典型或激素耐药型肾病综合征,同时伴有生长发育落后、骨骼异常、皮肤咖啡斑等多系统疾病患儿应考虑SIOD,但由于该病发病率低,且对该病的认识不足,故临床诊断存在困难,尽早行基因检测,防止误诊。
