运动激活PGC-1a/FNDC5/BDNF通路延缓APP/PS1小鼠病理进程的机制研究
2024-04-15金迪吴慧民何标王运良
金迪 吴慧民 何标 王运良

摘要: 探讨PGC-1a/FNDC5/BDNF信号通路在运动改善APP/PS1小鼠认知功能障碍中的作用机制。选用12只4月龄APPswe/PS1转基因雄性小鼠和12只同窝野生型小鼠,随机分AD对照组(AD-C,n=6)、AD运动组(AD-E,n=6)、野生对照组(WT-C,n=6)和野生运动组(WT-E,n=6)。WT-C组和AD-C组小鼠安静饲养,WT-E组和AD-E组进行10周中等强度跑台运动干预。采用Western blot法检测实验小鼠海马PGC-1a、FNDC5、BDNF和Aβ蛋白表达情况。结果表明:与AD-C组小鼠相比,AD-E组小鼠海马内Aβ蛋白表达水平显著下(P<0.01),PGC-1a蛋白表达水平显著上升(P<0.01),FNDC5蛋白表达水平显著上升(P<0.01),BDNF蛋白表达显著上升(P<0.01),Aβ蛋白含量显著下降(P<0.01)。由此得到如下结论:长期中等强度的有氧运动激活APP/PS1小鼠海马PGC-1a/FNDC5/BDNF信号通路,降低海马区Aβ蛋白表达,改善APP/PS1小鼠空间学习记忆能力。
关键词:阿尔茨海默病;运动;PGC-1a/FNDC5/BDNF信号通路;Aβ
中图分类号:G804.7文献标志码:A文章编号: 1001-2443(2024)01-0085-06
引言
阿尔茨海默病(Alzheimers disease,AD)又称老年痴呆症,是一种多发于老年人群的慢性神经退行性疾病,以学习记忆能力持续下降以及生活能力的减退为主要临床症状,以老年斑、神经纤维缠结、神经元异常丢失为主要病理特征[1]。AD致病机制复杂,其确切的发病机制仍待进一步阐明,但普遍认为是多种致病因素引起的,遗传、生活方式、衰老等因素均可导致AD的发生。截止目前尚无有效治疗AD的药物,因此,寻求一种有效预防和治疗AD的策略显得尤为重要[2]。已有的人体实验及动物实验均已证实, 积极的运动干预可改善AD患者认知功能,延缓AD病理进程,但运动改善AD患者认知功能,延缓AD病理进程的分子机制仍待进一步阐明[3]。
在AD病理进程中,脑源性神经营养因子 (brain derived neurotrophic factor, BDNF)参与调节AD病理,BDNF可有效抑制AD病理进程,改善AD小鼠的认知功能。研究发现,BDNF、过氧化物酶体增殖物激活受体γ辅激活因子-1a(peroxisome proliferators-activated receptor-γ coactivator-1alpha,PGC-1α)和含有III型结构域的纤连蛋白5(fibronectin type Ⅲ domain-containing protein 5,FNDC5)与运动以及AD病理进程之间存在潜在联系[4]。脑内PGC-1α/FNDC5/BDNF信号通路参与调节AD的病理进程,但运动通过调节PGC-1a/FNDC5/BDNF信号通路改善AD的研究较少,且分子机制也尚不清晰[5]。目前因此,本研究探讨运动是否通过激活海马PGC-1α/FNDC5/BDNF信号通路,减少海马内β-淀粉样蛋白(amyloid β-protein,Aβ)含量、延缓AD病理进程的作用。
2 实验材料与方法
2.1 实验动物
选用的4月龄APPswe/PS1dE9双转基因雄性小鼠和同窝野生型小鼠(C57BL/6)均购自南京模型动物研究中心(南京青龙山动物实验基地),小鼠饲养于标准动物房,分笼饲养,室温控制在22±2°C,室内湿度控制在40-60%之间,在饲养、训练和处死过程中严格遵循安徽师范大学动物实验伦理委员会的相关伦理规范。
2.2 实验分组
所有实验小鼠均进行适应性饲养1周,运动干预前将所有实验的小鼠随机分为4组,即APP/PS1双转基因小鼠分为转基因对照组(AD-C组)和转基因运动组(AD-E组),同窝野生型小鼠分为正常对照组(WT-C组)和正常運动组(WT-E组),每组6只。运动组小鼠进行10周的运动干预,对照组小鼠不进行运动干预,常规分笼饲养。
2.3 运动方案
本实验运动方案的制定参考学者Baker等人[6]的研究,在此基础上做出适当优化,运动方案结合AD患者现实生活中的实际情况,运动干预方案为10周中等强度的跑台训练(最大摄氧量的45%-55%)。运动分为运动适应阶段和正式训练阶段,运动适应阶段后的下一周立即进行正式训练。运动适应阶段具体的安排是:第一周进行适应性训练,周一至周五的训练时间为15分钟,跑台坡度0°。正式训练阶段:周一至周五进行训练,周六和周日休息,每天训练时间为45分钟,跑台速度由5m/min逐渐增至12m/min,为符合小鼠的生活习惯,跑台训练时间固定在每天的18:00—20:00时间段。
2.4 组织取材
10周运动干预结束后,所有小鼠禁食12小时,隔日进行组织取材。脱颈处死所有实验小鼠,剪开头皮和颅骨后迅速取出左右海马,用锡箔纸进行包裹,迅速放入液氮中暂时保存,取材全部结束后将组织放入-80℃超低温冰箱进行长期冷冻保存。
2.5 Western Blot法检测小鼠海马PGC-1a、FNDC5、BDNF和Aβ蛋白表达情况
取海马按1∶7的比例加入混有PMSF的裂解液,匀浆3-4次,低温离心,取上清,BCA试剂盒测定蛋白浓度,用SDS-PAGE进行凝胶电泳,后用PVDF转膜,孵一抗,4℃摇床过夜,次日孵二抗,TBST摇床清洗, ECL暗室显影,用AIpha成像系统曝光,ImageJ1.46进行灰密度值分析,将目的蛋白与内参平均密度的比值作为目的蛋白相对表达水平。
2.6 数据统计与分析
所获数据用平均数±标准差(Mean±SD)的形式表示,进行双因素方差分析,分析每个因素的主效应和2个因素间的交互作用;P<0.05表示为差异具有显著性,P<0.01表示为差异具有极显著性。
3 研究结果
3.1 有氧运动对小鼠海马内Aβ蛋白表达结果比较
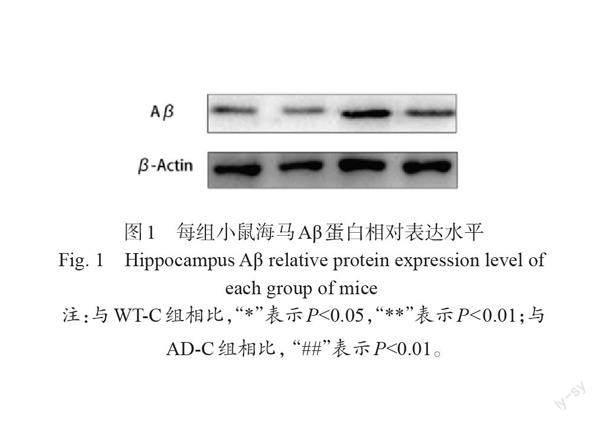
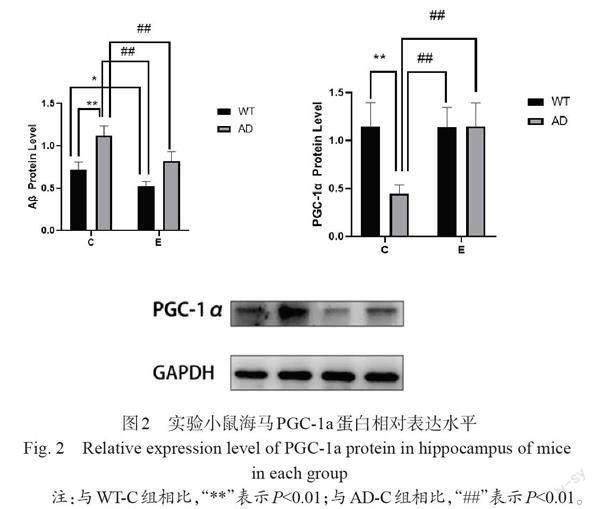
如表1所示, Western blot实验结果显示,与WT-C组小鼠相比,AD-C组小鼠海马Aβ蛋白表达高于WT-C组,呈现极显著性差异(P<0.01),WT-E组小鼠海马Aβ蛋白表达低于WT-C组,呈现显著性差异(P<0.05);与AD-C组小鼠相比,WT-E组小鼠海马Aβ蛋白表达低于AD-C组,呈现极显著性差异(P<0.01),AD-E组小鼠海马Aβ蛋白表达低于AD-C组,呈现极显著性差异(P<0.01),见图1。
3.2 有氧运动对PGC-1a/FNDC5/BDNF信号通路的影响
3.2.1 有氧运动对小鼠海马PGC-1a蛋白表达的影响 如表1所示, Western blot实验结果显示,与WT-C组小鼠相比,AD-C组小鼠海马PGC-1a蛋白表达低于WT-C组,呈现极显著性差异(P<0.01),WT-E组小鼠海马PGC-1a蛋白表达水平呈上升趋势,但差异没有显著性(P>0.05);与AD-C组小鼠相比,WT-E组小鼠海马PGC-1a蛋白表达高于AD-C组,呈现极显著性差异(P<0.01),AD-E组小鼠海马PGC-1a蛋白表达高于AD-C组,呈现极显著性差异(P<0.01),见图2。
3.2.2 有氧运动对小鼠海马FNDC5蛋白表达的影响 表1所示, Western blot实验结果显示,与WT-C组小鼠相比,AD-C组小鼠海马FNDC5蛋白表达低于WT-C组,呈现极显著性差异(P<0.01),WT-E组小鼠海马FNDC5蛋白表达水平呈上升趋势,但差异没有显著性(P> 0.05);与AD-C组小鼠相比,WT-E组小鼠海马FNDC5蛋白表达高于AD-C组,呈现极显著性差异(P<0.01),AD-E组小鼠海马FNDC5蛋白表达高于AD-C组,呈现极显著性差异(P<0.01),见图3。
3.2.3 有氧运动对小鼠海马BDNF蛋白表达的影响 如表1所示, Western blot实验结果显示,与WT-C组小鼠相比,AD-C组小鼠海马BDNF蛋白表达低于WT-C组,呈现极显著性差异(P<0.01),WT-E组小鼠海马BDNF蛋白表达水平呈上升趋势,但差异没有显著性(P> 0.05);与AD-C组小鼠相比,WT-E组小鼠海马BDNF蛋白表达高于AD-C组,呈现极显著性差异(P<0.01),AD-E组小鼠海马BDNF蛋白表达高于AD-C组,呈现极显著性差异(P<0.01),见图4。
4 讨论
AD可分为家庭性痴呆和散发性痴呆,生活中出现的痴呆大多数表现为散发性痴呆。家族性AD主要病因是由于脑内早老蛋白1(presenilin-1,PS1)、早老蛋白2(presenilin-2,PS2)和淀粉样前体蛋白(amyloid precursor protein,APP)的基因突变,导致海马区Aβ异常聚集以及神经纤维纠缠结的形成;散发性AD主要病因与Aβ细胞外异常沉积、tau蛋白在细胞内形成神经纤维纠缠结、氧化应激反应、炎症反应等因素密切相关[7]。Aβ级联学说认为Aβ主要是由神经元产生,主要是通过β-分泌酶和γ-分泌酶对APP水解后形成,Aβ主要存在Aβ40、Aβ42、Aβ38和Aβ37四种亚型,人脑中最常见的Aβ亚型主要有Aβ40和Aβ42,其中Aβ40在脑脊液和血液中的表达含量水平较高,Aβ40和Aβ42具有神经毒副作用,导致神经元异常丢失,诱发学习记忆障碍[8]。AD亦成为危害老年身心健康的主要疾病之一,因此,探寻有效的防治方案,成为亟待解决的问题。
早期的研究证明,运动可有效抑制APP/PS1转基因小鼠的病理进程,降低APP/PS1转基因小鼠海马Aβ含量[9]。近年也有研究对运动、Aβ和AD病理机制之间的潜在分子机制进行探讨,基本得出较为一致的研究结果,即规律的体育锻炼可以有效延缓AD的病理进程[10- 11]。Liu等[12]研究发现,3个月的跑台运动显著降低APP/PS1转基因小鼠海马Aβ42含量,显著提高APP/PS1转基因小鼠的行为能力。Xia 等[13]研究发现,3个月的跑台运动显著降低3月龄APP/PS1转基因小鼠海马Aβ斑块面积和可溶性Aβ的含量,同时也显著降低海马β-分泌酶和PS1蛋白表达水平。Liang等[14]研究发现,3个月的跑台运动可通过提高星形胶质细胞的功能加速AD模型小鼠海马内Aβ降解和清除速率,降低Aβ斑块面积,改善AD模型小鼠空间学习记忆能力。本研究发现,10周跑台运动可显著减轻APP/PS1转基因小鼠海马Aβ蛋白表达水平,延缓AD的病理进程。房国梁等[15]研究证实,为期8周的有氧运动可增强APP/PS1小鼠皮质和海马PI3K/Akt信号通路的活性,降低BACE1的含量,促进APP蛋白的降解,减轻APP/PS1小鼠海马内Aβ42聚集,抑制APP/PS1小鼠海马老年斑的形成。以上研究结果表明,长期中等强度的运动干预可降低AD小鼠海马Aβ蛋白表达水平,延缓AD的病理进程。
运动作为干预治疗AD的一种有效方式,已有的研究已经证实运动可抑制AD患者或AD模型小鼠海马Aβ沉积水平,减少老年斑的数量,但其确切的机制尚不明了。PGC-1α作为一种重要的线粒体能量代谢调节因子,可通过FNDC5调节脑内BDNF表达,起到神经保护的作用。PGC-1a/FNDC5/BDNF信号通路可能通过外周机制或中枢機制改善AD病理进程,提高AD学习记忆能力[16]。但运动是否通过PGC-1a/FNDC5/BDNF信号通路改善AD仍需要进一步的探讨。有研究发现运动可激活PGC-1a/FNDC5/BDNF信号通路,改善抑郁症的病理症状[17]。Wrann等[4]研究发现,小鼠敲除FNDC5基因后,海马BDNF蛋白表达水平显著下降,而上调小鼠FNDC5基因表达后,小鼠海马BDNF表达水平显著上。Liu等[12]研究发现,5个月的跑台运动可通过上调AD模型小鼠的BDNF表达提高突触长时程作用(Long-term potentiation,LTP)增强,改善AD模型小鼠海马的突触可塑性。余锋[18]研究中发现,16周的自主跑轮运动可通过上调APP/PS1转基因小鼠海马BDNF和神经生长因子(nerve gowth factor,NGF)表达水平,抑制海马Aβ的生成,改善AD小鼠学习记忆能力。
肌肉作为人体重要组织,不仅参与人体日常获得和体育运动,还是重要的分泌器官,肌组织可以分泌多种运动因子,调节机体多种功能,PGC-1α作为重要的肌肉因子,运动可激活脑和骨骼肌中PGC-1α的表达,Steiner等[19]研究发现,8周的跑台运动显著提高小鼠脑内PGC-1α表达水平,促进大脑线粒体的生物发生。先前的研究发现,AMPK作为重要的代谢调节因子之一,同时也是PGC-1α的重要上游调节因子,AMPK可直接激活骨骼肌中的PGC-1α[20]。Marosi等[21]研究发现, 15周的中等强度跑台运动显著提高Wistar大鼠海马内p-AMPK水平,进而上调Wistar大鼠海马PGC-1α的蛋白表达。此外,Azimi等[22]发现,4周的跑台运动提高 AD小鼠脑PGC-1α和FNDC5蛋白表达,抑制AD小鼠海马Aβ沉积水平,改善AD小鼠学习和记忆障碍。
FNDC5参与运动改善AD病理进程,在脑及骨骼肌中,FNDC5是PGC-1a的依赖性因子,PGC-1a表达增加可提高FNDC5的表达[23]。FNDC5可能参与抑制Aβ病理进程,而运动也可通过PGC-1α途径诱导小鼠海马FNDC5蛋白表达增加,从而利于对AD的预防[24]。先前研究发现,运动可提高肌肉或脑内FNDC5蛋白表达水平,Lourenco等[16]8研究证实,外周过表达FNDC5/Irisin可显著改善AD学习记忆障碍,而脑内FNDC5/Irisin表达下降会降低运动对AD小鼠海马突触可塑性和记忆功能的保护作用,表明FNDC5/Irisin可能是运动改善AD学习记忆能力的重要介质。Hegazy等[25]研究发现,游泳运动可提高AD大鼠海马FNDC5/Irisin蛋白表达水平,进一步抑制Aβ42和磷酸化tau蛋白的积累,促进胰岛素信号传导、BDNF蛋白和认知功能的改善,并相应减轻AD大鼠的认知功能障碍。Belviranl?等[5]13研究发现,3个月的跑台运动显著上调老年Wistar大鼠海马内PGC-1、FNDC5和BDNF蛋白表达,改善老年Wistar大鼠的学习记忆能力,表明运动改善认知功能障碍可能与海马PGC-1α、FNDC5和BDNF表达增加有关。本研究通过检测各组小鼠海马内PGC-1α、FNDC5和BDNF的蛋白表达,结果发现,APP/PS1小鼠海马PGC-1a、FNDC5和BDNF蛋白表达显著低于野生型小鼠,表明随着年龄的增加,APP/PS1小鼠呈现出明显的病理特征,导致海马内PGC-1a蛋白表达水平降低,下调FNDC5和BDNF蛋白表达水平。而经过10周的运动干预,运动组小鼠海马PGC-1a、FNDC5和BDNF蛋白均显著上升,提示有氧运动干预可显著上调APP/PS1小鼠海马PGC-1a、FNDC5和BDNF的含量,改善AD病理状态。此外,Wrann和Belviranl?等人也得出相一致的研究结果[4]31。LeeG等[8]55研究发现,12周的有氧和抗阻联合运动提高运动大鼠海马及皮层PGC-1α、FNDC5和BDNF的蛋白表达水平,降低海马内Aβ沉积水平,有效改善模型大鼠的心肺功能、肌肉耐力和短期记忆能力。Wrann等[4]38研究也发现,耐力运动可以通过激活海马PGC-1a/FNDC5途径来诱导BDNF的表达,从而改善认知功能。本研究与上述研究相一致。
5 结论
APP/PS1小鼠海马Aβ含量显著增加,海马PGC-1α/FNDC5/BDNF信号通路关键蛋白表达下降,而10周中等强度的跑台运动通过激活海马PGC-1α/FNDC5/BDNF信号通路减轻APP/PS1小鼠海马Aβ含量,延缓AD的病理进程。
参考文献:
[1] 何标,仲飞,王运良,等.力量锻炼改善阿尔茨海默症学习记忆能力研究进展[J].中国运动医学杂志,2023,42(3):248-253.
[2] 吴慧民,郑永涛,王运良,等.运动调节神经炎症改善阿尔茨海默病的研究进展[J].生命的化学,2022, 42(7):1329-1336.
[3] 余锋,贾芳芳,徐帅,等.自主运动抑制tau蛋白过度磷酸化改善学习记忆的分子机制[J]. 西安体育学院学报,2021,38(1):105-115.
[4] WRANN C D, WHITE J P, SALGIANNNNIS J, et al. Exercise induces hippocampal BDNF through a PGC-1alpha/FNDC5 pathway[J].Cell Metab, 2013, 18(5): 649-659.
[5] BELVIRANLI M, OKUDAN N. Exercise training protects against aging-induced cognitive dysfunction via activation of the hippocampal PGC-1alpha/FNDC5/BDNF pathway[J]. Neuromolecular Med,2018,20(3):386-400.
[6] BAKER E J, GLEESON T T. The effects of intensity on the energetics of brief locomotor activity[J].J Exp Biol,1999,202(22):3081-3087.
[7] 何標,梁艳,徐波,等.跑台运动对TgAPP/PS1小鼠海马Aβ转运清除的影响[J].体育学刊. 2018,25(4):134-139.
[8] LEE G, KIM Y, JANG J H,et al.Effects of an exercise program combining aerobic and resistance training on protein expressions of neurotrophic factors in obese rats injected with beta-amyloid[J].Int J Environ Res Public Health,2022,19(13):53-68.
[9] ZHANG J, GUO Y, WANG Y, et al.Long-term treadmill exercise attenuates Abeta burdens and astrocyte activation in APP/PS1 mouse model of Alzheimer's disease[J].Neurosci Lett,2018,666:70-77.
[10] 徐波,李百侠,赵娜,等.运动通过改善线粒体功能预防和缓解AD的研究进展[J].体育科学, 2018,38(9):72-77.
[11] 蒋杨林,王先泽,吕康,等.运动调节小胶质细胞延缓阿尔茨海默症的研究进展[J]. 生命的化学,2021,41(9):1981-1988.
[12] LIU H L, ZHAO G, ZHANG H, et al.Long-term treadmill exercise inhibits the progression of Alzheimer's disease-like neuropathology in the hippocampus of APP/PS1 transgenic mice[J].Behav Brain Res,2013,256:261-272.
[13] XIA J, LI B, YIN L, et al.Treadmill exercise decreases beta-amyloid burden in APP/PS1 transgenic mice involving regulation of the unfolded protein response[J]. Neurosci Lett,2019,703:125-131.
[14] LIANG F, SUN F, HE B, et al.Treadmill exercise promotes microglial beta-amyloid clearance and prevents cognitive decline in APP/PS1 mice[J].Neuroscience,2022,491: 122-133.
[15] 房国梁,赵杰修,张漓,等.有氧运动通过增强PI3K/Akt信号通路活性抑制阿尔茨海默症小鼠大脑皮质和海马组织老年斑的形成[J].中国体育科技,2019,55(1):22-27.
[16] LOURENCO M V, FROZZA R L, dE FREITAS G B, et al.Exercise-linked FNDC5/irisin rescues synaptic plasticity and memory defects in Alzheimer's models[J].Nat Med, 2019,25(1):165-175.
[17] LUCAS E K, DOUGHERTY S E, MCMEEKIN L J,et al.PGC-1alpha provides a transcriptional framework for synchronous neurotransmitter release from parvalbumin-positive interneurons[J].J Neurosci,2014,34(43):14375-14387.
[18] 余鋒.跑轮运动对APP/PS1转基因AD小鼠学习记忆和海马Aβ沉积的影响[D].上海:华东师范大学,2015:174.
[19] STEINER J L, MURPHY E A, MCCLELLER J L,et al.Exercise training increases mitochondrial biogenesis in the brain[J].J Appl Physiol,2011,111(4):1066-1071.
[20] JAGER S, HANDSCHIN C, ST-PIERRE J, et al.AMP-activated protein kinase (AMPK) action in skeletal muscle via direct phosphorylation of PGC-1alpha[J]. Proc Natl Acad Sci U S A,2007,104(29):12017-12022.
[21] MAROSI K, BORI Z, HART N, et al.Long-term exercise treatment reduces oxidative stress in the hippocampus of aging rats[J].Neuroscience,2012,226:21-28.
[22] AZIMI M, GHARAKHANLOU R, NAGHDI N, et al. Moderate treadmill exercise ameliorates amyloid-beta-induced learning and memory impairment, possibly via increasing AMPK activity and up-regulation of the PGC-1alpha/FNDC5/BDNF pathway[J].Peptides,2018, 102:78-88.
[23] WRANN C D. FNDC5/irisin - their role in the nervous system and as a mediator for beneficial effects of exercise on the brain[J]. Brain Plast,2015,1(1):55-61.
[24] YOUNG M F, VALARIS S, WRANN C D. A role for FNDC5/Irisin in the beneficial effects of exercise on the brain and in neurodegenerative diseases[J]. Prog Cardiovasc Dis, 2019,62(2):172-178.
[25] HEGAZUY M A, ABDE LMONSIF D A, ZEITOUN T M, et al.Swimming exercise versus L-carnosine supplementation for Alzheimer's dementia in rats:implication of circulating and hippocampal FNDC5/irisin[J].J Physiol Biochem, 2022,78(1):109-124.
The Mechanism of Treadmill Exercise Activating PGC-1a / FNDC5 / BDNF Pathway Delaying the Pathological Process of APP/PS1 Mice
JIN Di1,2, WU Hui-min1, HE Biao1, WANG Yun-liang1
(1. College of Physical Education, Anhui Normal University, Wuhu 241000, China; 2 Anhui Provincial Student Physical Health Monitoring and Research Center, Anhui Normal University, Wuhu 241000, China)
Abstract: objective: to explore the mechanism of exercise-induced PGC-1a/FNDC5/BDNF signaling pathway in cognitive impairment in APP/PS1 mice. Methods: twelve 4-month-old male APPswe/PS1 transgenic mice and 12 littermates of wild-type mice were selected, and randomly divided into AD control group (AD-C, N = 6) , AD exercise group (AD-E, N = 6) , wild control group (WT-C, N = 6) and wild exercise group (WT-E, N = 6) . Mice in WT-C and AD-C groups were reared quietly, and mice in WT-E and AD-E groups were subjected to 10-week moderate intensity treadmill exercise intervention. Western blot was used to detect the expression of PGC-1a, FNDC5, BDNF and Aβ protein in the hippocampus of mice. Results: compared with AD-C group,in AD-E group, the expression level of Aβ protein was significantly decreased(P<0.01) , the expression level of PGC-1a protein was significantly increased(P<0.01), and the expression level of FNDC5 protein was significantly increased(P<0.01) , the expression of BDNF protein was significantly increased(P<0.01),while the content of AΒ protein was significantly decreased (P<0.01). Conclusion: long-term moderate intensity aerobic exercise can activate PGC-1A/FNDC5/BDNF signaling pathway in hippocampus of APP/PS1 mice, decrease the expression of Aβ protein in hippocampus, and improve the ability of spatial learning and memory of APP/PS1 mice.
Key words: Alzheimer's disease; exercise; PGC-1a/FNDC5/BDNF signaling pathway; Aβ
(責任编辑:叶松庆)
收稿日期:2023-06-19
基金项目:安徽省自然科学研究项目(1908085MC89;2108085MH265);安徽省教育厅自然科学研究重点项目(KJ2018A0318).
作者简介:金迪(1985—),女,安徽阜阳市人,硕士,讲师,主要研究方向为体育锻炼与身心健康;通讯作者:何标(1982—),男,安徽淮北市人,博士,副教授,硕士生导师,主要研究方向为体育锻炼与身心健康.
引用格式:金迪,吴慧民,何标,等.运动激活PGC-1a/FNDC5/BDNF通路延缓APP/PS1小鼠病理进程的机制研究[J].安徽师范大学学报(自然科学版),2024,47(1):85-90.
