高表达LINC00626 通过JAK1/STAT3/KHSRP 信号轴促进食管胃结合部腺癌转移的恶性进展
2024-04-13范林林韦海涛
张 锋,范林林,康 霞,韦海涛,李 丽,
河南大学1淮河医院胸外科,2护理与健康学院,河南 开封475001
食管胃结合部腺癌(EGJ)在全球癌症相关死亡原因中排名第4[1],每年有超过150万患者[2],由于早期症状不明显,EGJ患者在首次诊断时往往会出现局部侵袭和远处转移,导致EGJ患者的预后较差[3],总体五年生存率约为10%~15%[4]。有关EGJ发病机制的临床研究尚未明确[5]。因此,深入研究EGJ发生与发展的分子机制,并寻找用于临床诊断和治疗EGJ的分子标志物[6],对于改善临床诊断和治疗方法具有重要意义[7,8]。
长链非编码RNA(lncRNA)的失调在各种癌症中已经普遍存在,并被确认为人类癌症的重要调节因子[9]。越来越多的lncRNA被证实在EGJ细胞增殖、凋亡、细胞周期、迁移和侵袭中发挥着关键作用[4,10]。因此,lncRNA不仅是一种潜在生物标志物,也是一种新的分子治疗靶点[11]。JAK/STAT信号通路是许多细胞因子进行细胞内外信息传导的主要通路,研究表明JAK/STAT3信号通路广泛参与细胞增殖、分化、凋亡和炎症等多种生理过程[12],并与癌症的发病机制和进展密切相关[13]。KH型剪接调节蛋白(KHSRP)含有多个KH结构域,这些结构域通过与靶RNA分子结合,调节其在剪接过程中的选择性和效率。KHSRP与RNA结合后能够影响RNA的稳定性、核外转运以及翻译的调控。除了参与RNA的剪接和转运,KHSRP还对RNA的转录、剪接和翻译后修饰等起到调节作用[14]。
LINC00626 在EGJ 中的作用机制目前尚未见报道。鉴于lncRNA在EGJ中的潜在作用,我们旨在研究LINC00626在EGJ发生发展中的作用。已经有充分研究表明,非编码转录本通过以序列特异性模式与RNA结合蛋白(RBP)相互作用,在癌症中发挥着重要的调节作用[15],KHSRP参与各种生物过程中的信号转导和转录激活因子(STAT)和NF-κB信号通路[16]。因此,我们在前期质谱分析发现KHSRP基础上研究LINC00626在临床EGJ 组织中的表达,并进一步分析其表达水平与JAK/STAT信号通路激活之间的关系。
1 材料和方法
1.1 细胞实验
1.1.1 实验细胞、主要试剂及仪器 食管腺癌细胞系OE-19、TE-7、BIC-1、FLO-1、SK-GT-4、BE-3和DMEM培养基(武汉普诺赛公司)。正常食管上皮细胞Het-1A(宁波明舟生物公司)。TRIzol试剂、CCK-8试剂盒、10%聚偏二氟乙烯膜(Sigma Aldrich)。HiScript®II逆转录酶试剂盒、通用型高特异性染料法定量PCR检测试剂盒、RIPA缓冲液(北京索莱宝公司),BCA蛋白质定量试剂盒(南京诺唯赞公司),Transwell小室(Corning),慢病毒试剂(上海吉玛公司),流式细胞仪(Beckman),荧光显微镜(Olympus),Nano Drop 2000c分光光度计(赛默飞),酶标仪(北京普天新桥限公司)。
1.1.2 细胞培养及转染 将细胞放置在5%CO2、37 ℃的细胞培养箱中用含10%胎牛血清、100 U/mL青霉素和100µg/mL链霉素的DMEM培养基进行培养。后续细胞功能实验将选用表达相对较高的(OE-19、TE-7)和表达量相对较低的(FLO-1、SK-GT-4)细胞系进行。首先根据获取的LINC00626全长序列设计特异性敲降和过表达的RNA序列,并构建到稳定敲降载体和稳定过表达载体上,其中FLO-1、SK-GT-4做过表达处理,OE-19、TE-7做敲降处理。准备4个6孔板,将FLO-1、SK-GT-4、OE-19、TE-7细胞分别接种到6孔板中,加入无双抗的完全培养基DMEM至2 mL,放入培养箱中进行培养,当细胞生长至70~80% 以上的密度时开始转染,从-80 ℃冰箱取出敲降LINC00626及敲降对照LV3-NC慢病毒和过表达LINC00626慢病毒以及过表达对照LV6-NC慢病毒放置冰上,待融化后使用移液器分别吸出20µL慢病毒和2µL polybrene液加入原先铺好的6孔板的孔中,轻轻混匀,放置细胞培养箱中进行培养。12 h后吸去含有病毒的培养基,换上新鲜培养基,37 ℃继续培养。培养48 h后弃去细胞六孔板中带病毒液的培养基,按照4µL/mL加入嘌呤霉素,24 h加大至8µL/mL后根据细胞状态继续筛选,每2 d或者有大量漂浮细胞时换液。持续观察直至没有死亡细胞后得到稳定转染的敲降OE-19、阴性对照及敲降TE-7、阴性对照和过表达FLO-1、阴性对照及过表达SK-GT-4、阴性对照细胞株。OE-19细胞分为sh-NC组(转染LV3-NC慢病毒)sh-LINC00626组(转染敲降LINC0062慢病毒);TE-7细胞分为sh-NC组(转染LV3-NC慢病毒)sh-LINC00626组(转染敲降LINC0062 慢病毒);FLO-1 细胞分为Vector组(转染LV6-NC慢病毒)INC00626组(转染过表达LINC0062慢病毒);SK-GT-4细胞分为Vector组(转染LV6-NC 慢病毒)INC00626 组(转染过表达LINC0062慢病毒)。
1.1.3 qRT-PCR 使用TRIzol试剂提取组织、细胞中的总RNA,Nano Drop 2000c分光光度计测量RNA的浓度和纯度,然后进行反转录。使用qRT-PCR试剂盒检测LINC00626、KHSRP mRNA的表达量。引物由上海生物工程公司合成。GAPDH和U6作为对照,2-ΔΔCt法进行分析(表1)。
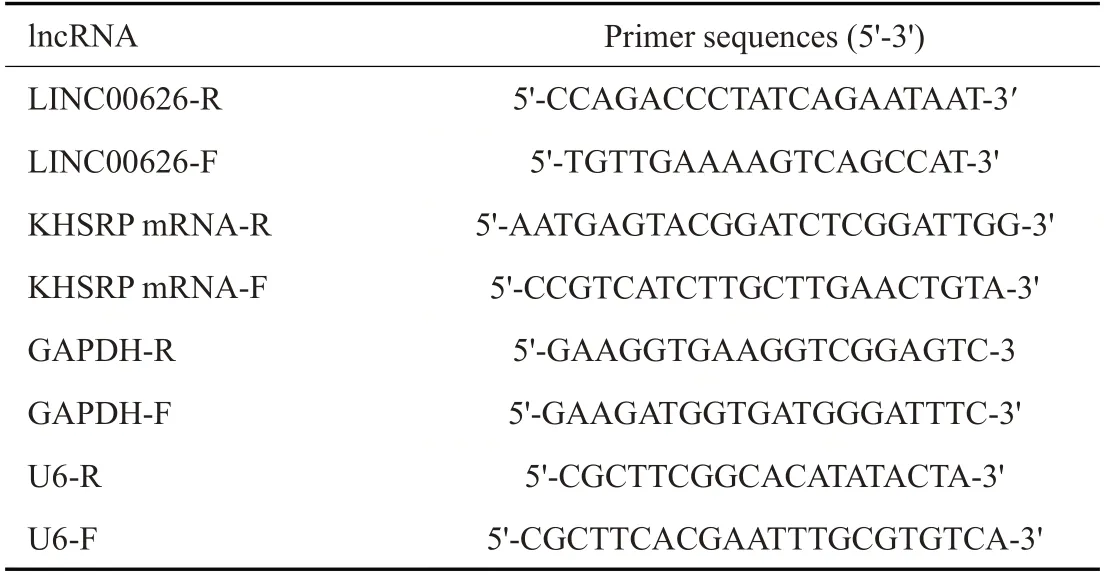
表1 片段引物Tab.1 Fragment primers
1.1.4 CCK-8实验 将细胞以1×104/孔接种到96孔板中,分别在细胞贴壁后、24、48、72和96 h时间点测试。每次测试前采用CCK-8试剂盒在每个孔中加入110µL培养基(100µL无血清培养基+10µL CCK-8溶液),孵育2 h后用酶标仪在450 nm处测量吸光度。
1.1.5 Transwell小室实验 采用Transwell小室(含/不含Matrigel胶)检测细胞侵袭、迁移能力。将200µL无血清培养基添加到上室,在下室中添加含有胎牛血清的培养基700µL。孵育24 h(迁移)/48 h(侵袭)后,去除留在膜上的细胞,并进行固定和染色。在倒置显微镜下以400倍率拍摄图像。对5个随机区域中的细胞进行计数,获得迁移或侵袭细胞平均数。
1.1.6 Western blotting实验 采用RIPA缓冲液提取细胞总蛋白。BCA 蛋白质定量试剂盒进行定量。通过SDS凝胶电泳将蛋白质分离,之后转移到PVDF模中,在5%脱脂牛奶中室温下封闭1 h,再与GAPDH抗体和一抗KHSRP 4 ℃下孵育过夜,使用TBST洗涤3遍,与二抗一起室温下放置1.5 h。使用ECL试剂盒化学发光。
1.2 病例标本实验
收集2020 年1月和2022 年12月在河南大学淮河医院进行手术切除的EGJ患者64例。全部患者手术方式均由同一个手术团队进行,术中在标本离体20 min内迅速取材,无菌条件下留取新鲜EGJ组织及癌旁距肿瘤大于5 cm正常组织。所有参与者已签署知情同意书。本实验经河南大学淮河医院伦理委员会批准(批准编号:HUSOM2023-348)。
1.3 裸鼠实验
1.3.1 皮下成瘤实验 将32只从北京维通利华公司购买的4-6w雄性裸鼠随机分为4笼,每组8只,分别命名为sh-NC组、sh-LINC00626组、Vector组、LINC00626组。sh-NC组、sh-LINC00626组腹腔注射稳定转染的OE-19细胞,Vector组、LINC00626组腹腔注射稳定转染的FLO-1细胞,注射剂量均为5×106个细胞。每3 d测量1次肿瘤体积/体质量,体积公式为:体积(mm3)=长×宽2×0.5。分别于第26天(敲降实验)和第21天(过表达实验)处死小鼠。
1.3.2 尾静脉肺转移模型实验 将40只从北京维通利华公司购买的4~6周龄雄性裸鼠,随机分为4笼,每组10只(饲养过程中,sh-NC组和sh-LINC00626组均有2只裸鼠死亡),分别命名为sh-NC组、sh-LINC00626组、Vector组、LINC00626组。sh-NC组、sh-LINC00626组尾静脉注射稳定转染的OE-19 细胞,Vector 组、LINC00626组尾静脉注射稳定转染的FLO-1细胞。注射浓度为1×106/mL,尾静脉接种0.1 mL/只。分别于第35天(敲降实验)和第28天(过表达实验)后,以颈椎脱臼法处死裸鼠,剖离并取出肺组织,肉眼和解剖显微镜下同时计数肺部转移病灶数。
1.4 统计学分析
采用GraphPad Prism 8.0 软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,采用独立样本t检验或单因素方差分析进行组间比较。计数资料以例(%)表示,采用卡方检验进行组间比较。采用ROC曲线预测LINC00626的诊断价值。双侧检验,检验校准α=0.05。
2 结果
2.1 LINC00626在食管胃结合部腺癌组织和细胞系中表达均显著上调
qRT-PCR结果显示,EGJ组织中LINC00626表达水平高于癌旁组织(图1A,P<0.001);食管腺癌细胞系中LINC00626表达水平高于食管正常上皮细胞(图1B,P<0.05)。ROC显示,LINC00626在64例EGJ组织总样本中AUC=0.8035(图1C,P<0.001);LINC00626在32例EGJ表达上调样本中AUC=0.8635(图1D,P<0.001);32 例表达上调EGJ 患者不同分期的AUC=0.9228(图1E,P<0.001);32例表达上调EGJ患者有无淋巴结转移的AUC=0.9458(图1F,P<0.001)。
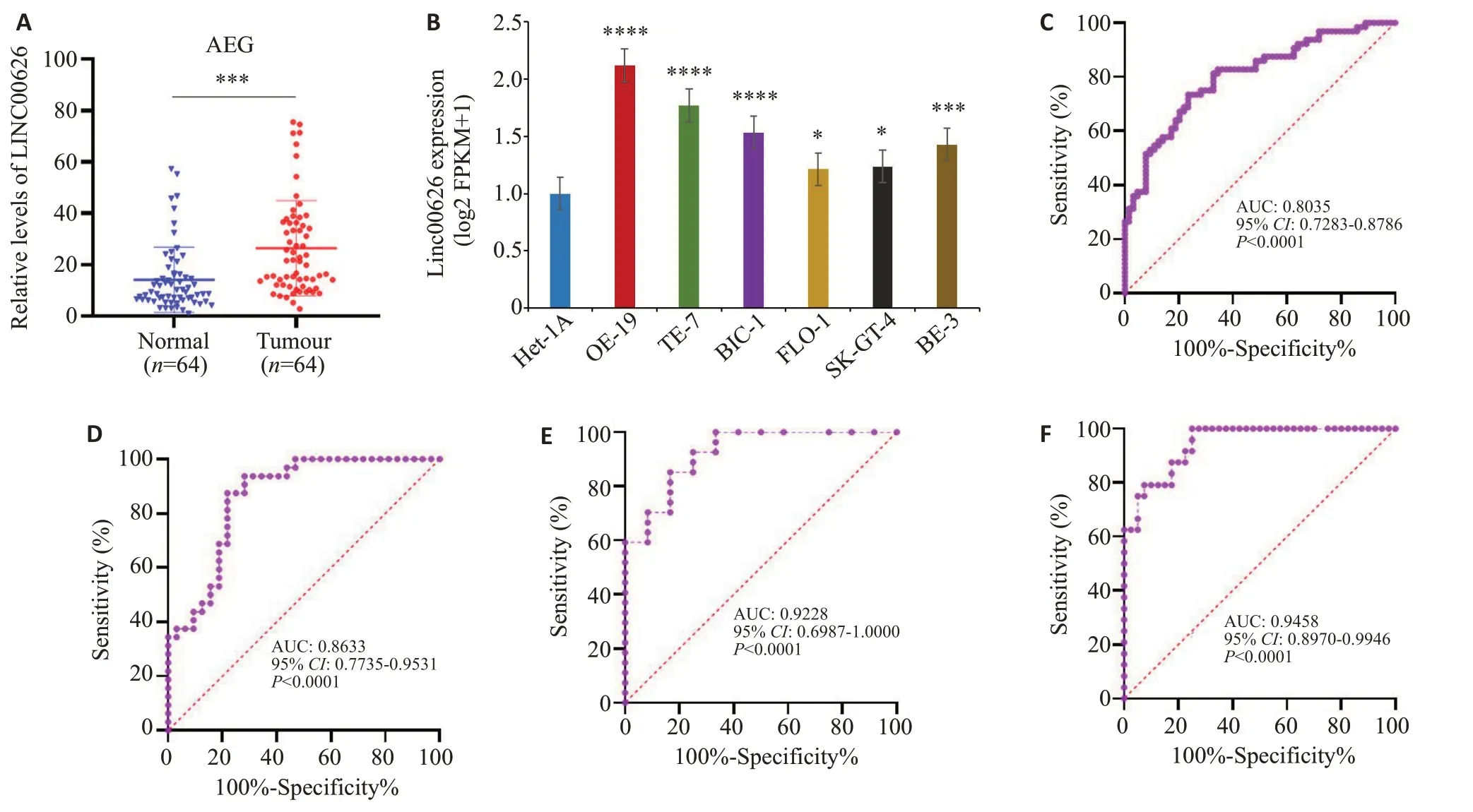
图1 LINC00626在EGJ中高表达Fig.1 LINC00626 is upregulated in esophagogastric junction (EGJ) adenocarcinoma. A: qRT-PCR for detecting LINC00626 expression of EGJ adenocarcinoma tissue.B:qRT-PCR for detecting LINC00626 expression in esophageal adenocarcinoma cell lines. C: ROC curve of LINC00626 expression in 64 EGJ tissue samples. D: ROC curve of LINC00626 expression in 32 EGJ tissues with upregulated LINC00626.E:ROC curves of LINC00626 expression in 32 cases with upregulated at different stages.F:ROC curves of LINC00626 expression in tissues with and without lymph node metastasis in 32 cases.*P<0.05,***P<0.001,****P<0.0001 vs Het-1A.
2.2 LINC00626促进体外细胞增殖、迁移和侵袭
qRT-PCR 实验检测转染效率(图2,P<0.001)。CCK-8实验结果显示,sh-LINC00626组细胞增殖能力明显低于sh-NC组,过表达则反之(图3,P<0.001)。Transwell小室实验结果显示:sh-LINC00626组细胞侵袭、迁移能力明显低于sh-NC组,过表达则反之(图4,P<0.01)。
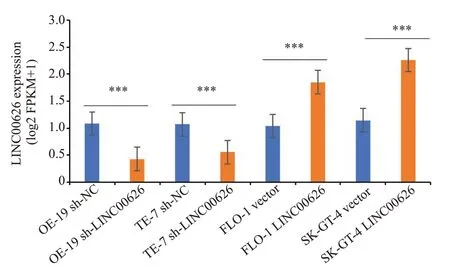
图2 RT-qPCR实验检测转染效率Fig.2 RT-qPCR experiment to detect transfection efficiency(***P<0.001).
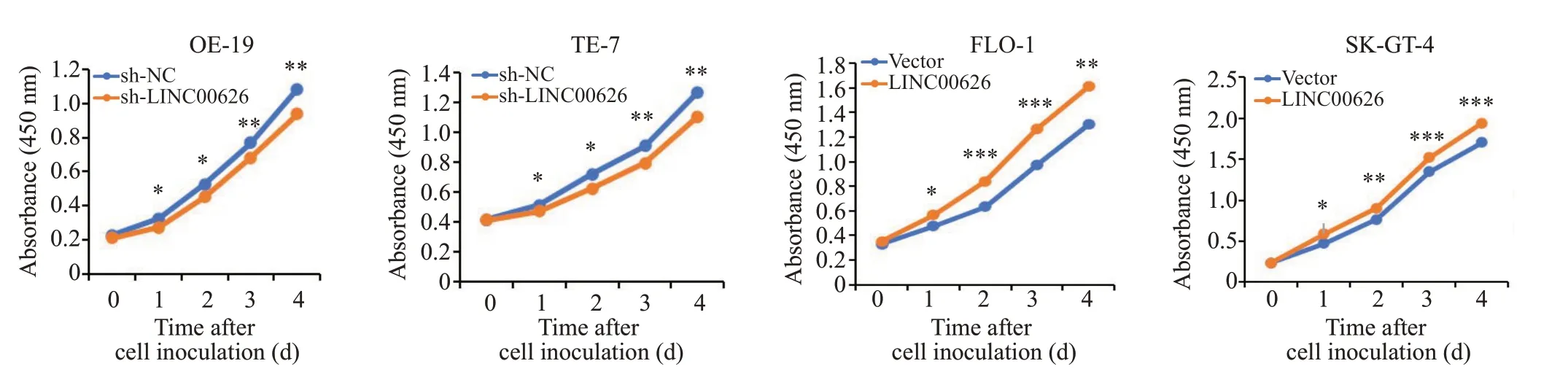
图3 CCK-8实验检测细胞增殖能力Fig.3 CCK-8 assay for assessing cell proliferation ability(*P<0.05,**P<0.01,***P<0.001).
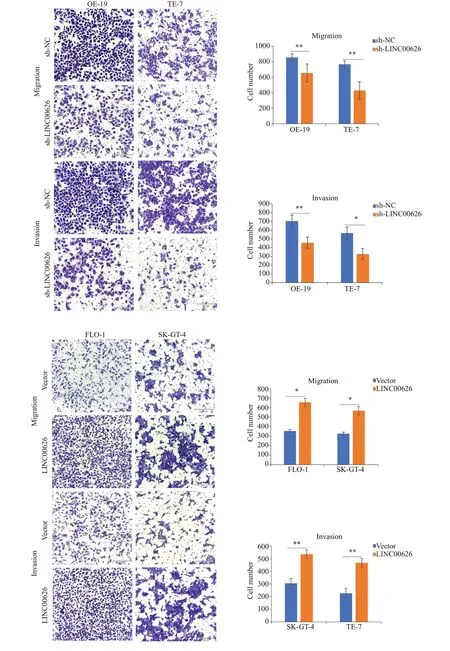
图4 Transwell小室实验检测细胞迁移和侵袭能力Fig.4 Transwell chamber assay for detecting cell migration and invasion abilities(scale bar=210 μm;*P<0.05,**P<0.01).
2.3 LINC00626促进裸鼠体内细胞生长和转移
皮下成瘤实验中,sh-LINC00626 组中肿瘤体积和质量明显低于sh-NC组,过表达组则反之(图5,P<0.01)。尾静脉肺转移模型实验中,sh-LINC00626组中肺转移结节数量明显低于sh-NC组,过表达组则反之(图6,P<0.01)。
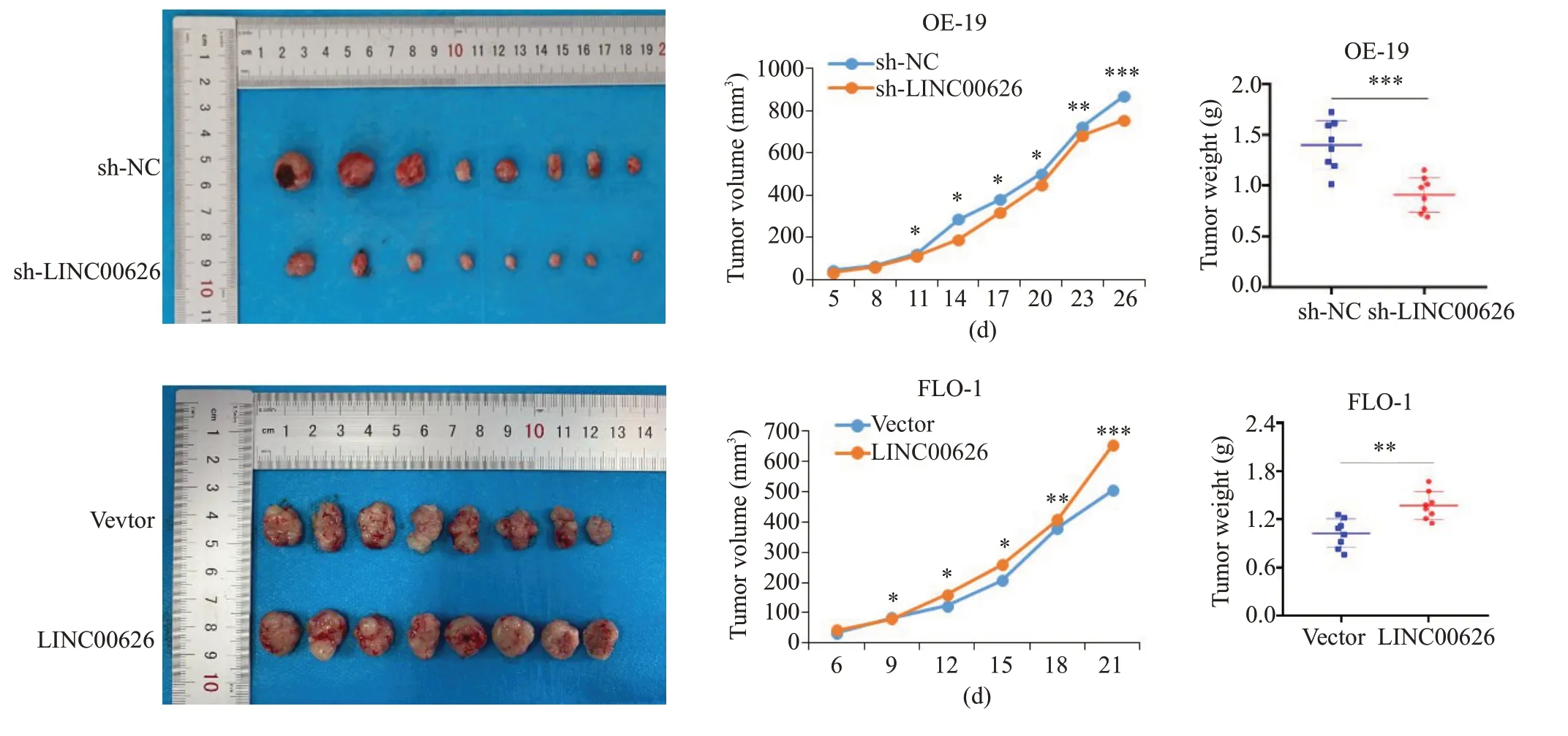
图5 皮下成瘤实验检测LINC00626对裸鼠体内细胞增殖能力的影响Fig.5 Subcutaneous tumorigenesis experiment for assessing the effect of LINC00626 expression level on cell proliferation ability in nude mice(*P<0.05,**P<0.01,***P<0.001).
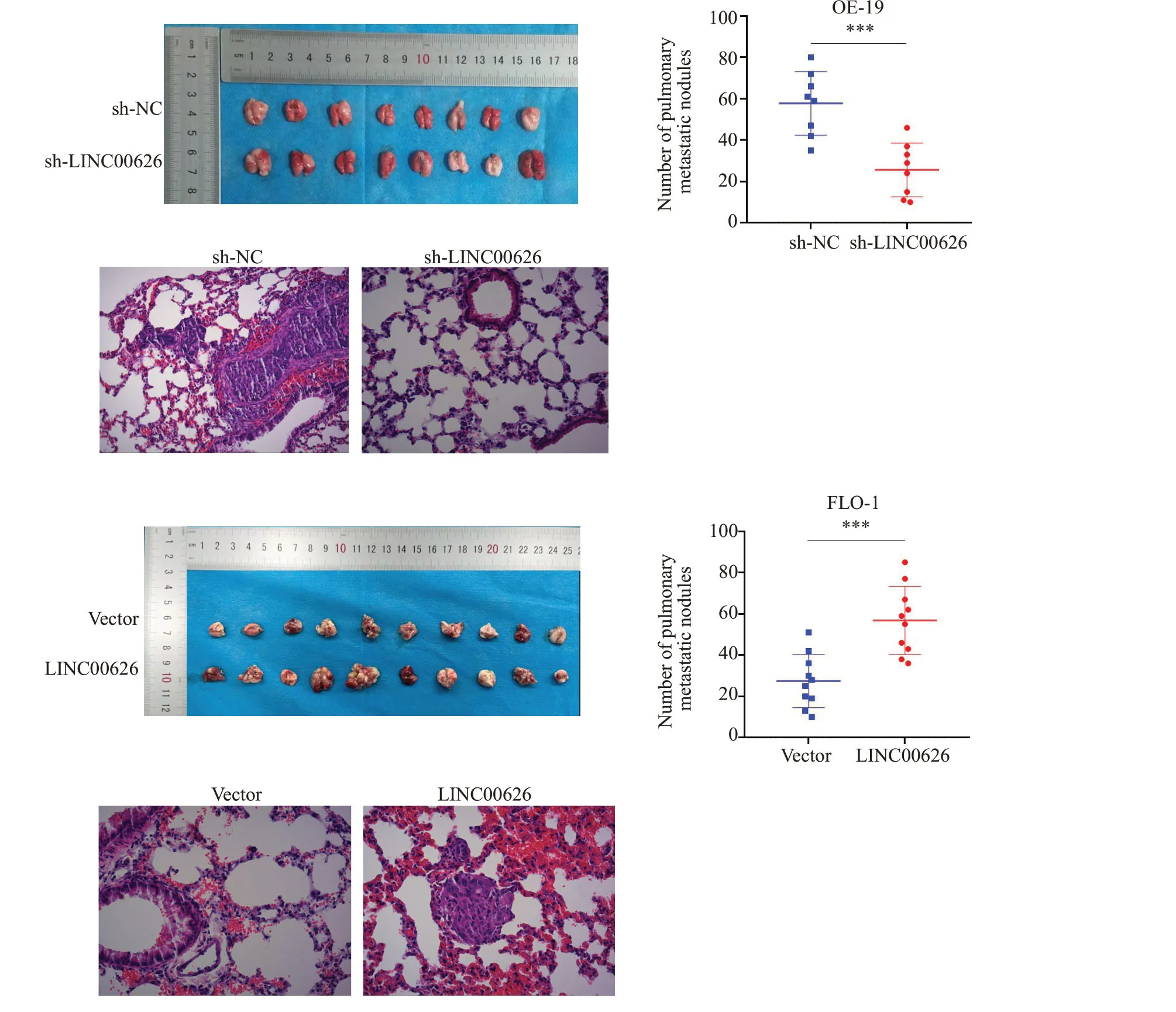
图6 尾脉肺转移模型实验验检测LINC00626对裸鼠体内转移能力的影响(显微镜下食管胃结合部腺癌肺脏组织病理图)Fig.6 Effect of LINC00626 expression level on lung metastasis ability of esophageal adenocarcinoma cells injected via the tail vein in nude mice (HE staining,×200).***P<0.001.
2.4 KHSRP在EGJ组织和细胞系中表达均显著上调
qRT-PCR结果显示,EGJ组织中KHSRP表达水平明显高于正常组织(图7A,P<0.001);食管腺癌细胞系中KHSRP 表达水平高于食管正常上皮细胞(图7B,P<0.05)。64例EGJ组织中LINC00626和KHSRP呈正相关(图7C,P<0.0001)。
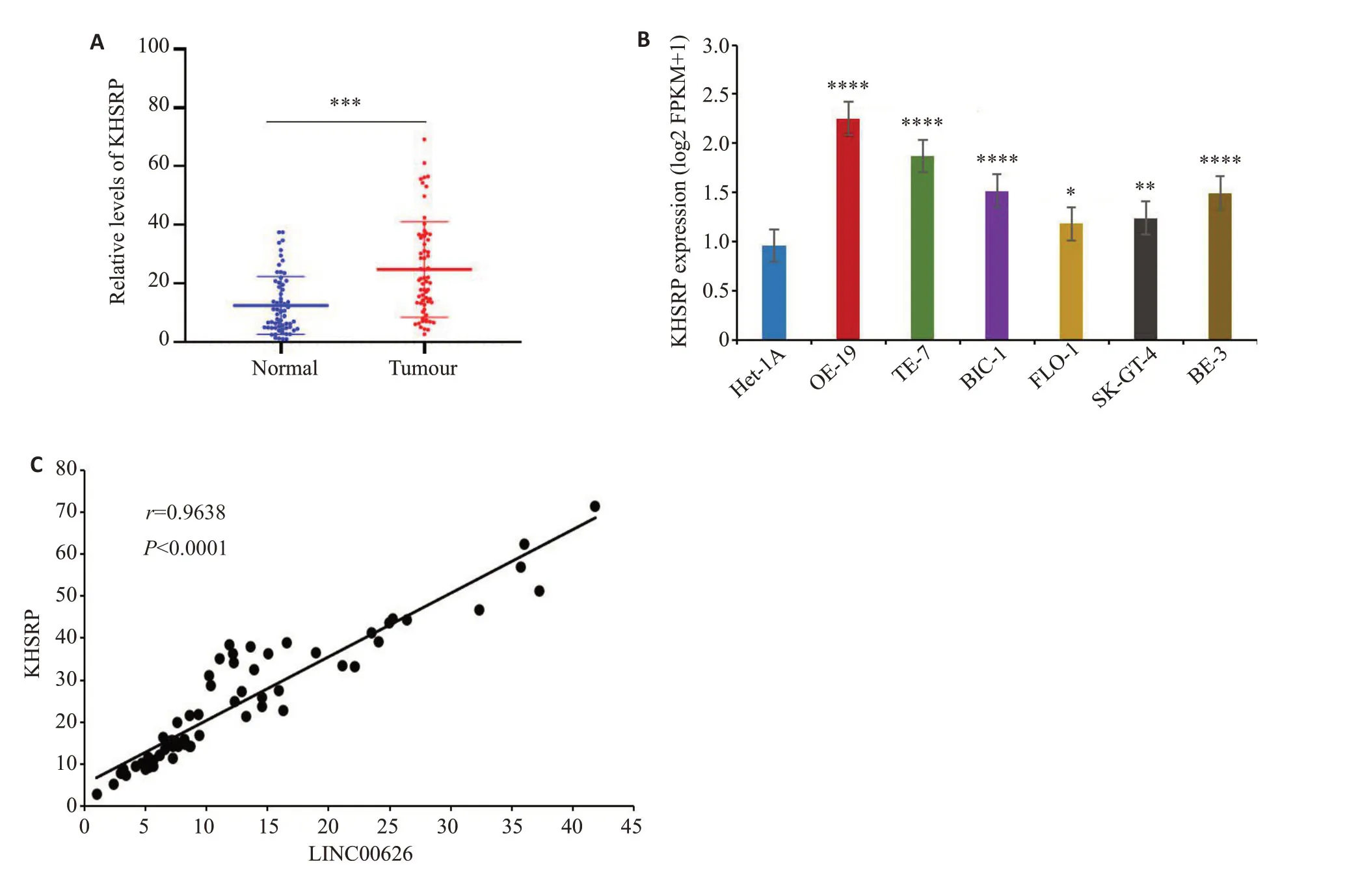
图7 KHSRP在EGJ中高表达Fig.7 High expression of KHSRP in EGJ adenocarcinoma tissue and esophageal adenocarcinoma cell lines. A:qRT-PCR of KHSRP mRNA expression in EGJ adenocarcinoma. B: qRT-PCR for detecting KHSRP mRNA expression in esophageal adenocarcinoma cell lines.C:Pearson correlation analysis showing a positive correlation between LINC00626 and KHSRP.*P<0.05,**P<0.01,****P<0.0001 vs Het-1A.
2.5 KHSRP逆转LINC00626对细胞增殖、迁移、侵袭能力的影响
qRT-PCR 结果显示,KHSRP 可以逆转敲降LINC00626对细胞的抑制作用(图8A,P<0.01)。CCK-8结果显示,KHSRP可以逆转sh-LINC00626对细胞增殖的抑制作用(图8B,P<0.001);Transwell 小室实验结果显示,KHSRP 可以逆转由sh-LINC00626 对细胞迁移、侵袭的抑制作用(图8C,P<0.01)。
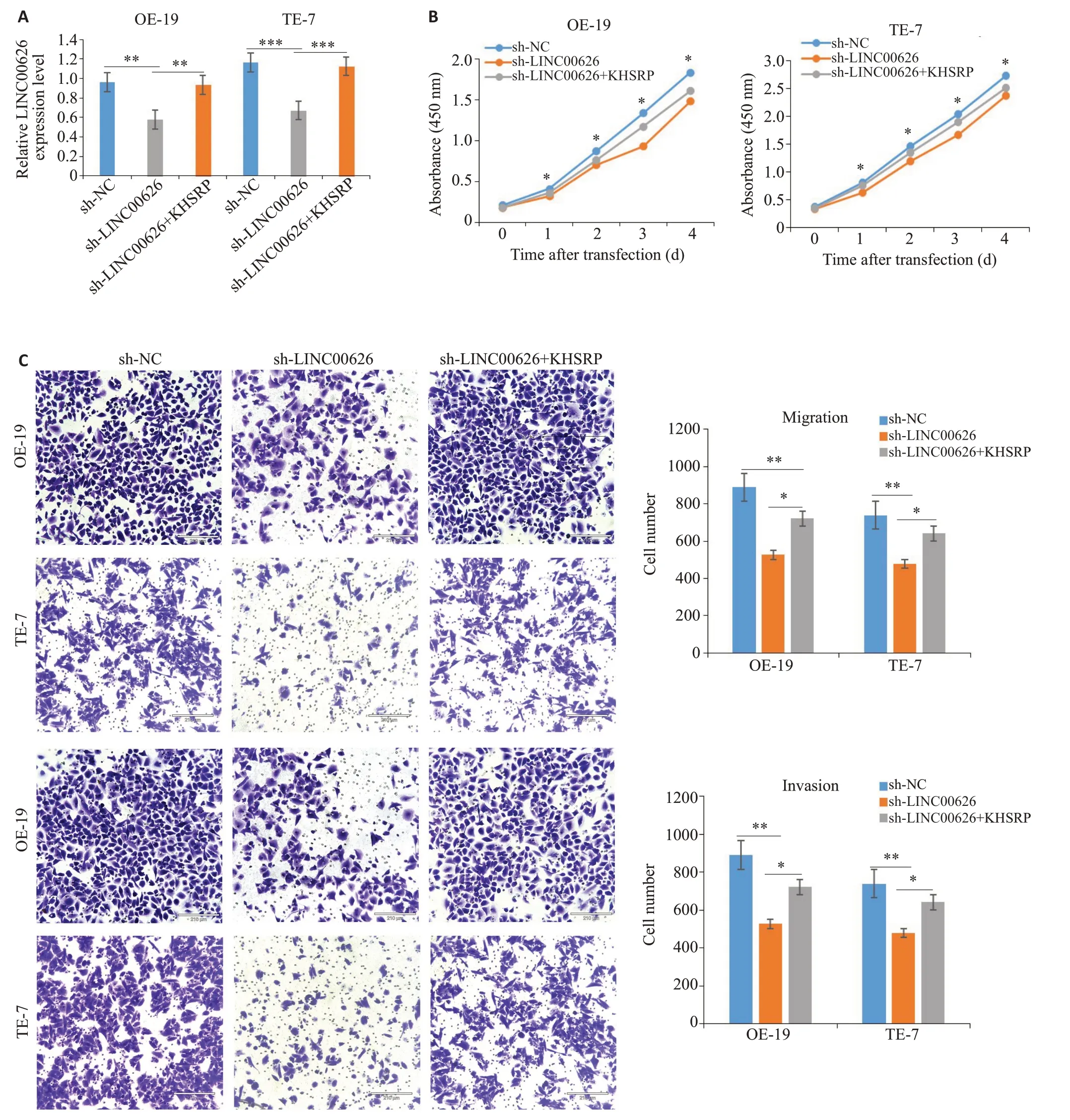
图8 KHSRP过表达可逆转sh-LINC00626对细胞增殖、迁移、侵袭能力的抑制作用Fig.8 Overexpression of KHSRP reverses inhibitory effect of LINC00626 knockdown on proliferation,migration,and invasion abilities of esophageal adenocarcinoma cells.A:qRT-PCR for detecting transfection efficiency of KHSRP in sh-LINC00626 cells.B: CCK-8 experiment for assessinhg cell proliferation. C: Transwell chamber assay for assessing cell migration and invasion(scale bar=210 μm).*P<0.05,**P<0.01,***P<0.001.
2.6 LINC00626在食管胃结合部腺癌中对JAK/STAT信号通路相关mRNA的调控作用
qRT-PCR 实验结果显示,与sh-NC 组相比,sh-LINC00626组中JAK1、p-JAK-1、STAT3 mRNA表达显著降低,JAK2、p-JAK2、STAT1、STAT2和STAT5 mRNA表达降低不明显(图9A,P<0.001)。与Vector组相比,LINC00626组JAK1、pJAK-1、STAT3 mRNA表达水平显著增高,JAK2、p-JAK2、STAT1、STAT2 和STAT5 mRNA表达增高不明显(图9B,P<0.05)。

图9 qRT-PCR 检验LINC00626对JAK/STAT信号通路相关mRNA表达情况的影响Fig.9 qRT-PCR for assessing the effect of LINC00626 on expressions of JAK/STAT signaling pathway.A:mRNA expression levels of JAK/STAT signaling pathway in cells with LINC00626 knockdown. B: mRNA expression levels of the JAK/STAT signaling pathway in cells overexpressing LINC00626.*P<0.05,**P<0.01.
2.7 LINC00626对JAK/STAT信号通路相关蛋白的调控作用
Western blot实验结果显示,与sh-NC组相比,sh-LINC00626 组中JAK1、p-JAK-1、STAT3 蛋白表达显著降低,JAK2、p-JAK2、STAT1、STAT2和STAT5蛋白降 低不明显(图10,P<0.05);与Vector 组相比,LINC00626组JAK1、p-JAK1、STAT3表达水平显著升高,JAK2、p-JAK2、STAT1、STAT2和STAT5蛋白升高不明显(图11,P<0.05)。

图10 Western blotting检测LINC00626对敲降组JAK/STAT通路相关蛋白表达情况的影响Fig.10 Western blotting of JAK/STAT pathway-related proteins in esophageal adenocarcinoma cell lines with LINC00626 knockdown.*P<0.05,**P<0.01.
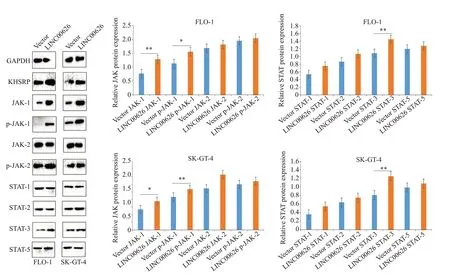
图11 Western blotting检测LINC00626对过表达组JAK/STAT通路相关蛋白表达情况的影响Fig.11 Western blotting of JAK/STAT pathway-related proteins in esophageal adenocarcinoma cell lines with LINC00626 overexpression.*P<0.05,**P<0.01.
3 讨论
lncRNA异常表达可以通过调节细胞增殖、迁移和侵袭来发挥肿瘤癌基因或抑制因子的作用[17],目前,许多lncRNA已被证实可以充当竞争性内源性RNAs在EGJ 的发生发展中发挥关键作用[18,19]。本研究发现LINC00626在EGJ组织和细胞系中表达显著上调,且LINC00626 可以促进EGJ 细胞的增殖、迁移和侵袭。ROC曲线分析表明LINC00626的高表达与EGJ的晚期肿瘤分期和淋巴结转移显著有关。这说明LINC00626是EGJ的一个潜在治疗靶点,它作为一个促癌基因,可以调节体内EGJ转移的恶性进展,在EGJ患者中具有重要的诊断价值。
JAK/STAT信号通路在癌症的发生和发展过程中发挥重要作用[20]。JAK(Janus激酶)是该通路中的酶类蛋白,可以磷酸化STAT(信号转导和转录激活子),使其进入细胞核并调节基因的转录,STAT1通常被描述为具有诱导细胞凋亡和细胞周期停滞能力的肿瘤抑制因子,相比之下,STAT3是抑制细胞凋亡的关键介质,并促进对转移、侵袭、增殖和血管生成至关重要的基因的转录[21]。在癌症发生过程中,JAK/STAT信号通路可以被异常激活或抑制,导致细胞增殖、分化、凋亡和炎症等生理过程的紊乱[22]。例如,肿瘤微环境中的炎症因子可以激活JAK/STAT信号通路,促进癌细胞的增殖和侵袭能力。此外,某些癌细胞可以通过突变激活JAK或STAT蛋白,导致细胞增殖和抗凋亡能力异常。Zhang等发现JAK/STAT信号通路的上调和STAT3的抑制可减少乳腺癌中的干细胞群[23]。本研究应用qRT-PCR 和Western blot实验确定JAK/STAT信号通路在EGJ中的表达变化。我们得出LINC00626和KHSRP参与JAK/STAT信号通路的表达,通过正向调控JAK/STAT信号通路中的JAK1和STAT3促进EGJ的恶性发生发展。
KHSRP是cGMP信号通路的一种肌动蛋白结合蛋白,具有调节细胞黏附、变形、移动和增殖的功能[24]。文献表明,KHSRP的异常表达在某些肿瘤疾病的发生中起到关键作用[25,26],Chen等[27]发现KHSRP在食管鳞状细胞癌(ESCC)中起致癌功能。Taniuchi等发现在胰腺癌中,KHSRP位于细胞核,敲低的KHSRP可以抑制胰腺癌细胞的侵袭和转移[28]。本研究通用qRT-PCR实验和WB实验证明LINC00626和KHSRP的mRNA和蛋白在EGJ中表达一致。细胞拯救实验表明,过表达KHSRP可消除敲降LINC00626对细胞增殖、迁移、侵袭能力的抑制作用。这证明了LINC00626与KHSRP之间存在相互作用关系,KHSRP可能是LINC00626的一个下游靶蛋白,LINC00626在EGJ中正向调控KHSRP的表达,从而促进EGJ的恶性进展过程。
综上所述,LINC00626在EGJ中表达上调,并与EGJ患者转移的恶性进程密切相关。LINC00626通过调节JAK1/STAT3/HKSRP轴抑制EGJ细胞增殖、侵袭和转移。本研究为EGJ的临床诊疗提供了一种新的分子标志物和潜在的治疗靶点。
